В настоящее время многими исследователями показано, что улучшение результатов хирургического лечения может быть достигнуто за счет обоснованной стратификации пациентов по риску осложнений, внедрения современных методов диагностики гнойно-септических состояний и реализации эффективных подходов поддерживающей терапии [9,10]. Адекватная оценка тяжести состояния больных с острыми хирургическими заболеваниями позволяет точнее прогнозировать вероятность исхода, сроки госпитализации и оценивать эффективность проводимого лечения [1, 12, 13, 16]. Однако интегральные шкалы оценки тяжести состояния APACHE 2, Ranson, Glasgow, MPM, SAPS требуют для сбора данных минимум 24-48 часов или не учитывают некоторые предикторы тяжести возможных осложнений [14,20]. Трудным аспектом является не всегда удовлетворительная калибровка шкал при решении конкретных задач, что связано с улучшением качества медицинской помощи, отличиями в диагностических категориях и наличием неклинических факторов, которые не могут быть измерены существующими шкалами [17, 19, 22].
Появление и широкое внедрение ЭВМ привело к прорыву в области прогнозирования, и были созданы устройства обработки информации, основанные на принципах работы биологических нейронных систем [11, 14]. Искусственные нейронные сети (ИНС) обладают уникальными возможностями, к числу которых относятся способность к решению задач классификации и к самообучению, функционирование при недостатке фактического материала, использование неограниченного количества параметров, использование обычного персонального компьютера и возможности клинического моделирования [5]. Перечисленные достоинства способствовали применению ИНС в решении различных медицинских задач [6, 18]. Однако данный подход чрезвычайно редко используется в ургентной хирургии.
В связи с этим особую актуальность приобретают возможность использования ИНС для прогнозирования течения и исходов острых хирургических заболеваний у больных в критических состояниях и усовершенствование на основе полученных данных методов диагностики и лечения данной категории больных.
Цель работы
Оценка эффективности методики искусственных нейронных сетей в стратификации больных с острым деструктивным и травматическим панкреатитами.
Материал и методы исследования
Настоящая работа основана на результатах клинического исследования 100 больных с острым деструктивным и травматическим панкреатитами (ОДТП). Все больные находились на лечении в отделениях реанимации и интенсивной терапии (ОРИТ) клиники. Критериями исключения из исследования были: возраст младше 18 или старше 80 лет, смерть наступившая в первые 48 часов госпитализации, декомпенсированные хронические состояния или иммуносупрессия. Конечными точками исследования были: 1) смерть от ОДТП; 2) гнойно-септические осложнения ОДТП; 3) длительность госпитализации. Тестовую выборку составили 14 пациентов с ОДТП, госпитализированных в 2006 г.
Диагностику острых хирургических заболеваний проводили согласно основным рекомендациям по нозологическим единицам. Диагноз ОДТП был основан на случаях с клиническими симптомами и биохимическими маркерами по критериям В.С.Савельева [3]. Определение и оценку физиологических нарушений проводили по общепринятым критериям: сопутствующих заболеваний по индексу M.E.Charlson [8]; органной дисфункции по критериям D.D.Tran и M.A.Cuesta [21]; синдрома системного воспалительного ответа (ССВО), сепсиса, тяжелого сепсиса, септического шока по критериям American College of Chest Physicians/Society of Critical Care Medicini (ACCP/SCCM, 1992). Распространенность панкреонекроза (<33%, 33-50%, >50%) определяли по результатам УЗИ/КТ или по операционным находкам. Инфицирование панкреонекроза было определено при микробиологическом исследовании аспирационного содержимого, либо на операции. Уровни прокальцитонина (ПКТ) определяли полуколичественным экспресс-методом наборами PCT-Q-test (BRAHMS Diagnostica GmbH, Germany). Интерпретацию результатов анализа проводили по M.Meisner [15]: концентрация ПКТ<0,5 нг/мл характерна для здоровых людей или локальной инфекции; концентрация ПКТ 0,5-2,0 нг/мл характерна для инфекции, сопровождаемой ССВО; концентрация ПКТ>2,0 нг/мл характерна для тяжелой бактериальной инфекции и сепсиса. Уровни лейкоцитарного индекса интоксикации (ЛИИ) Я.Я.Кальф-Калифа [2] были определены в соответствии с классификацией иммунодефицитных нарушений В.В.Чаленко [7].
В компьютерную базу данных (Microsoft Office Access) были включены пациенты, у которых в первые 24 часа госпитализации были собраны физиологические, биохимические и визуальные критерии для подсчета баллов по формализованным системам оценки тяжести состояния. 49 количественных и 30 качественных переменных были объединены в 6 категорий: 1) демографические данные; 2) физиологические переменные; 3) лабораторные тесты; 4) временные переменные; 5) данные о лечебных и диагностических вмешательствах; 6) исходы: умер, выжил. Были использованы следующие прогностические системы: 1) Acute Physiology and Chronic Health Evaluation (APACHE) 2; 2) Simplified Acute Physiology Score (SAPS)2; 3) Logistic Organ Dysfunction Score (LODS); 4) Mortality Probability Model (MPM); 5) Ranson; 6) Glasgow; 7) Risk of Infection to Severe Sepsis and Shock Score (RISSC); 8) Frank; 9) Injury Severity Score (ISS).
33 параметра по 5 категориям были выбраны для построения ИНС. Впоследствии количество входных данных было уменьшено путем пошагового регрессионного анализа. Непрерывная величина – длительность госпитализации была переведена в биномиальную величину определением точки разделения. Мерой служила медиана длительности госпитализации, которая составила для ОДТП 35 дней (от 23 до 58 дней). Трехслойные персептроны были построены по принципу прямого распространения сигнала для диагностики осложнений и прогнозирования исходов. При использовании ИНС во входные элементы подавались значения исходных переменных, затем последовательно отрабатывались нейроны промежуточных и выходного слоев. Пять или шесть переменных были входными откликами, скрытый слой содержал от 4 до 5 откликов, количество скрытых слоев было от 1 до 2, положительный или отрицательный исход был входным откликом. Выходные данные ИНС были ранжированы в диапазоне от 0,0 до 1,0 с наибольшей ценностью, соответствовавшей наивысшему отношению вероятностей положительного исхода. Нейронные сети были обучены и протестированы на всех случаях их базы данных с использованием алгоритма «back-propagation». Обучение ИНС было остановлено, когда индекс площади под кривой операционных характеристик (AUC) был максимальным для всех случаев. В качестве контроля была сконструирована традиционная прогностическая модель на основе многофакторного логистического регрессионного анализа (ЛРА).Входные варианты для модели ЛРА были аналогичны использованным для моделирования ИНС и были подвергнуты анализу с селекцией по алгоритму «forward». Во избежание эффекта «переобучения» критерий принятия варианты в модель устанавливали менее 5%.
Нормальность распределения количественных признаков оценивали критерием Колмогорова-Смирнова. Выборочные параметры представлены как среднее+стандартное отклонение при нормальном распределении; либо медиана (25-75% межквартильный разброс) при другом распределении; категорированные переменные представлены как абсолютная и относительная частота; операционные характеристики представлены с 95% доверительными интервалами (95% ДИ). Достоверность различий между непрерывными величинами оценивали с помощью t-теста Student или u-теста Mann-Whithey. Категориванные переменные сравнивали с помощью x2 –теста или точного метода Fisher. Относительную силу взаимосвязи между факторами риска и исходами определяли как отношение шансов (ОШ) с помощью логистического регрессионного анализа. Величина ОШ>1,0 означала важную этиологическую роль фактора; при ОШ=1,0 фактор не оказывал воздействия; ОШ<1,0 означало превентивное действие изучаемого фактора. Критическое значение двустороннего уровня значимости принимали как p,0,05. Для статистического сравнения прогностических моделей были выбраны операционные характеристики: 1) чувствительность; 2) специфичность; 3) пост-тестовая ценность. Прогностическую эффективность моделей оценивали путем дискриминации по индексу AUC. Эффективность модели признавали ограниченной при AUC≥0,70; хорошей при AUC≥0,80; превосходной при AUC≥0,90. Для статистического анализа использовали компьютерные программы NN PRO (Россия), Нейронные сети (Россия), MedCalc Software (Belgium).
Обсуждение результатов исследования
Средний возраст больных был 48,3+-14,2 года (21-79 лет), соотношение мужчины и женщины 1,56:1. Этиология ОДТП была желчнокаменная (43% случаев), алкогольная (31%), идиопатическая (15%) и смешанная (11%). Сопутствующие заболевания – сердца, легких, печени, почек, язва желудочно-кишечного тракта, сахарный диабет имели 49 больных, из них 34 больных (69,4%) имели по одному заболеванию, 15 больных (30,6%) имели от 2 до 4 заболеваний. 26 больных были с ожирением. У 50 больных развилась 121 органная дисфункция: дыхательная (29,8% случаев), сердечно-сосудистая (18,2%), почечная (14,9%), неврологическая (12,4%) и печеночная (11,5%). На долю гематологической дисфункции и кровотечений из «острых язв» желудочно-кишечного тракта приходилось 13,2% органных дисфункций. Инфицированный панкреонекроз был самым частым локальным осложнением, затем шли стерильный панкреонекроз, изолированные панкреатогенные абсцессы и псевдокисты. Изолированные локальные осложнения были у 39 больных, в 89 случаях было сочетание локальных осложнений с органной дисфункцией. Распространенность панкреонекроза была оценена <33 у 35 больных, 33-50% у 11 больных и >50% у 35 больных. Самой распространенной клинической формой гнойно-септических осложнений (ГСО) был сепсис (n=33), следом шли септический шок (n=13), тяжелый сепсис (n=11) и инфекция без ССВО (n=4). Летальные случаи были только среди больных тяжелым сепсисом и септическими шоком, летальность составила 41,7%.
Все больные с ОДТП были разделены на 2 группы: абдоминальных ГСО (n=49) и контрольную группу (n=51), состоящую из 12 больных с экстраабдоминальными ГСО (респираторный тракт, мочевыводящие пути, кожа и мягкие ткани, кровь) и 39 больных со стерильным панкреонекрозом без ГСО. Примерно равное количество больных умерло от абдоминальных ГСО и других причин, но длительность лечения в ОРИТ (p<0,01) и стационаре (p<0,01) была статистически значимо выше у больных с абдоминальными ГСО.
Статистически значимая взаимосвязь была между объемом панкреонекроза и частотой развития абдоминальных ГСО за счет больных с объемом некроза 33-50% (p<0,01). Минимальное количество критериев ССВО статистически значимо преобладало у пациентов контрольной группы (p<0,01), тогда как наличие 4 критериев ССВО статистически достоверно свидетельствовало о присутствии абдоминальных ГСО (p<0,05). Гектическая лихорадка (температура тела >39 0C) чаще присутствовала у больных без абдоминального ГСО (p<0,01), так же как длительность лихорадки свыше 3 дней была ассоциирована с абдоминальными ГСО (p<0,01). Уровни ЛИИ имели две точки разделения: уровень 0,5-2,0 единицы чаще присутствовал у больных без абдоминальных ГСО (p<0,05), уровень от 7,1-12,0 единицы был чаще представлен среди больных абдоминальными ГСО (p<0,05). Частота положительных результатов ПКТ-теста статистически значимо не отличалась между больными с абдоминальными ГСО и контролем. При сравнении распределений результатов ПКТ-теста по клиническим формам инфекции (сепсис, тяжелый сепсис, септический шок) была выявлена статистически достоверная разница в частоте встречаемости резко положительных результатов ПКТ-тестов у больных с септическим шоком.
Дискриминационная способность клинико-биохимических и визуальных критериев, оцененная по AUC, была низкой для всех критериев, и была статистически незначимой для ЛИИ и уровней ПКТ (табл.1).
Таблица 1. Дискриминационная способность клинических, визуальных и биохимических критериев в прогнозировании случаев абдоминальных ГСО

Нейронная сеть, сконструированная из вышеназванных критериев, обученная и протестированная по стандартному протоколу, показала самую высокую дискриминационную способность в прогнозировании случаев абдоминальных ГСО среди больных с ОДТП, статистически значимо больше по сравнению с другими моделями (рис.1). При чувствительности в 63,3% ИНС продемонстрировала самую высокую среди прогностических моделей специфичность в 88,2%, разница была статистически значимой в сравнении со шкалами APACHE 2, RISSC и критериями УЗИ/КТ ( p<0,05; p<0,01; p<0,01 соответственно). Вероятность правильной диагностики абдоминальных ГСО среди больных ОДТП, составила для ИНС 83,8%, что выше аналогичного показателя для ЛРА, шкал APACHE 2, RISSC и критериев УЗИ/КТ. В итоге ИНС продемонстрировала самую высокую прогностическую эффективность и корректно классифицировала по группам абдоминальных ГСО и контроля 76 больных, статистически значимо больше количества больных, классифицированных с помощью шкалы RISSC (табл.2).
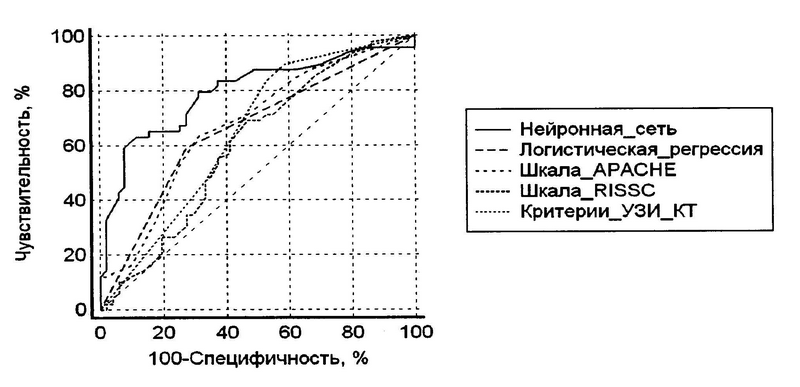
Рис. 1. Кривые операционных характеристик, построенные для прогнозирования случаев абдоминальных ГСО по моделям ИНС (AUC=0,79 +-0,04), ЛРА (AUC=0,66+-0,05; p=0,032), шкалам APACHE 2 (AUC=0,67+-0,05; p=0,036), RISSC (AUC=0,60+-0,06; p=0,001), визуальным критериям УЗИ/КТ (AUC=0,65+-0,05; p=0,032). Указаны стандартные ошибки и достоверности различий AUC по сравнению с нейронной сетью.
Таблица 2. Операционные характеристики ИНС, шкал APACHE 2, RISSC, критериев УЗИ/КТ в прогнозировании абдоминальных ГСО
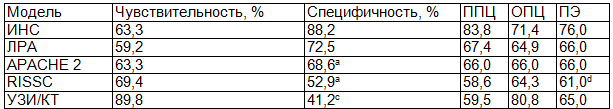
Примечания: aχ2=4,54; p<0,05; b χ2=13,64; p<0,01; c χ2=22,65; p<0,01; d χ2=4,54; p<0,05 по сравнению с ИНС. Здесь и далее: ППЦ – положительная прогностическая ценность; ОПЦ – отрицательная прогностическая ценность; ПЭ – прогностическая эффективность.
Смерть наступила у 21 больного с ОДТП: 14 больных умерло в первые 7 суток госпитализации, остальные больные умерли в сроки 22-68 суток. Основными причинами гибели были мультиорганная дисфункция и гнойно-септические осложнения.
Мы оценили способность моделей прогнозирования предсказывать госпитальную смерть среди больных с ОДТП (шкалы APACHE 2, Ranson, Glasgow, LODS, SAPS 2, MPM 20-24-48-72). Также с помощью методики регрессионного анализа были отобраны факторы риска неблагоприятного исхода (баллы по шкале комы Глазго [Glasgow Coma Scale], уровень глюкозы, частота дыханий, возраст, уровень креатинина), которые затем были включены в модели ИНС и ЛРА в качестве входных данных. Только две модели прогнозирования продемонстрировали способность различать умерших и выживших больных как хорошую (LODS [AUC=0,85] и MPM 224 [AUC=0,85] и три модели как превосходную (MPM 248 [AUC=0,95], ИНС [AUC=0,95], ЛРА [AUC=0,97]. При наилучшем соотношении чувствительности и специфичности ИНС и система MPM 248 продемонстрировали только по одному не диагностированному случаю смерти больных с ОДТП. ЛРА не распознавал 3 случая смерти, но продемонстрировал высокую специфичность прогноза, что отразилось в 3 переоцененных случаях. Остальные прогностические модели продемонстрировали низкую чувствительность. Доля случаев госпитальной смерти больных с ОДТП, корректно классифицированных ИНС, составила 90,1%, что сравнимо с аналогичным показателем для ЛРА и системы MPM 248 и статистически значимо больше, чем для шкал APACHE 2, Ranson, Glasgow (p=0,015; p=0,005; p=0,018 соответственно) (табл. 3).
Таблица 3. Операционные характеристики моделей прогнозирования госпитальной смерти у больных с ОДТП
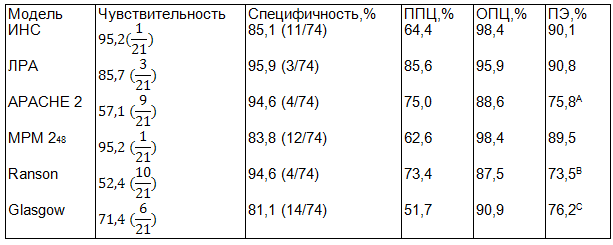
Примечания: a χ2=11,26; p<0,05; b χ2=15,43; p<0,01; c χ2=25,38; p<0,01; d χ2=7,72; p<0,01; по сравнению с ИНС. *Здесь и далее в скобках указаны ошибочные прогнозы.
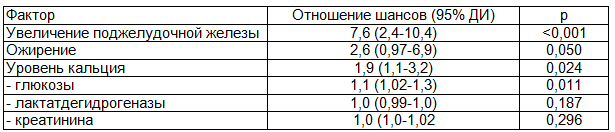
Больные с длительной госпитализацией имели статистически достоверно больше случаев развития инфицированного панкреонекроза и неспецифических послеоперационных осложнений (p<0,05 и p<0,01 соответственно) по сравнению с больными, выписанными из стационара ранее 35 дней. С помощью техники регрессионного анализа были отобраны варианты клинико-визуальных параметров и биохимических тестов, имевших наибольшее влияние на конечный прогноз – длительность госпитализации свыше 35 дней (табл.4).
Таблица 4. Влияние факторов различных типов на прогноз длительности госпитализации больных ОДТП
Модели ИНС (AUC=0,85) имели преимущества над моделями ЛРА (AUC=0,76) в прогнозировании длительности госпитализации, но без статистически значимой разницы (р=0,846). Дискриминационная способность ИНС была статистически значимо лучше, чем у шкал Ranson (AUC=0,55; p<0,01) и APACHE 2 (AUC=0,58; p<0,01) и визуальных критериев УЗИ/КТ (AUC0,68; p<0,05). При оптимальном соотношении чувствительности и специфичности ИНС продемонстрировала только 8 не прогнозированных случаев длительной госпитализации по сравнению с 36 случаями шкалы Ranson (χ2=33,91; p<0,01). Переоцененных прогнозов ИНС было статистически значимо меньше, чем для шкалы APACHE 2 (χ2=13,58; p<0,01) и критериев УЗИ/КТ (χ2=19,16; p<0,01). Доля корректных прогнозов для ИНС составила79,1%, что было статистически значимо больше, чем для шкал Ranson (χ2=10,57; p=0,006) и APACHE 2 (χ2=7,01; p=0,034).
При сравнении чувствительности и специфичности моделей ИНС и ЛРА на тестовой выборке больных ИНС показала сопоставимые результаты и продемонстрировала сравнимую с ЛРА способность прогнозировать летальные случаи (чувствительность 90,4% и 81,0% соответственно) и длительность госпитализации (чувствительность 72,1% и 60,5% соответственно) и превосходила ЛРА в прогнозировании случаев абдоминальных ГСО при ОДТП (чувствительность 66,7% и 51,2% соответственно).
Алгоритм лечебно-диагностических мероприятий при подозрении на ОДТП был разработан на основании собственного клинического опыта и данных литературы (рис.2).
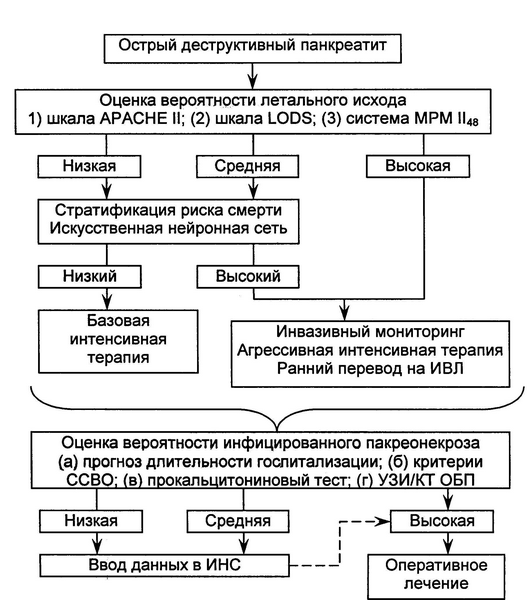
Рис. 2. Лечебно-диагностический алгоритм при остром деструктивном панкреатите. ОБП - органы брюшной полости.
На первом этапе проводилась клиническая оценка вероятности наличия ОДТП, которая базировалась на следующих признаках: 1) факторы риска; 2) абдоминальная боль, тошнота, рвота; 3) повышение амилазы крови в три раза и выше; 4) исключение по данным УЗИ и рентгенографии брюшной полости синдромо-подобных заболеваний; 5) ввод данных в ИНС. На втором этапе проводились те же исследования, что с учетом характера интенсивной терапии подтверждало диагноз ОДТП, уточнить локализацию и объем поражения поджелудочной железы. На третьем этапе с помощью ИНС оценивалась предполагаемая длительность госпитализации; с помощью критериев ССВО, лихорадки, ПКТ-теста и ИНС отслеживались начальные проявления ГСО. Максимальный показатель госпитальной летальности при ОДТП был отмечен в 2000 г. (25,4%), в дальнейшем наблюдалась отчетливая тенденция к снижению летальности, которая в тестовой группе составила 14,8%. Абсолютное снижение госпитальной летальности составило 10,6% (р=0,054).
Выводы
- Использование методики искусственных нейронных сетей позволяет корректно стратифицировать больных с острым панкреатитом по риску развития системных осложнений и летального исхода.
- Дискриминационная способность методики искусственных нейронных сетей статистически значимо не отличалась от методики логистического регрессионного анализа, но статистически значимо превосходила точность формализованных систем оценки тяжести состояния в диагностике гнойно-септических осложнений (p<0,01), прогнозировании длительности госпитализации (p<0,01) и летальных исходов (p<0,01) у больных с деструктивным панкреатитом.
- Ранняя идентификация пациентов группы риска по развитию осложненного течения заболевания позволила снизить летальность с 25,4 до 14,8% при деструктивном панкреатите и снизить длительность лечения в отделении интенсивной терапии среди выживших пациентов на 1 койко-день.
