Грыжи передней брюшной стенки являются одними из наиболее часто встречающихся заболеваний в хирургии. Вместе с тем наблюдается тенденция к увеличению встречаемости сочетанной патологии, в частности заболеваний бронхо-легочной системы, которые могут оказывать влияние на течение и прогноз основного заболевания в периоперационном периоде, особенно у лиц с грыжами больших размеров, герниопластика которых сопряжена с вероятностью развития синдрома абдоминальной компрессии [7].
Бронхиальная астма (БА) и хроническая обструктивная болезнь лёгких (ХОБЛ) являются широко распространёнными заболеваниями органов дыхания, входящими в число лидирующих причин временной нетрудоспособности и инвалидности [1]. Несмотря на то, что эти заболевания имеют ряд отличительных особенностей, связанных с различными типами воспалительного процесса респираторного тракта за счёт разных воспалительных клеток и медиаторов, дифференциальная диагностика ХОБЛ и БА порой представляет трудности для клинициста [5]. Сложность в диагностике наблюдается также в случаях сочетания ХОБЛ и БА у людей старше 35 лет с длительным анамнезом одного из указанных заболеваний [4]. Обычно ХОБЛ присоединяется к БА, причём для подобной смешанной патологии характерны свои особенности характера воспаления и клинического течения [2, 6].
Актуальным является поиск надёжных методов обследования, позволяющих верифицировать данные заболевания. Одним из наиболее часто встречающихся симптомов патологии бронхо-легочной системы является кашель, который в силу патогенетических механизмов своего формирования с участием мышц брюшной стенки может рассматриваться в качестве провоцирующего и поддерживающего процесс грыжеобразования фактора, а кроме того – как нередко наблюдаемый негативный симптом в послеоперационном периоде, отрицательно сказывающийся на течении последнего. Это определяет актуальность всестороннего исследования кашля, включая его анализ как звукового феномена, которое позволило бы на ранних этапах дифференцировать нозологии, проявлением которых он является.
Цель: выявить дифференциально-диагностические критерии при проведении спектрального анализа звука кашля у больных с грыжами передней брюшной стенки.
Материалы и методы. Обследованы 129 больных с грыжами передней брюшной стенки в сочетании с ХОБЛ легкой и средней степени тяжести (84 мужчины и 45 женщин, средний возраст 54,3 (42,5; 64,3) лет) и 112 больных с вентральными грыжами в сочетании с БА легкой и средней степени тяжести (72 женщины и 40 мужчин, средний возраст 48,5 (41,8; 65,1) лет).
Помимо общеклинических методов обследования всем пациентам проводили исследование звуков кашля с помощью спектральной туссофонобарографии (СТФБГ), представляющей собой компьютерный спектральный анализ звуков кашля, основанный на алгоритме быстрого преобразования Фурье [3]. Спектральный анализ звука кашля проводился у всех больных до и через 15 минут после ингаляции бронходилататора – беродуала (20 мкг ипратропиума бромида и 50 мкг фенотерола). Согласно методике, испытуемому, сидящему на стуле, устанавливался микрофон на расстоянии 15 см от полости рта. Перед проведением исследования больному подробно объясняли особенности правильного выполнения маневра кашля. Особое внимание обращалось на полноту вдоха перед выполнением кашлевого маневра. В случае отсутствия самостоятельного кашля больному ингалировали гипотонический раствор хлорида натрия для провокации кашля. Аналоговым способом мы усилили звуковые сигналы от микрофона для обеспечения возможности слухового контроля в процессе анализа. Все звуковые сигналы подвергались цифровой обработке в диапазоне частот 60-6000 Гц с 16-тибитным разрешением для компьютеризированного временно-частотного анализа с помощью быстрого преобразования Фурье с интервалом времени 10 мс. Благодаря этому разрешение для частот доходило до 11 Гц. Спектральная энергия звука кашля нормировалась к единице, что позволяло производить сравнительный анализ различных записей независимо от громкости звука.
Отдельные кашли были разделены на 3 фазы: 1-я фаза соответствовала быстрому открытию голосовой щели, 2-я – срединная, более продолжительная – соответствовала выходу воздуха из легких, 3-я – непостоянная – соответствовала закрытию голосовой щели в конце маневра кашля.
Оценивали временно-частотные параметры: Т (с) – общую продолжительность кашля, Т1 (с) – продолжительность 1-й фазы, Т2 (с) – продолжительность 2-й фазы, Т3 (с) – продолжительность 3-й фазы и распределение спектральной энергии по диапазонам частот (ВЧ – высокие частоты, СЧ – средние частоты, НЧ – низкие частоты). Исследование с помощью СТФБГ осуществляли при одновременном проведении визуального и слухового анализа каскадов кашля, а также каждого кашля в отдельности с последующим разложением на фазы.
Статистическая обработка результатов исследования производилась с помощью непараметрических методов пакета прикладных программ Statistica 6.0,. Численные значения параметров представлены в виде медианы, в скобках указаны 25% и 75% перцентили. Различия считали достоверными при уровне значимости р<0,05.
Результаты и их обсуждение. При оценке аналоговых записей звуков отдельных кашлей под контролем аудирования было выявлено, что у больных ХОБЛ кашель состоит из 3-х фаз: 1-ая фаза – открытие голосовой щели, 2-ая фаза – выход воздуха из лёгких через открытую голосовую щель, 3-я фаза – закрытие голосовой щели, в то время как у больных БА – из первых двух фаз (3-я фаза настолько мало выражена по сравнению с другими, что отдельно не определяется).
Для получения точного представления о частотном распределении звуковой энергии были вычислены средние значения процентного распределения относительной энергии звуков кашлей. Мы обнаружили, что у больных БА преобладает энергия высоких частот (600-5000 Гц), в то время как у больных ХОБЛ – энергия средних и низких частот, что обусловлено вибрацией различного по своим физико-химическим свойствам бронхиального секрета и стенок бронхиального дерева различного диаметра.
При анализе спектрограмм выявлены достоверные различия звуков кашлей больных ХОБЛ и БА по общей продолжительности, продолжительности отдельных фаз и наличию экстремумов амплитуды звуковой энергии. Наибольшее диагностическое значение представляет 2-ая фаза, отражающая изменения в дыхательных путях во время скоростного выхода воздуха из лёгких (табл. 1).
На спектрограммах кашлей больных ХОБЛ экстремум амплитуды 2-ой фазы находится на частоте выше 1500 Гц в сочетании с широкополосным подъёмом звуковой энергии в диапазоне до 600 Гц, который во время прослушивания напоминает «клокотание», а при анализе процентного распределения относительной энергии создаёт преобладание энергии средних частот.
У больных бронхиальной астмой во 2-й фазе мы наблюдаем гладкое, так называемое, «лысое» поле, у больных же ХОБЛ даже после отхождения мокроты во 2-й фазе имеется множество разноамплитудных экстремумов и никогда не наблюдается так называемого «лысого» поля как при БА, потому что в дыхательных путях лёгких всегда имеется бронхиальный секрет за счёт усиленной его секреции.
Таблица 1. Временные параметры звуков кашля в сравниваемых группах
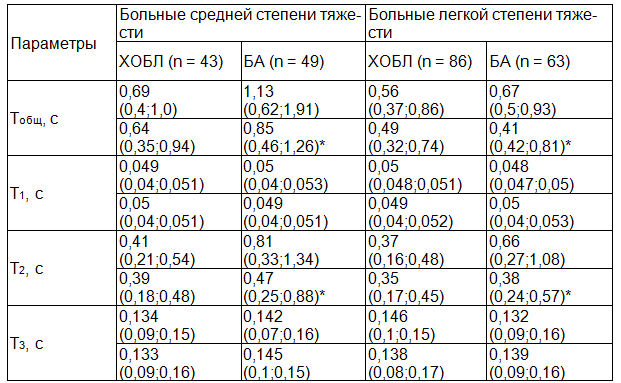
Примечание: * - различия параметров у больных ХОБЛ и БА достоверны при р<0,05. В числителе приведены значения до ингаляции беродуала, в знаменателе – через 15 мин. после ингаляции беродуала.
Были обнаружены изменения исследуемых параметров и в ходе проведения бронходилатационного теста. Так у больных хронической обструктивной болезнью легких и бронхиальной астмой происходят изменения следующих временных параметров. У больных БА продолжительность 2-ой фазы после ингаляции бронходилататора уменьшается. Продолжительность 2-ой фазы после ингаляции бронходилататора при ХОБЛ изменяется недостоверно или остается неизменной, что видимо, характеризует наличие необратимого компонента бронхиальной обструкции за счёт эмфиземы лёгких и пульмосклероза.
Происходит изменение и частотных параметров: у больных бронхиальной астмой отмечается смещение частот в зону низких за счёт устранения бронхиальной обструкции, которая участвует в формировании высокочастотных звуков, а у больных хронической обструктивной болезнью легких наоборот, происходит перераспределение частот в зону более высоких, так как после ингаляции бронходилататора, пациенты, как правило, откашливают мокроту, которая участвует в формировании звуков средних и низких частот (табл. 2).
Таблица 2. Частотные параметры звуков кашля в сравниваемых группах
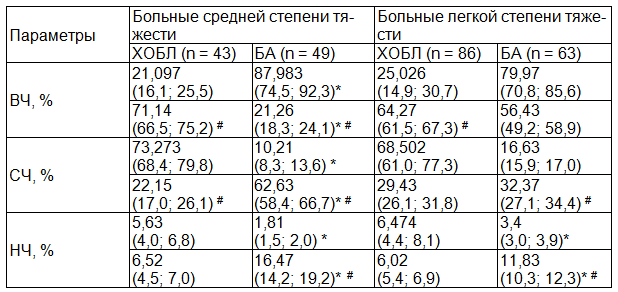
Примечание: * - различия параметров у больных ХОБЛ и БА достоверны при р<0,05; # - различия параметров до и после ингаляции беродуала достоверны при р<0,05. В числителе приведены значения до ингаляции беродуала, в знаменателе – через 15 минут после ингаляции беродуала.
Учитывая вышеизложенное, отличительной особенностью звуков кашля больных ХОБЛ является преобладание энергии средних частот во 2-ой фазе, по сравнению с кашлем больных БА, для которого характерна большая доля энергии высоких частот; а также различная ответная реакция на воздействие ингаляционных бронходилататоров: у больных БА происходит уменьшение продолжительности кашля за счёт 2-й фазы, при ХОБЛ же продолжительность 2-й фазы остаётся неизменной; у больных БА происходит смещение частот в зону низких, а у больных ХОБЛ наоборот, происходит перераспределение частот в зону более высоких.
Таким образом, критериями дифференциальной диагностики ХОБЛ и БА являются динамические изменения продолжительности 2-ой фазы и частотного распределения энергии звуков кашля, исследуемые с помощью СТФБГ при проведении бронходилатационного теста. Точная дифференциальная диагностика ХОБЛ и БА у больных с грыжами передней брюшной стенки в периоперационном периоде позволит осуществлять своевременный дифференцированный подход к назначению и коррекции лекарственной терапии, что предотвратит ухудшение течения патологии бронхо-легочной системы, таким образом, будет способствовать улучшению прогноза в послеоперационом периоде, снижению сроков госпитализации и нетрудоспособности.
