«Золотым стандартом» в хирургическом лечении вентральных грыж признана технология герниопластики без натяжения, а основным протезирующим материалом остается синтетический [1,2,4,5,10].
Широкое распространение сетчатых полипропиленовых эндопротезов различных конструкций и производителей не могут в полной мере удовлетворить хирургов, так как ведущей причиной неблагоприятных результатов операции являются дистрофические и дегенеративные изменения тканей брюшной стенки в области вмешательства, что неизбежно отражается на их регенераторном потенциале и приводит к снижению послеоперационных прочностных свойств с возможностью отторжения трансплантатов и формированию рецидива заболевания [2,3,6,8].
Перспективным направлением научного поиска по-прежнему остается разработка синтетических и биологических материалов с возможностью управления процессами формирования полноценного рубца в области герниопластики [7].
Известны отдельные экспериментальные и клинические исследования, посвященные применению диспергированных инъекционных форм аллотрансплантатов серии Аллоплант «стимулятор регенерации» в качестве дополнения к ауто- и аллопластическим способам герниопластики, направленные на стимуляцию местных тканевых репаративных процессов и профилактику инфекционных раневых осложнений [9].
Цель работы - изучить в эксперименте морфологические особенности формирования соединительнотканного регенерата при использовании в качестве протезирующего материала пластинчатый биоматериал технологии Аллоплант.
Материалы и методы. Экспериментальный раздел выполнен на 60 крысах-самцах одного возраста и массы с соблюдением регламентированных правил работы с лабораторными животными (разрешено биоэтическим комитетом ГБОУ ВПО «Ижевская государственная медицинская академия»ИГМА).
Для пластики модели грыжевого дефекта использован биоматериал технологии Аллоплант из твердой мозговой оболочки (изготовлен в тканевом банке ФГУ «Всероссийский центр глазной и пластической хирургии» г.Уфа в соответствии с требованиями ТУ42-2-537-2002).
Имплантация стерильных кусочков биоматериала Аллоплант из твердой мозговой оболочки размерами 1х1 см произведена по технологии «in lay» под апоневроз передней и переднебоковой брюшной стенки.
Оперативные вмешательства выполнены под эфирным масочным наркозом в сочетании с местной инфильтрационной анестезией для гидравлической препаровки субапоневротического пространства.
Забор морфологического материала осуществлен на 15-е и 30-е сутки иссечением зоны имплантации.
Изъятый экспериментальный материал маркировали; фиксировали в 10% растворе нейтрального формалина с последующей заливкой в парафин.
Серийные гистологические срезы толщиной 4-5 мкм готовили на микротоме. Использовали обзорные (гематоксилин и эозин) методы окраски. Всего изучено 120 объектов, 250 срезов.
Изучение срезов и фотосъемка выполнены на микроскопе МИКМЕД - 2 видеокамерой VIDEOLABE.
Морфометрическое исследование предоставленных гистологических образцов произведено на микроскопе Leica DM2500. Снимки были сделаны с помощью цифровой камеры Leica DFC420, разрешение 2592×1944 pixels.
Для анализа цифровых изображений использованы программы по морфометрии: подсчет площади - UTHSCSA Image Tool for Windows Version 3.00; подсчет количества клеток - ImageJ 1.33a (National Institute of Health, USA).
Результаты и обсуждение. При использовании в качестве трансплантата биоматериал Аллоплант, на 15 сутки эксперимента определяется неактивная фаза продуктивного воспаления с замещением трансплантата на волокнистую соединительную ткань; его гомогенизация со скудной воспалительной инфильтрацией, небольшим количеством полиморфно-ядерных клеток.
Воспалительный инфильтрат преимущественно представлен единичными клетками лимфоидного ряда, что свидетельствует о незначительной клеточной иммунной реакции.
В этих же участках наблюдается пролиферация и скопление фибробластов, мигрирующих по ходу коллагеновых волокон; признаки новообразования капилляров (рис. 1).
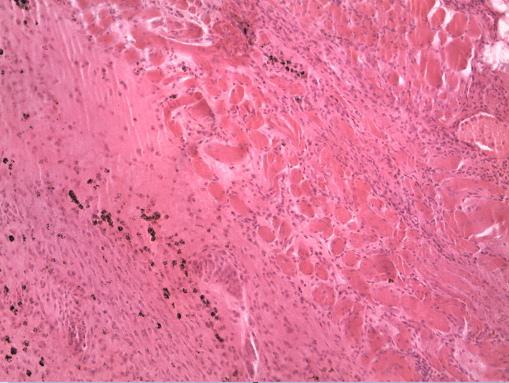
Рис. 1. Пролиферация волокнистой соединительной ткани с новообразованием сосудов в области биоматериала Аллоплант (увеличение ×200; окраска гематоксилин и эозин).
В центральной части формируемого регенерата из общей площади изученного среза (80207,04 кв. мкм) площадь новообразованных сосудов составила 5096,7 кв. мкм (6,35% от площади среза).
В клеточном составе визуализированы преимущественно фибробласты, сегментоядерные лейкоциты, клетки системы фагоцитирующих мононуклеаров и лимфоциты.
В периферической зоне исследуемых регенератов (80207,04 кв. мкм) общая площадь новообразованных сосудов составила 3787,46 кв. мкм (4,72% от площади среза); тромбированные сосуды составили 1295,99 кв. мкм (1,62%). Клеточный состав исследуемой зоны представлен в подавляющем количестве фибробластами и фиброцитами.
Морфологическая картина на 30 сутки при подапоневротическом размещении биоматериала Аллоплант характеризуется развитием зрелой соединительной ткани с множеством новообразованных сосудов и скудной мононуклеарной инфильтрацией по периферии трансплантата.
При этом трансплантат замещается на зрелую грануляционную ткань с незначительной макрофагальной реакцией и выраженным фибропластическим процессом с активным васкулогенезом в пролиферативной зоне (рис. 2).
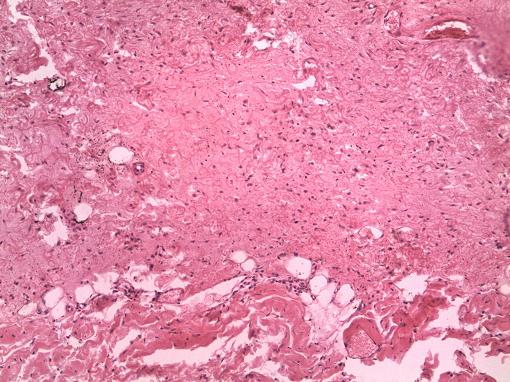
Рис. 2. Замещение биоматериала Аллоплант зрелой соединительной тканью с активным васкулогенезом (увеличение ×200; окраска гематоксилин и эозин).
В центральной части регенерата из общей площади изученного объекта площадь новообразованных сосудов составила 4778,99 кв.мкм (5,96% от площади среза).
В периферическом отделе формируемого регенерата общая площадь новообразованных сосудов при применении биоматериала Аллоплант составила 5475,45 кв.мкм (6,83% от площади среза) с площадью тромбированных сосудов 1726,71 кв.мкм. Клеточный состав периферии регенерата представлен фибробластами и лимфоцитами.
В исследуемых объектах с биологическим материалом Аллоплант обнаружено незначительное количество тканевых базофилов, расположенных периваскулярно по ходу стенки вен малого калибра и сосудов микроциркуляторного русла, а также единичные между волокнами соединительной ткани.
Выявленная особенность может указывать на отсутствие при применении технологии Аллоплант клеточного компонента, провоцирующего развитие местной аллергической реакции, а также отсутствие микроциркуляторных нарушений в зоне имплантации биоматериала.
Выводы
- Применение биоматериала технологии Аллоплант в экспериментальных условиях индуцирует формирование соединительнотканного регенерата в ранние сроки с незначительной макрофагальной реакцией, выраженным фибропластическим процессом и активным васкулогенезом.
- Пластинчатый биоматериал из твердой мозговой оболочки технологии Аллоплант может рассматриваться как альтернатива другим биологическим протезирующим материалам в экспериментальной и клинической герниологии.
