Актуальность
Лечебные и диагностические вмешательства на печени под ультразвуковым контролем получили в последнее время широкое распространение. В России ежегодно выполняется не менее 12000 таких операций [1,2]. Диагностические вмешательства представлены в основном чрескожной биопсией очаговых образований, лечебные – пункционно-дренирующими операциями при жидкостных образованиях, а также малоинвазивными методами лечения первичного и метастатического рака печени, к которым относятся радиочастотная аблация, криовоздействие и введение этанола. Преимуществами малоинвазивных операций под ультразвуковым контролем являются малая травматичность, косметический эффект, возможность выполнения их под местной анестезией и экономичность.
Вместе с тем, частота осложнений при этих вмешательствах по данным различных авторов составляет 2-5% и не имеет тенденции к снижению [3,4]. Учитывая рост количества операций, абсолютное число случаев осложнений также растет. К наиболее часто встречающимся осложнениям относятся внутрибрюшное кровотечение, местный перитонит вследствие подтекания содержимого кисты или абсцесса в брюшную полость, некроз и инфекция в области внутрипеченочного воздействия, повреждения диафрагмы, пневмо- и гемоторакс и другие. В сообщениях различных авторов, посвященных этой проблеме, можно найти указания на необходимость учитывать такие факторы риска осложнений, как состояние свертывающей системы крови, наличие асцита и/или желтухи, диаметр пункционного канала, поведение больного. Однако изолированная оценка значимости этих факторов, которая присутствует в большинстве работ, не позволяет в достаточной мере прогнозировать развитие осложнений или нежелательных явлений, поскольку факторы риска могут действовать разнонаправлено. Ряд исследователей считают, что наиболее точно определить вероятность тех или иных периоперационных событий можно лишь с помощью создания математических прогностических моделей на основе современных методов статистического анализа [5-7]. Практическое применение этих моделей позволит не только быстро определить противопоказания к тому или иному вмешательству, но и разработать меры профилактики возможных осложнений.
Цель исследования: разработать алгоритм профилактических мероприятий при чрескожных миниинвазивных вмешательствах на печени в группах пациентов с различным риском периоперационных осложнений и оценить его эффективность
Характеристика клинических наблюдений и методов исследования
В исследование были включены 263 пациента с очаговыми и диффузными заболеваниями печени, находившихся на обследовании и лечении в Дорожной клинической больнице Ювжд и в центре амбулаторной хирургии 7 городской поликлиники г. Воронежа. Первичные злокачественные новообразования печени были представлены гепатоцеллюлярным раком (8 пациентов; 3,0% от всех больных), холангиокарциномой (3 пациента; 1,1%). Метастатические опухоли печени имелись у большинства (45,2%) пациентов, при этом преобладали метастазы колоректального рака (88 пациентов; 33,5%). Непаразитарные кисты печени (60 пациентов; 22,8%) имели неосложненное течение у 54 пациентов, в 6 случаях наблюдались осложнения кист в виде инфицирования содержимого или кровоизлияния в полость кисты. У 43 пациентов, вошедших в исследование (16,3%), имелись дифффузные поражения печени, которые требовали инвазивных методов уточняющей диагностики. Среди пациентов с доброкачественными новообразованиями печени (30 человек; 11,4%) у 19 больных была диагностирована гемангиома печени, у 6 – нодулярная гиперплазия, у 4 – гепатоцеллюлярная аденома, у 1 больного был поставлен диагноз воспалительной псевдоопухоли печени. Из анализа были исключены пациенты с паразитарными кистами печени, больные с клинически выраженной механической желтухой, первичными холангиогенными абсцессами печени, а также пациенты с терминальными стадиями злокачественных новообразований и сопутствующих заболеваний.
Всем пациентам, включенным в исследование, были произведены те или иные чрескожные миниинвазивные вмешательства. Диагностические операции были представлены биопсиями объемных образований или паренхимы печени (161 операция), лечебные – пункционно-дренирующими вмешательствами при кистах печени и РЧА при опухолях (127 операций).
Всего при проведении миниинвазивных хирургических вмешательств на печени у наших пациентов было зарегистрировано 26 периоперационных осложнений. Таким образом, частота осложнений составила 9,03 случаев на 100 операций или 9,89 случаев на 100 больных. Большинство осложнений протекали в легкой форме: в 19 случаях из 26 (6,6% от всех операций) степень тяжести осложнений трактовалась как первая или вторая. Осложнения 3-5 степени тяжести наблюдались в 9 случаях (3,1% от всех операций). Умер 1 пациент, общая летальность составила 0,38%. Эти показатели в целом соответствуют статистике других авторов.
Наиболее часто осложнения наблюдались у пациентов, которым проводилась радиочастотная термоаблация опухолей печени (в 10 случаях на 72 операции или 13,9%). Частота осложнений при пункционной биопсии паренхимы печени при диффузных поражениях органа составила 12,8% (5 случаев); при биопсии очаговых образований – 5,7% (7 случаев); при пункционно-дренажном лечении непаразитарных кист печени – 7,3% (4 случая). У 4 пациентов одновременно наблюдалось 2 и более осложнений.
Статистически значимыми положительными предикторами риска развития периоперационных геморрагических осложнений (унивариантный анализ) являлись следующие 8 факторов (из 14 анализируемых): наличие у пациента явной или скрытой коагулопатии (КП), фиброза или цирроза печени (ЦП), острой печеночной недостаточности и/или выраженного холестаза (ДП), технических трудностей при выполнении вмешательства (ТТ), диаметр пункционного канала свыше 1,6 мм (ДК), неоднократное прохождение инструмента через паренхиму органа (ПИ), опасная локализация объемного образования (ОЛ) и беспокойное поведение пациента во время и после вмешательства (БП). Округленные до целых величин значения отношения шансов (OR) для этих факторов, полученные при анализе таблиц сопряженности, легли в основу расчета балльного индекса риска геморрагических осложнений (ИРГО), который вычисляли по формуле:
ИРГО=КП+ЦП+ДП+ТТ+ДК+ПИ+ОЛ+БП,
где «вес» каждого фактора при его наличии составляет округленное до целой величины значение отношения шансов (OR), при отсутствии данный показатель равен 0.
Ретроспективно мы разделили всех пациентов данного этапа исследования на 3 группы риска: низкий (0-4 балла), средний (5-12 баллов) и высокий (свыше 12 баллов).
Обоснованность предложенной стратификации степени риска осложнений с использованием разработанного индекса подтверждали регистрацией частоты и характера осложнений в каждой группе. На основании полученных данных и накопленного клинического опыта был разработан алгоритм профилактики осложнений с учетом стратификации риска осложнений, который в полной мере был внедрен в практику работы клиники с 2010 г. Для оценки эффективности алгоритма мы провели сравнительный анализ частоты и характера осложнений в период 2009 – 2011 г.
Результаты
В группу низкого риска вошли 104 пациента, у которых наблюдалось 1 геморрагическое осложнение (0,96%) и 1 местная аллергическая реакция; в группу среднего риска оказались 70 пациентов, у которых процент геморрагических осложнений составлял 8,6% (n=6), другие осложнения наблюдались у 5 пациентов (у 2 пациентов они развились совместно с геморрагическими осложнениями); наконец, в группе высокого риска (29 больных) геморрагические осложнения произошли у 7 человек (24,1%), другие осложнения – у 6 пациентов (также у части больных они наблюдались совместно).
При разработке алгоритма профилактических мероприятий (рис. 1) мы принимали во внимание тот факт, что риск периоперационных осложнений может меняться в зависимости от операционной ситуации, поэтому разделили оценку риска на предварительную (до начала вмешательства) и окончательную (после завершения операции и выхода из анестезии). Соответственно, на последнем этапе могут потребоваться дополнительные меры профилактики развития осложнений.
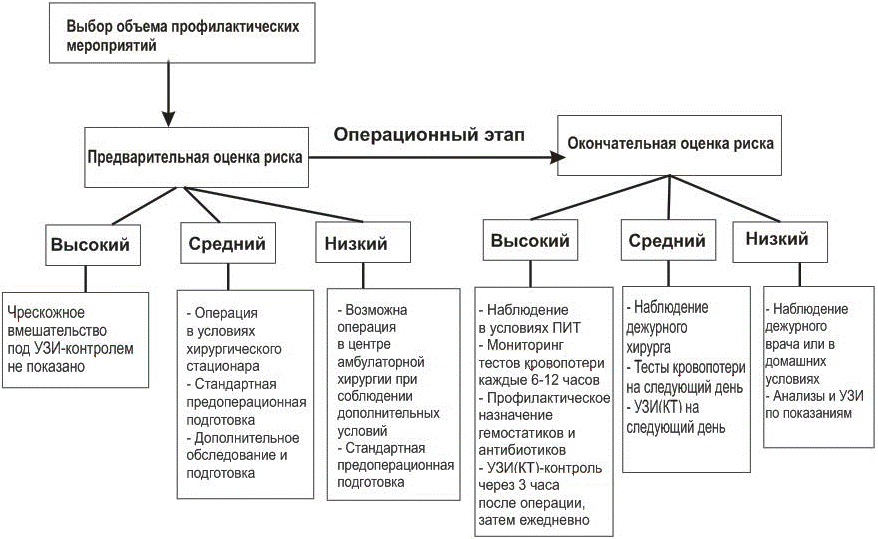
Рис. 1. Алгоритм профилактики осложнений при миниинвазивных чрескожных вмешательствах на печени.
Также, как и многие другие авторы, мы считаем, что пациентам с заведомо высоким риском осложнений, имеющим патологию свертывающей системы, тяжелые нарушения структуры и функции печени в сочетании с предполагаемыми техническими трудностями проведения вмешательства, проведение лечебного или диагностического интервенционного вмешательства под контролем УЗИ без возможности визуальной оценки поверхности печени и немедленного гемостаза противопоказано. Этим пациентам можно рекомендовать пункционное вмешательство трансъюгулярным доступом или под контролем лапароскопии. В нашей клинике мы трижды использовали лапароскопию для биопсии печени в небезопасных ситуациях, и во всех случаях надежно предупреждали крово- и желчеистечение в послеоперационном периоде с помощью коагуляции дефекта и/или оментопексии.
У пациентов со средним риском развития осложнений чрескожное вмешательство на печени, по нашему мнению, должно выполняться только в условиях хирургического стационара, имеющего необходимое оснащение и специалистов для проведения открытых и лапароскопических операций на органах брюшной полости, включая операции на печени и желчевыводящих путях.
Как уже было сказано выше, важным фактором риска развития осложнений являются технические трудности выполнения вмешательств связанные с «неудобным» расположением и/или плохой визуализацией объекта в печени. В таких случаях эффективным методом предупреждения осложнений еще на дооперационном этапе служит проведение ультразвукового сканирования печени в сочетании с цветокодированными методиками (цветное допплеровское картирование и энергетическое допплеровское картирование), что имеет важное значение для определения взаимоотношения объемного образования и крупных сосудов печени, а также использование метода трехмерной реконструкции изображения.
Трехмерная реконструкция выполнялась нами у 54 пациентов с помощью программного обеспечения, интегрированного в ультразвуковой сканер: производилась обработка информации, полученной при детальном сканировании «зоны интересов» за счет формирования совокупности полученных срезов одного и того же объекта из одного и того же акустического доступа при панорамном сканировании. В своей работе использовали следующие серошкальные режимы трехмерной реконструкции объемного массива:
- трехплоскостная развертка трехмерного массива изображения в про-
дольной, поперечной и коронарной плоскостях - многоплоскостная раз-
вертка объемного массива (МПР);
- кубическая объемная реконструкция непрозрачной поверхности объемного массива (НП);
- режим изменяемой прозрачности объемного массива (ИП) - изменение прозрачности путем регулировки яркости, контрастности, цветового фона.
С целью более конкретного изучения отдельных участков изображения, устранения возможных артефактов, улучшения наглядности полученных изображений, использовали дополнительные режимы ротации (от 0 до 360°) и сегментации в различных плоскостях.
Трехмерную реконструкцию сосудистых структур выполняли при сочетании В-режима и режимов цветного допплеровского картирования и энергетического допплеровского исследования. Основными задачами этого исследования являлись: улучшение визуализации магистральных сосудов, прилежащих к объемному образованию, определение степени компрессии этих сосудов, смещения и деформации сосудистого рисунка, наличие безопасного акустического доступа в бессосудистой зоне для выполнения малоинвазивных вмешательств.
Таким образом, к существенным преимуществам трехмерной реконструкции можно отнести формирование наглядной объемной структуры:
- определение положения и формы объемного образования, состояние окружающей паренхимы;
- получение изображения внутренней поверхности, детализация рельефа и строения стенок кистозной полости;
- детализация расположения объемного образования по отношению к крупным артериальным и венозным сосудам.
В нашем исследовании ни у одного пациента, которым выполнялась трехмерная реконструкция, не наблюдалось осложнений, связанных с фактором технических трудностей.
Среди других мер, позволяющих снизить вероятность осложнений на предоперационном этапе, можно назвать рациональный подход к выбору диаметра иглы для пункционной биопсии объемного образования в печени, особенно у пациентов с явлениями цирроза или фиброза печени. В ряде случаев тонкоигольная аспирационная биопсия с последующим квалифицированным цитологическим исследованием позволяет добиться не менее информативного результата.
Как уже отмечалось ранее, в ходе выполнения чрескожного вмешательства могут возникнуть дополнительные обстоятельства или факторы, влияющие на риск осложнений. В этих случаях окончательная оценка риска с помощью расчета суммарного балльного индекса позволяет осуществить дифференцированный подход к выбору профилактических (а при необходимости и лечебных) мероприятий с учетом окончательной стратификации риска. Так, если риск развития осложнений у пациента расценивается как высокий, то мы рекомендуем в первые сутки после операции наблюдать за пациентом в условиях отделения (палаты) интенсивной терапии; каждые 6-12 часов исследовать кровь на показатели, характеризующие наличие и степень кровопотери (тесты кровопотери), а именно, на содержание гемоглобина и эритроцитов, гематокрит и удельный вес крови; не менее 1 раза в сутки исследовать состояние свертывающей системы по приведенным выше тестам; назначать с профилактической целью гемостатическую и антибактериальную терапию, а также проводить ультрасонографический и/или КТ мониторинг с первым исследованием не позднее, чем через 3 часа после операции. При среднем риске осложнений больной может наблюдаться в палате, но с обязательным осмотром дежурного хирурга. На следующий день проводится УЗИ и определяются тесты кровопотери.
Пациентам с исходно низким риском осложнений на предоперационном этапе проводятся стандартные обследования и подготовка, а после операции достаточно наблюдения дежурного врача. У амбулаторных пациентов функцию наблюдения осуществляют ухаживающие лица или родственники. Дополнительные инструментальные и лабораторные исследования назначаются по показаниям. Если риск осложнений в процессе выполнения вмешательства возрос и сменился на средний или высокий, пациента следует вести в соответствии с новой стратификацией риска, а амбулаторного пациента направить для дальнейшего наблюдения в стационар.
В целом применение разработанного алгоритма в клинике позволило снизить общую частоту осложнений при чрескожных миниинвазивных вмешательствах на печени с 9,0% в 2009 г. до 3,1% в 2011 г. (рис. 2).
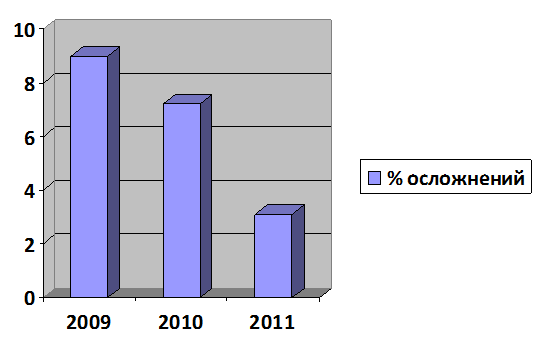
Рис. 2. Динамика частоты осложнений при чрескожных миниинвазивных вмешательствах на печени.
Практическое использование разработанного способа прогнозирования осложнений можно продемонстрировать на следующих клинических примерах:
- Больной Т., 49 лет, ИБ № 9742, поступил в ХО-1 ДКБ Ювжд 1.10.2006 г. с диагнозом: рак прямой кишки 4 ст., метастаз в правую долю печени, состояние после брюшно-анальной резекции прямой кищки в 2005 г. Общее состояние пациента при поступлении удовлетворительное, в общем и биохимическом анализах крови патологии не выявлено. Число тромбоцитов=180х109/мм3, протромбиновый индекс=87%, АЧТВ=34 с., MHO=1,1. При ультразвуковом исследовании печени лоцируется объемное образование в 8 сегменте диаметром 4 см, расположенное в 0,9 см от правой печеночной вены. Ткань печени диффузно неоднородна, с мелкими гиперэхогенными включениями (признаки фиброза). Ранее проведена биопсия опухоли под УЗК: заключение – метастаз аденокарциномы. Больному планировалось проведение радиочастотной термоаблации метастаза в печени чрескожным доступом. Однако при расчете индекса риска геморрагических осложнений (ИРГО) обнаружено, что у данного пациент имеется 3 положительных предиктора геморрагических осложнений, а именно наличие фиброза печени (5 баллов), расположение объекта вблизи от крупного кровеносного сосуда (5 баллов) и большого диаметра пункционного канала – свыше 1,6 мм (7 баллов). Общий ИРГО был равен 5+5+7=17 баллов, что позволяло отнести данного пациента к группе высокого риска. В связи с этим от чрескожной манипуляции под контролем УЗИ решено воздержаться, а процедуру РЧА провести под непосредственным визуальным контролем при минилапаротомии с интраоперационным УЗИ, что и было сделано. После окончания сеанса РЧА и удаления операционных электродов из дефекта ткани печени наблюдалось интенсивное кровотечение, которое хорошо визуализировалось через операционную рану и было сразу же остановлено электрокоагуляцией. Таким образом, использование предлагаемого подхода к профилактике осложнений с учетом стратификации риска позволило своевременно внести коррективы в план хирургического лечения и избежать серьезного осложнения.
- Пациент К., у которого предполагалось проведение пункционной биопсии опухоли печени (подозрение на гепатоцеллюлярную карциному) на фоне нормальной сонографической картины непораженных участков печени, без грубых функциональных нарушений и без признаков коагулопатии. До операции риск развития осложнений расценивался как низкий (ИРГО =0). Во время проведения операции ситуация изменилась: пациент вел себя беспокойно, недостаточно четко выполнял распоряжения врача (например, по задержке дыхания); при первом прохождении было получено мало материала, поэтому пришлось биопсию повторять. С учетом операционной ситуации возникли дополнительные факторы развития осложнений (ПИ и БП), и индекс ИРГО возрос до 9 баллов (средний риск осложнений), что потребовало проведения дополнительных профилактических мероприятий (гемостатическая терапия). Ближайший послеоперационный период протекал без осложнений и больной был выписан домой через сутки после операции. Таким образом, использование алгоритма профилактики геморрагических осложнений позволило своевременно внести коррективы в послеоперационное ведение больного и избежать серьезного осложнения.
Выводы
- Выбор профилактических мероприятий при чрескожных миниинвазивных вмешательствах на печени следует осуществлять с учетом стратификации риска возможных периоперационных осложнений.
- Разработанный алгоритм профилактики осложнений при миниинвазивных чрескожных вмешательствах на печени позволяет снизить частоту этих осложнений более, чем в 2 раза.
