Патология трикуспидального клапана продолжительное время не привлекала достаточного внимания хирургов, а сам клапан получил название «забытого» [1]. Однако, по мере накопления знаний о гемодинамике правых отделов сердца, роли в ней трехстворчатого клапана и с развитием хирургического и анестезиологического пособий, трикуспидальному клапану стали уделять гораздо большее исследований. В настоящее время среди пациентов, требующих оперативной коррекции клапанной патологии сердца, 8-35% имеют клинически значимые изменения на уровне правого атриовентрикулярного отверстия [2]. Более активный подход к хирургическому лечению больных трикуспидальным пороком, влечет за собой проблему повторного вмешательства в отдаленном периоде. Частота возврата выраженной недостаточности трехстворчатого клапана после первичной коррекции митрально-трикуспидального порока, при динамическом наблюдении составляет 10-16% [3]. Среди хирургов нет единого мнения о выборе тактики при повторной операции: отсутствуют однозначные данные о необходимости протезирования или сохранения несостоятельного клапана, не определены критерии в пользу того или иного вида аннулопластики. Недостаточно знаний также об особенностях эксплантации скомпрометированных биологических протезов из трикуспидальной позиции. В настоящей работе, на основании опыта клиники ФГБУ «НИИПК им. акад. Е.Н. Мешалкина», мы представили свое мнение по поводу перечисленных выше проблем.
Материал и методы исследования. В основу работы положен анализ результатов обследования и хирургического лечения 80 взрослых больных, оперированных с 1999 по 2012 г. Средний возраст пациентов составил 51±11 (18-72) лет. Структура первичных вмешательств на трикуспидальном клапане выглядела следующим образом: протезирование клапана – 12 (15%) больных, шовная аннулопластика – 21 (26%). У 47 (59%) пациентов на первичной операции вмешательство на трехстворчатом клапане не производили. Из 80 больных у 58 (72%) ритм сердца был представлен мерцательной аритмией, у 15 (19%) был сохранен синусовый ритм, у 7 (9%) больных ритм навязывался постоянным электрокардиостимулятором. Среднее время от последней операции до развития гемодинамически значимых нарушений на уровне правого атриовентрикулярного отверстия составило 10±8 (1-36) лет. Все операции проводили в условиях искусственного кровообращения. При необходимости вмешательства только на трикуспидальном клапане (9 пациентов) предпочитали не выполнять окклюзию аорты, а проводить основной этап в условиях работающего сердца. Показанием к выполнению пластики трехстворчатого клапана было отсутствие выраженных морфологических изменений створок и подклапанных структур собственного клапана (грубый фиброз, сращение створок и подклапанных хорд, разрывы створок). Дисфункция биологического протеза была абсолютным показанием к репротезированию клапана во всех случаях. Все пациенты перед операцией заполняли информированное согласие по принятой в клинике форме. Анализ полученных данных проводили в программе «Statistica 7.0» (Statsoft Inc., США), используя методы параметрической статистики. Уровень отклонения нулевой гипотезы о недостоверности различий (р) принимали равным 0,05.
Результаты исследования. Среди пациентов, которым выполнили пластическую коррекцию трикуспидального порока, у 28 (41%) использовали опорное кольцо «МедИнж» (рис. 1). Размер опорного кольца варьировался от 28 до 36 (32±2) мм и подбирался исходя их конституциональных особенностей, размеров полостей правых предсердия и желудочка, давления в легочной артерии и выраженности дилатации фиброзного кольца. Основным показанием к применению опорной конструкции было увеличение большой оси фиброзного кольца клапана более 50 мм. В таблице 1 представлены до и интраоперационные характеристики пациентов в зависимости от выбранного метода пластики.
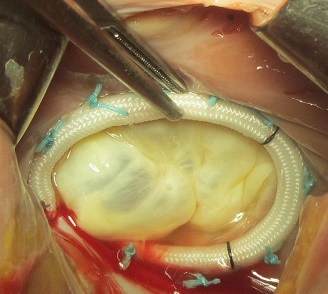
Рис. 1. Опорное кольцо в трикуспидальной позиции.
Таблица 1. До и интраоперационные характеристики пациентов, которым выполнили аннулопластику трикуспидального клапана.
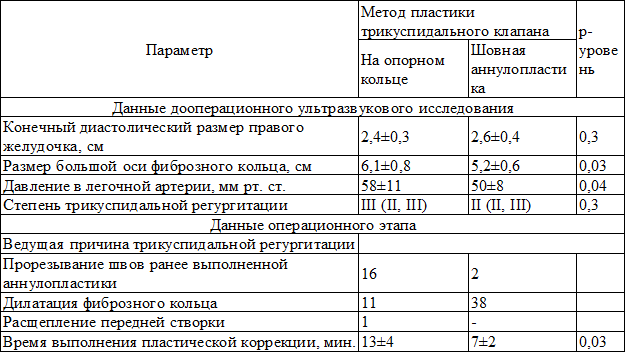
Имплантация опорного кольца требует бóльших временных затрат, но является, на наш взгляд, оправданной процедурой в тех случаях, когда шовная аннулопластика уже доказала свою неэффективность – в 16 случаях непосредственной причиной возврата трикуспидальной регургитации явилось прорезывание нити через фиброзное кольцо. При дилатации фиброзного кольца в пределах 5,2±0,6 см мы старались выполнить шовную аннулопластику при условии, что на первичной операции не проводилось вмешательств на трехстворчатом клапане, либо не было признаков прорезывания ранее проведенной нити. Стоит отметить, что пациенты, которым имплантировали опорную конструкцию, имели не только более выраженную дилатацию фиброзного кольца, но и более высокий уровень систолического давления в легочной артерии (58±11 против 50±8), что также служило основанием для применения опорного кольца. В одном случае мы определили расщепление передней створки трикуспидального клапана как ведущую причину развития трикуспидальной недостаточности. Пациенту была успешно выполнена пликация передней створки и имплантация опорного кольца.
Особый интерес представляет дисфункция биологического протеза в трикуспидальной позиции. В доступной литературе крайне мало информации о нюансах проведения операции репротезирования трикуспидального клапана. Частично это можно объяснить небольшим количеством подобных операций – в клинике нашего Института, например, из 345 имплантаций ксенопротезов в трикуспидальную позицию, в отдаленном периоде репротезировали только 12, т.е. 3,5% от общего количества. Тем не менее, обладая даже небольшим опытом подобных операций, мы можем сделать определенные выводы, которые будут интересны кардиохирургам. Основной особенностью при эксплантации биопротеза из трикуспидальной позиции было сращение ранее сохраненной септальной створки или (в одном случае) целого клапана с биологическим протезом. В двух наблюдениях результатом такого сращения стало разрастание фиброзной ткани с переходом на внутреннюю часть ксеноклапана и созданием значительного ограничения подвижности ксеностворок. Этот процесс стал причиной развития дисфункции и необходимости репротезирования клапана. В двух наблюдениях формирование тесной связи между нативным и искусственным клапанами не приводило непосредственно к развитию дисфункции, однако значительно затрудняло эксплантацию протеза.
В настоящее время мы предпочитаем выполнять полное иссечение трикуспидального клапана и подклапанных структур до головок папиллярных мышц, оставляя лишь бортик ткани 3-4 мм, достаточный для более надежной фиксации протеза. В двух случаях мы наблюдали перфорацию створки ксенопротеза ранее проведенным эндокардиальным электродом. Всего же у 5 из 12 больных, реоперированных по поводу дисфункции трикуспидального протеза, в правых отделах находились один или более эндокардиальных электродов. Всем пациентам выполнили максимально возможное удаление электродов из правых отделов и системы верхней полой вены с последующей имплантацией ЭКС в миокардиальном варианте. Во всех 12 случаях дисфункция ксенопротеза в трикуспидальной позиции определена как структурная, т.е. сопровождающаяся макроскопическими изменениями створок (рис. 2).
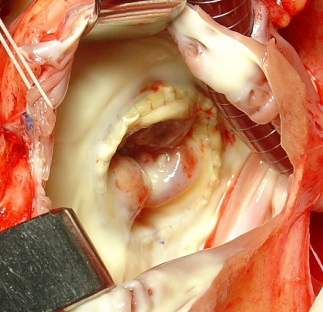
Рис. 2. Структурная дисфункция биологического протеза в трикуспидальной позиции.
Сравнивая уровни послеоперационной летальности после выполнения реконструктивного вмешательства и репротезирования трикуспидального клапана, можно констатировать, что аннулопластические процедуры демонстрируют меньший риск смерти на госпитальном этапе. В группе больных, которым выполнили пластику трикуспидального клапана, летальность составила 3% (2 пациента). Среди пациентов, которым выполнили репротезирование трикуспидального клапана, умерли 3 больных (25%), однако стоит учитывать, что один больной этой группы подвергся эксплантации двух протезов (митрального и трикуспидального), а у одного смерть после операции наступила на фоне острой остановки дыхания вследствие самостоятельного введения неочищенных наркотических средств. Выжившие больные обеих групп к моменту выписки отмечали улучшение общего самочувствия, уменьшение отеков, одышки. В группе пациентов, которым выполнили аннулопластику клапана, нарушения ритма сердца (инцизионное трепетание предсердий) при исходном синусовом ритме наблюдали у 6 (9%) больных. Во всех случаях синусовый ритм был восстановлен электродефибрилляцией сердца. Развитие синдрома Фредерика, требующего имплантации постоянного электрокардиостимулятора, зафиксировали у 2 (3%) пациентов. Среди больных, которым выполняли репротезирование клапана, трепетание предсердий развилось у 1 (8%) пациента. Нарушений проводимости, требующих имплантации постоянного кардиостимулятора, не зафиксировано, но стоит отметить, что изначально 5 (42%) больных поступили в клинику Института с уже имплантированным кардиостимулятором. По данным контрольной эхокардиографии, наиболее значимые изменения наблюдались в динамике полости правого предсердия – уменьшение продольного размера в общей группе с 7,4±1,1 до 6,1±1 см (р=0,02) и уровня легочной гипертензии – с 56±10 до 47±8 мм рт. ст. (р=0,03). Уменьшение давления в легочной артерии, большинстве случаев (75 больных), было связано не только с восстановлением замыкательной функции трикуспидального клапана, но и с коррекцией митрального порока.
Обсуждение. Патология трикуспидального клапана является одной из самых неоднозначных проблем современной кардиохирургии. Так, например, до настоящего времени нет единого мнения о целесообразности коррекции функциональной недостаточности трехстворчатого клапана при вмешательствах по поводу митрального порока, а также о выборе метода пластики клапана [4, 5]. Одна из самых распространенных техник аннулопластики – методика, предложенная De Vega N.G. [6]. Она воспроизводима и не требует дорогостоящих затрат. За 40 лет было предложены различные модификации этой техники [7, 8], но наиболее востребованной все равно остается классическая. Сторонники шовной аннулопластики в качестве ее преимуществ называют сохранение физиологической подвижности фиброзного кольца клапана, отсутствие синтетических материалов в полости правого предсердия, меньший риск повреждения проводящей системы сердца [9]. Такое мнение разделяют не все хирурги. Некоторые считают, что золотым стандартом при хирургическом лечении функциональной трикуспидальной недостаточности, является имплантация опорной конструкции – при сопоставимых рисках осложнений эта методика обеспечивает более стабильные отдаленные результаты в отношении прогрессирования дилатации фиброзного кольца и риска возврата патологического сброса [10]. На основании собственного опыта и анализа литературных данных, при хирургическом лечении митрального порока мы всегда оцениваем необходимость коррекции сопутствующего трикуспидального порока и в 95% случаев принимаем решение о выполнении аннулопластики, даже при отсутствии значимого обратного сброса крови. При дилатации фиброзного кольца менее 50 мм (большая ось), мы считаем достаточным выполнение шовной аннулопластики, более 50 мм – предпочитаем имплантацию опорного кольца в большинстве случаев. Особого внимания заслуживают пациенты, у котрых открытая операция на сердце является повторной. В нашем исследовании, у 21 больного ранее выполнялось вмешательство на трикуспидальном клапане в объеме шовной аннулопластики. У 18 пациентов в отдаленном периоде наблюдали прорезывание части, или всей нити через ткани фиброзного кольца и, как следствие, развитие сброса на уровне правого атриовентрикулярного отверстия. В подобных случаях, мы считаем выполнение повторной шовной аннулопластики нецелесообразным и однозначно рекомендуем имплантацию опорного кольца (при отсутствии выраженных морфологических изменений клапанного аппарата). Шовную пластику при повторном вмешательстве на сердце целесообразно выполнять пациентам, у которых вмешательство на трехстворчатом клапане производится впервые, ориентируясь на размер фиброзного кольца и уровень давления в легочной артерии (в нашем исследовании достаточным условием для выполнения пластики было систолическое давление в легочной артерии не более 50±8 мм рт. ст.). Независимо от выбранного метода аннулопластики, основными целями операции является коррекция патологической дилатации фиброзного кольца, достижение сопоставимости створок клапана в систолу и достижение стабильных результатов в отдаленном периоде [5]. Окончательное решение, основанное на данных клинического и инструментального обследования, интраоперационных находок, принимает хирург во время основного этапа. При эксплантации протезов из атриовентрикулярных позиций, особого внимания заслуживает такая проблема, как сращение сохраненных ранее подклапанных структур или створок клапана с элементами конструкции протеза. Если в митральной позиции, формирование такого конгломерата приводит к техническим трудностям при выделении протеза [11, 12], то в трикуспидальной разрастание собственных тканей в ряде случаев является непосредственной причиной развития дисфункции или усугубляет гемодинамические нарушения в комплексе с другими (как правило, структурными) изменениями. Подобная проблема описана и для механических протезов [13]. Ряд исследователей указывают на положительную роль сохранения атриовентрикулярного клапана или отдельных его компонентов в улучшении геометрии и функции полости сопряженного желудочка [14, 15], однако не анализируют возможные воздействия на имплантированный протез. Учитывая известные данные и результаты, полученные нами, мы рекомендуем отказаться от полного сохранения трикуспидального клапана при выполнении его протезирования [16]. При его иссечении мы оставляем бортик ткани с хордами третьего порядка, достаточный для формирования надежной фиксации протеза.
Заключение. В отсутствии выраженных морфологических изменений структур трикуспидального клапана при повторном открытом вмешательстве на сердце, предпочтительно выполнение клапансохраняющей процедуры. При дилатации фиброзного кольца по большой оси не более 5,2±0,6 см рекомендовано проведение шовной аннулопластики, более 5,2±0,6 см – имплантация опорного кольца. Нецелесообразно выполнять шовную реконструкцию при формировании дисфункции правого атриовентрикулярного клапана за счет прорезывания нити предыдущей пластики. После восстановления замыкательной функции правого атриовентрикулярного клапана можно ожидать уменьшения размеров правого предсердия и снижения уровня давления в легочной артерии уже в раннем послеоперационном периоде. Вероятность формирования дисфункции ксенопротеза в трикуспидальной позиции за счет формирования сращений структур собственного клапана с корпусом биологической конструкции, свидетельствует о необходимости полного иссечения трехстворчатого клапана при его первичном протезировании.
