Гнойно-некротические осложнения нижних конечностей у больных сахарным диабетом (СД) представляют собой трудную и далеко не решенную проблему общей хирургии. Окклюзионно-стенотические поражения артерий нижних конечностей у больных СД являются одной из причин развития хронических раневых дефектов и гангрены стопы [11]. Одним из эффективных методов по сохранению конечности является артериальная реконструкция пораженного участка, способная значительно снизить уровень ампутации [3]. По данным литературы, выполнение реваскуляризирующих операций на артериях нижних конечностей у больных СД позволяют снизить риск высокой ампутации в 10 – 12 раз [12]. Доказано, что снижение уровня кровотока конечности в сочетании с инфекцией являются ведущими факторами, нарушающими процессы репарации в тканях, и неизбежно приводят к ампутации [4]. Летальность в периоперационном периоде и после ампутации нижней конечности составляет: на уровне бедра 50% - 85%, на уровне голени 24% - 35%, на уровне стопы - 6% [6]. В России, несмотря на имеющиеся исследования, остаются недостаточно изученные вопросы, отражающие результаты комплексного лечения больных с тяжелыми гнойно-некротическими поражениями синдрома диабетической стопы (СДС). Основными проблемами у больных с различными кожно-пластическими вмешательствами на стопе остаются причины ранних и поздних осложнений, а также способы их лечения [2]. В последнее время появилась тенденция к выполнению «малых» и «экономных» вмешательств на стопе в сочетании с реконструктивными вмешательствами на артериях нижних конечностей [1, 5]. Пластику раневого дефекта с использованием лоскутов, выкроенных из местных тканей стопы, можно использовать у всех больных, независимо от формы диабетической стопы [8]. В литературе есть сообщения, что применение современных перевязочных материалов (ПМ) с наноструктурированным серебром в местной терапии раневого процесса, улучшают результаты лечения больных с гнойно-некротическими осложнениями синдрома диабетической стопы [9, 10].
Цель работы. Оценить результаты различных способов хирургического лечения больных с гнойно-некротическими осложнениями диабетической стопы, путем использования современных серебросодержащих перевязочных материалов и разработка на этой основе алгоритма лечебной тактики.
Методика исследования. С 2004 по 2012 г. нами проведено лечение 257 пациентов с гнойно-некротическими поражениями тканей стопы на фоне СД 2 типа. Средний возраст составил 72,4±5,1 года. Длительность заболевания СД варьировала в пределах 16,2±4,3 лет. Среди пациентов было 163 мужчины (63,4%) и 94 женщины (36,6%). Все больные имели II-IV стадию гнойно-некротического процесса по F.W. Wagner. По форме СДС: нейропатическая была у - 109 (42,3%) больного, ишемическая у - 23 (9,2%), смешанная у - 125 (48,5%). Для оценки микро- и макроангиопатии использовали: транскутанную оксиметрию, ультразвуковое дуплексное сканирование, ангиографию артерий нижних конечностей. В лечении больных принимали участие врачи общей и сосудистой хирургии, эндокринолог, анестезиолог, невропатолог, терапевт, подиатр.
Оценку динамики раневого процесса проводили с помощью клинико-лабораторных и инструментальных методов исследования. Исследование очагов гнойной инфекции осуществляли бактериологическим методом. Микроорганизмы идентифицировали по морфологическим, культуральным и биохимическим свойствам. Антибиотикочувствительность оценивалась диско-диффузионным методом Кирби-Бауэра. Проводили цитологическое исследование мазков-отпечатков ран по Покровской - Макарову. В качестве инструментальных использовали метод парциального напряжения кислорода в тканях (ТсРО2) с вычислением индекса региональной перфузии (ИРП). Скорость заживления ран оценивали планиметрическим методом по Л.Н. Поповой. Статистический анализ цифровых данных выполнен с помощью программы STATISTICA версии 7.0. Дискретные величины результатов исследования сравнивались с использованием критерия χ2.
В исследование были включены только те пациенты, которым выполнялись «малые» операции в пределах стопы. Лечебные мероприятия включали в себя: первичную хирургическую обработку раны (при флегмоне, влажной гангрене); медикаментозную терапию; реконструктивные вмешательства на артериях нижних конечностей (у пациентов II и III группы); оперативные вмешательства на стопе: радикальную некрэктомию в сочетании с одноэтапной или отсроченной пластикой раневых дефектов. В лечении применяли как традиционные, так и современные ПМ согласно стадиям развития раневого процесса. Для разгрузки зоны поражения стопы использовали средства иммобилизации типа «полубашмак» и Total Contact Cast.
В процессе лечения больные были разделены на три группы сопоставимые по тяжести заболевания, распространенности и глубине поражения стоп.
В I группу исследования были включены 176 пациентов, которым проводилось традиционное лечение: медикаментозная коррекция ишемии, дезинтоксикационная терапия, хирургические радикальные операции на стопе с пластикой раны. Для лечения ран использовали традиционные влажно-высыхающие марлевые перевязки с антисептиками (хлоргексидин, йодопирон) и мазями (левомеколь, левосин).
Во II группу вошли 34 пациента с открытыми сосудистыми вмешательствами (шунтирование, протезирование, эндартерэктомия) на артериях нижних конечностей. Всем больным проводилась инфузионно-дезинтоксикационная терапия и хирургические вмешательства на стопе. В местной терапии ран использовали современные ПМ (альгинаты – Silvercel, гидрогели – Hydrosorb, гидроколлоиды – Hydrocoll).
В III группу исследования были включены 47 пациентов с агиопластикой нижних конечностей (баллонная дилатация, стентирование). Оперативные вмешательства на стопе и пластика раневых дефектов были аналогичны I и II группе. Для лечения ран применяли импрегнированные ПМ, содержащие частицы серебра (Suprasorb Ag+, Atrauman Ag+, Асептика Ag+).
Все пациенты, в зависимости от способа выполнения пластического закрытия раневого дефекта, были разделены на две подгруппы (таблица 1). В подгруппах А (одноэтапная пластика) наряду с консервативной терапией проводили местное лечение раны, далее выполняли хирургическую радикальную некрэктомию, а затем пластику раневого дефекта. У пациентов подгруппы Б (отсроченная пластика) до и после радикальной некрэктомии проводили местное лечение раны, а затем приступали к пластическому закрытию раны. Марлевые повязки применялись традиционно. Среди современных ПМ, в фазе экссудации использовали абсорбирующие губки. Смену повязки производили 1-2 раза в день. Для стимуляции репаративных процессов раны, в фазе регенерации применяли атравматические повязки умеренной влажности. Смену повязок проводили через 2-3 дня.
Результаты и обсуждение. Поражение мягких тканей стопы были представлены в виде: гнойно-некротических ран – у 117 (45,5%) больных, сухой гангрены – у 102 (39,2%), влажной гангрены (флегмоны) – у 38 (15,3%). Деструкция костей стопы выявлена у 109 (42,4%) пациентов.
Изучение характера микрофлоры очагов гнойно-некротических поражений СДС до лечения показало, что ведущую роль в развитии процесса играют золотистый стафилококк и условно-патогенные микроорганизмы семейства Enterobacteriaceae. В 84 % случаев выделены ассоциации 2-3 микроорганизмов. Возбудители инфекции были чувствительны к фторхинолонам, ингибиторозащищённым пенициллинам, карбапенемам. После этапной сосудистой коррекции артериального кровотока дезинтоксикационную, противовоспалительную терапию продолжали до купирования перифокального отека мягких тканей. В I группе сроки проведения терапии составили 14-16 дней, во II и III группе 9-10 дней.
Таблица 1. Объем и результаты хирургических вмешательств
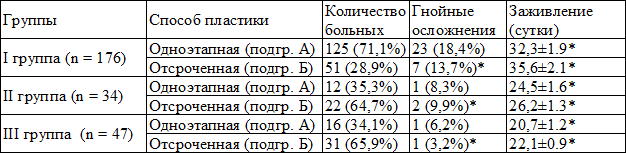
Примечание: здесь и далее * - статистически значимые различия в группах при р<0.05
У больных I группы исследования cроки подготовки раны к проведению пластики составили: в подгруппе А – 20 дней, в подгруппе Б – 22 дня. К концу лечения индекс региональной перфузии (ИРП) в положении сидя не превышал 0,6. Уровень контаминации ран был достаточно высоким, а цитологическое исследование показало воспалительно-регенераторный тип (табл. 2). У 21 (11,9%) пациента к концу лечения выявлены ассоциации антибиотикоустойчивых бактерий. В большинстве случаев бактериальный спектр характеризовался образованием биоплёнок. Количество послеоперационных осложнений со стороны раны в виде некрозов и нагноений выявлено у 30 (17,1%) больных, из них: в подгруппе А у 23 (18,4%) и у 7 (13,7%) в подгруппе Б. Сохранить конечность удалось у 147 (83,5%) пациентов. Высокие ампутации выполнены у 29 (16,5%) больных: из них у 18 (62,1%) на уровне бедра, у 11 (37,9%) на уровне голени.
Таблица 2. Показатели направленности течения раневого процесса
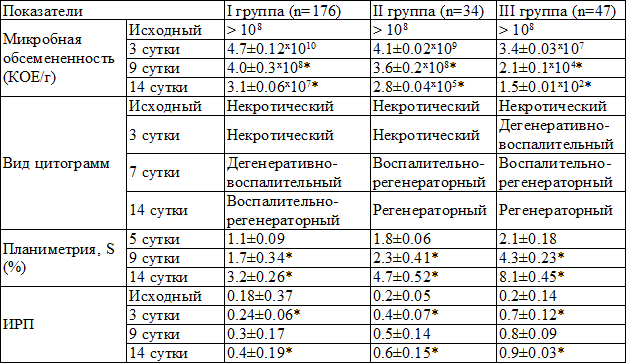
Примечания: S – скорость заживления раны (по Л.Н. Поповой [13]); ИРП – индекс региональной перфузии
У больных II группы исследования очищение раневого ложа к моменту пластики составило: в подгруппе А – 14 дней, а в подгруппе Б – 16. Прирост ИРП составил более 0,6. Контаминация раны была значительно меньше, чем в I группе и составила 105 колоний образующих единиц/г (КОЕ/г). Цитологическая картина показала регенераторный тип. У 3 (8,8%) пациентов выявлены ассоциации антибиотикоустойчивых бактерий. При микробиологическом исследовании обнаружен рост биопленок семейства S. аureus и Ps. аeruginosa. Применение современных ПМ способствовало более быстрому очищению раны, появлению краевой эпителизации и росту грануляций. Осложнения со стороны раны наблюдались у 3 (8,8%) больных, из них: в подгруппе А у 1 (8,3%) и в подгруппе Б у 2 (9,9%). Опорную функцию стопы удалось сохранить у 29 (85,3%) больных. У 4 (11,7%) пациентов выполнена высокая ампутация на уровне голени, у 1 (2,9%) на уровне бедра.
У пациентов III группы сроки подготовки раневой поверхности к моменту пластики составили: в подгруппе А – 10 дней, в подгруппе Б – 12 дня. В подгруппе А раневые дефекты очищались в среднем за 4-6 дней, а образование полноценного грануляционного ложа происходило в течение 4-5 дней. В подгруппе Б очищение раны происходило в среднем за 6-8 дней, а формирование здоровых грануляций после радикальной некрэктомии в течение 4-6 дней. Примерно на 10-е сутки после операции пациентам снимали швы. Средние сроки комплексного лечения гнойно-некротического процесса в I подгруппе составили – 20 дней, во II подгруппе – 22. Благодаря использованию серебросодержащих ПМ рост микроорганизмов выявлен лишь в одном (2,1%) случае. Уровень микробной обсемененности раны к проведению пластики составил 102 -104 КОЕ/г. По данным цитологического исследования мазков-отпечатков значительно увеличивалось количество фибробластов, а регенераторная фаза наступала намного быстрее. Скорость эпителизации раны была намного быстрее, чем в сравниваемых группах. Осложнения со стороны раны в виде локального некроза выявлены лишь у - 2 (4,2%) пациентов в каждой из подгрупп. Опорную функцию стопы удалось сохранить у всех больных. У 1 (2,1%) пациента в подгруппе А выполнена реампутация на уровне стопы.
Вывод. Наиболее благоприятные результаты были у пациентов III группы исследования. Оптимальным условием заживления раны после радикальных вмешательств на стопе является открытый способ ее ведения с последующей отсроченной пластикой. Использование импрегнированных ПМ в комплексной терапии у больных диабетической стопой позволяет снизить риск развития послеоперационных осложнений с 17,1 до 4,2%, а общие сроки лечения на 12-14 дней.
