Введение. Адекватная оценка степени тяжести состояния является необходимым условием для принятия правильных решений по диагностике и тактике лечения пациентов с ургентной хирургической патологией. В настоящее время для оценки тяжести состояния пациентов широко используются шкалы APACHE II, SAPS II, SOFA, MODS [7, 8, 11, 13]. Особое внимание в них уделено оценке состояния сердечно-сосудистой системы, газообмена, нарушений функций печени и почек [7, 8, 11, 13]. Необходимым свойством методик оценки тяжести состояния является сохранение их информативности в гетерогенных группах пациентов – вне зависимости от этиологических факторов, состояния воспалительного процесса и в разные периоды стационарного лечения. Очевидно, что любые методики оценки состояния пациента в зависимости от условий проявляют различную информативность. Например, чувствительность шкал APACHE II, SAPS II, SOFA, MODS на фоне мероприятий интенсивной терапии снижается с момента поступления в стационар [1]. Стремление улучшить качество математических моделей отражается в модификации шкал и смещении точек отсечения [7, 13].
В качестве одного из отягощающих факторов в ряде шкал учитывают наличие иммунодефицитных состояний. Известно, что состояние иммунной системы тесно связано с тяжестью состояния пациентов хирургического профиля [5, 9, 12], а показатели иммунной системы можно использовать для прогнозирования течения и исходов заболеваний [6, 14].
В то же время в современной клинике наиболее доступным средством мониторинга воспалительной реакции остается развернутый анализ морфологического состава лейкоцитов периферической крови. Уровень числа лейкоцитов и изменения со стороны соотношения популяций лейкоцитов дают представление о степени выраженности воспалительных изменений и состоянии костномозгового кроветворения. Очевидно, что эти факторы также влияют на информативность шкал тяжести состояния.
Целью настоящего исследования была оценка взаимосвязей между популяционными характеристиками лейкоцитов периферической крови и информативностью показателей тяжести состояния у пациентов с ургентной хирургической патологией.
Материалы и методы. Обследованы 442 пациента с экстренной патологией органов брюшной полости, требовавшей экстренного оперативного лечения. Среди них – пациенты с перфоративными язвами желудка и двенадцатиперстной кишки – ДПК (162 человек, 36,6%), проникающими ранениями с повреждениями органов брюшной полости (73, 16,5%), панкреонекрозами (45, 10,2%), острой спаечной кишечной непроходимостью (70, 15,8%), деструктивными формами аппендицита (31, 7%), у 104 пациентов, включая вышеназванных, наблюдались другие острые воспалительные процессы (23,5 %). Перитонит и абдоминальный сепсис наблюдался у 292 человек (66,1%). В то же время изменения состава лейкоцитов крови, соответствующие синдрому системной воспалительной реакции (ССВР), отмечены на момент исследования только у 54 пациентов (12,2%). Госпитальная пневмония развилась у 11 пациентов (2,5%), полиорганная недостаточность – у 59 больных (13,3%). Выздоровевших пациентов – 381 (86,2%), в 61 случае (13,8%) заболевание закончилось летальным исходом. В исследование включены 1187 результатов обследований. Интегральную оценку тяжести состояния пациентов проводили в динамике с помощью шкал Apache II [8, 11], SAPS II [8], SOFA [7], MODS [13]. Выраженность воспалительных изменений в брюшной полости оценивали по шкале мангеймского индекса перитонита (МИП) [11].
Все пациенты были оперированы в течение первых суток с момента госпитализации. Оперативное лечение включало лапаротомию, ревизию органов брюшной полости, устранение последствий травмы или ранения, ликвидацию (по возможности) очага инфекции. При невозможности одномоментного устранения гнойного процесса в брюшной полости проводились программированные релапаротомии. Все пациенты получали инфузионную, детоксикационную и антибактериальную терапию в объеме, адекватном тяжести состояния.
Исследовали показатели периферической крови: количество лейкоцитов (L, 109/л), абсолютное количество лимфоцитов (АКЛ) в мкл; показатели лейкоцитарных индексов интоксикации (ЛИИ): по Я.Я. Кальф-Калифу (ЛИИкк), по В.К. Островскому (ЛИИос), по С.Ф. Химич в модификации А.Л. Костюченко с соавт. (ЛИИх) [3]. Исследовали показатели вегетативной регуляции: индекс стресса (ИС), число признаков напряженности (ЧПН) адаптационных реакций организма по Л.Х. Гаркави (1987) [4], индекс Kerdö (ИК), показатель минутного объема кровотока (МОК) [2]. Определяли уровень экспрессии на лимфоцитах молекул: CD3, CD4, CD8, CD16, CD20, CD25, CD38, CD95. Использовали моноклональные антитела, производимые ЗАО «Сорбент» (Москва, Россия).
Таблица 1. Характеристика групп по составу лейкоцитов периферической крови
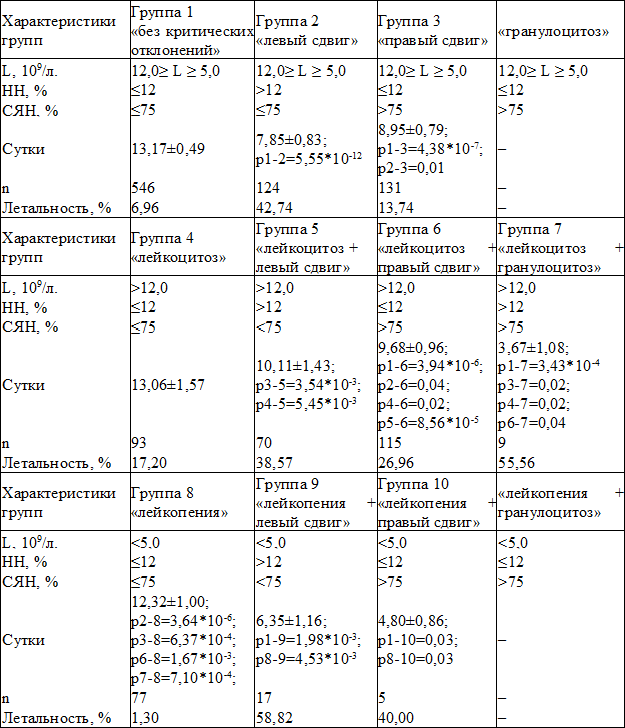
Примечание: p1-2–p8-10 – достоверность различий между показателями соответствующих групп
В расчетах использовали значения абсолютного числа клеток (в мкл) крови (abs), экспрессирующих молекулы: CD3, CD4, CD8, CD16, CD20, CD25, CD38, CD95. Фагоцитарную активность нейтрофилов изучали с помощью латекс-теста. Оценивали фагоцитарный индекс (ФИ) и количество фагоцитирующих нейтрофилов (КФН). Концентрацию сывороточных иммуноглобулинов А, М, G определяли методом иммунопреципитации в агаровом геле [10].
Варианты морфологического состава периферической крови классифицировали следующим образом. По уровню L выделяли группы: 1) «лейкоцитоз»: L>12,0*109/л.; 2) «без критических отклонений»: 5,0*109/л.≤L≤12,0*109/л.; 3) «лейкопения»: L<5,0*109/л. По уровню незрелых форм нейтрофилов (НН) выделяли группы: 1) «без критических отклонений»: НН≤12%; 2) «левый сдвиг»: НН>12%. По уровню сегментоядерных нейтрофилов (СЯН) выделяли группы: 1) «без критических отклонений»: СЯН≤75%; 2) «правый сдвиг» СЯН>75%. Сочетание НН>12% и СЯН>75% определяли как «гранулоцитоз». В зависимости от количества лейкоцитов, процентного содержания в периферической НН и СЯН были сформированы 10 групп показателей. Состояния, характеризующиеся сочетанием «гранулоцитоза» с «лейкопенией» или количеством лейкоцитов «без критических отклонений», не встречались (табл. 1).
Расчёты выполняли с помощью пакета статистических программ «Statistica for Windows 6.0». В качестве основных статистических параметров учитывали среднее арифметическое значение величин (M) и их стандартную ошибку (m). Различие показателей в группах проверяли с помощью U-критерия Вилкоксона-Манна-Уитни.
Связь между исследуемыми показателями определяли методами дисперсионного анализа. При дисперсионном анализе силу влияния фактора определяли по формуле:
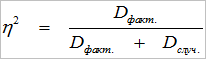
где η2 – сила влияния фактора, Dфакт. – факторная дисперсия, Dслуч. – случайная дисперсия.
Критический уровень значимости (p) при проверке статистических гипотез принимали равным 0,05. Значения p<0,01 представляли числом в форме мантиссы и показателя степени. При p<1,0*10-29 (ниже предела измерений достоверности различий “Statistica for Windows 6.0”) принимали p=0,00.
Результаты и обсуждение. Согласно полученным данным (табл. 1), наименьшие сроки с момента госпитализации были характерны для групп с критическими характеристиками морфологического состава крови: «лейкоцитоз + гранулоцитоз» (группа 7), «лейкопения + правый сдвиг» (группа 10), «лейкопения + левый сдвиг» (группа 9). Наиболее ранней (в течение шести первых суток стационарного лечения) реакцией на действие повреждающих факторов является лейкопения (группы 9, 10) и лимфопения (группа 7).
Затем в динамике, к 7–9-м суткам лечения, наиболее характерными особенностями состава лейкоцитов становятся «левый сдвиг» и «правый сдвиг» (группы 2, 3). Нужно отметить, что все перечисленные изменения характеризуются снижением относительной доли лимфоцитов за счет преобладания гранулоцитов. На 9–10-е сутки стационарного лечения наиболее характерными особенностями состава крови являются лейкоцитоз с «правым» и «левым» сдвигами лейкоцитарной формулы (группы 6, 5).
Таблица 2. Взаимосвязь показателей состояния пациентов первой–четвертой групп с исходом заболевания
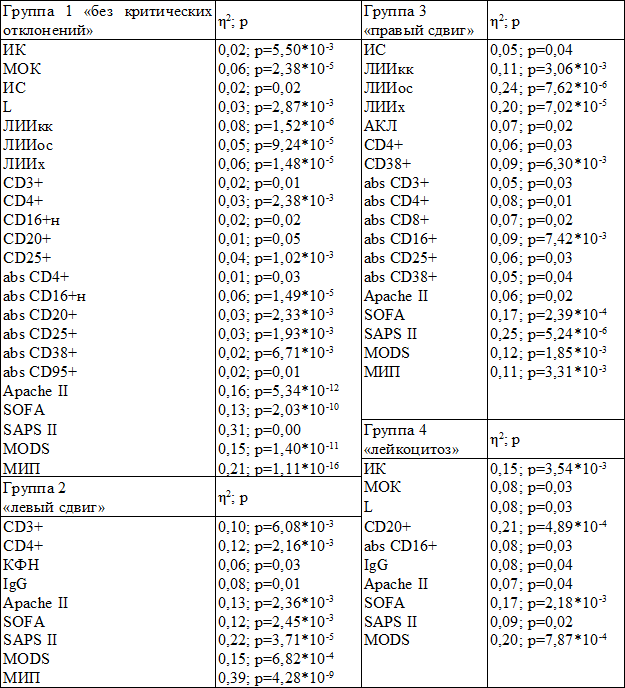
Примечание: при p<1,0*10-29 принимали p=0,00
Такие изменения клеточного состава крови можно считать проявлением механизмов увеличения количества лимфоцитов при сохранении явлений интоксикации. Для более поздних сроков стационарного лечения характерно отсутствие критических сдвигов популяционного состава лейкоцитов при колебании их количества (табл. 1). Достаточно очевидным является наибольшее значение показателей в группе 1, которая характеризуется отсутствием критических отклонений количества и состава лейкоцитов. Полученные данные являются достаточно специфичными и важными для оценки последовательности включения компенсаторных реакций и их взаимосвязей с информативностью показателей состояния пациентов для прогнозирования исхода заболевания.
Информативными для оценки исхода заболевания у пациентов 10-й и 7-й групп являются шкала SAPS II и показатели вегетативной регуляции: ИС (группа 10) и МОК (группа 7). Количество информативных показателей увеличивается в группе 9 («лейкопения + левый сдвиг», 6,35±1,16 суток), в которой наибольшую информативность демонстрируют МИП (η2=0,66) и Apache II (η2=0,63), показатели иммунной системы: CD3+, CD16+, CD25+ (экспрессирующие рецептор интерлейкина-2), которые превосходят по информативности шкалы SOFA и SAPS II (табл. 2).
При особенностях состава лейкоцитов, характерных для группы 2 («левый сдвиг»), наибольшую информативность среди шкал тяжести состояния демонстрируют показатели SAPS II (η2=0,22) и МИП (η2=0,39). Информативность шкалы Apache II сопоставима с показателями CD3+ и CD4+ (табл. 2). В группе 3 («правый сдвиг») наиболее информативно оценивают исход заболевания показатели SAPS II (η2=0,25) и ЛИИос (η2=0,24). Показатель Apache II существенно уступает по информативности другим шкалам тяжести состояния, индексам интоксикации и сопоставим с показателями иммунной системы (табл. 2). Информативность показателя ИС была достаточно низкой (η2=0,05), что свидетельствует о снижении роли вегетативных реакций как механизма регуляции гомеостаза.
Таблица 3. Взаимосвязь показателей состояния пациентов пятой–десятой групп с исходом заболевания
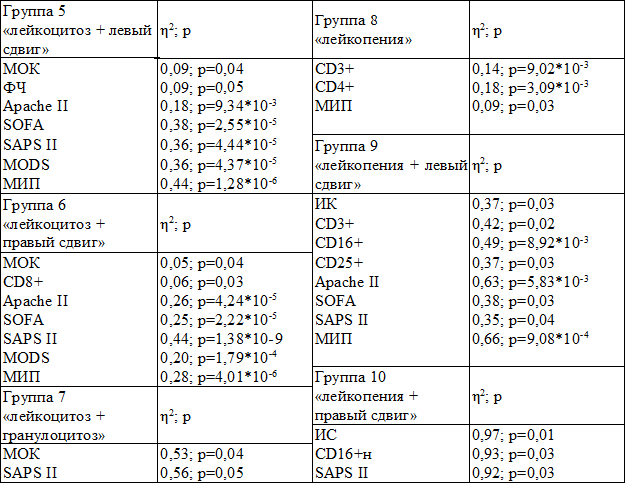
У пациентов с «левым» и «правым» сдвигами лейкоцитарной формулы на фоне лейкоцитоза (группы 5, 6) информативны шкалы тяжести состояния и показатель МОК. Наиболее информативными являются SAPS II и МИП (табл. 3). У пациентов с лейкопенией наиболее информативными являются показатели CD3+, CD4+ (табл. 3), превосходившими прогностическую информативность МИП (η2=0,09). Показатели других шкал тяжести состояния оказались недостоверными для оценки тяжести состояния пациентов в группе 8 (табл. 3).
Очевидно, что увеличение количества лейкоцитов повышает потенциальные возможности для установления функциональных связей между элементами иммунной системы. У пациентов с лейкоцитозом (L>12,0*109/л, группа 4) количество показателей, информативно отражающих тяжесть состояния, увеличивается. Наиболее прогностически значимыми являются показатели: CD20+ (η2=0,21), MODS (η2=0,20), SOFA (η2=0,17). Информативность шкал Apache II и SAPS II существенно ниже (табл. 2).
Среди всех вариантов популяционного состава и количества лейкоцитов наибольшее количество прогностически значимых показателей выявлено в группе 1 («без критических отклонений»). В этой группе информативно отражали тяжесть состояния пациентов показатели вегетативной регуляции (ИК, МОК, ИС), интоксикации (L, ЛИИкк, ЛИИос, ЛИИх), большинство показателей иммунного статуса, шкалы тяжести состояния (табл. 2). Наиболее информативными были показатели: SAPS II (η2=0,31), МИП (η2=0,21), Apache II (η2=0,16).
Выводы. У пациентов с ургентной хирургической патологией для разных сроков стационарного лечения характерны различия популяционного состава и количества лейкоцитов. Выявлены взаимосвязи между прогностической информативностью шкал APACHE II, SAPS II, SOFA, MODS, показателями иммунной системы, интоксикации и вегетативной регуляции и популяционным составом и количеством лейкоцитов. Отмечено, что используемые шкалы тяжести состояния наиболее информативны при классическом течении воспалительного процесса. Крайние варианты лейкоцитарных реакций сопровождаются снижением или потерей информативности шкал тяжести состояния. Наряду с классическими показателями шкал тяжести состояние пациентов информативно отражают показатели иммунного статуса, интоксикации и вегетативной регуляции. Результаты исследования целесообразно учитывать как для оценки тяжести состояния пациентов в клинике, так и при разработке новых способов прогнозирования исходов заболевания. Дифференцированный подход к определению функционально значимых факторов – ключ к выбору эффективных точек приложения лечебных воздействий. Высокая точность оценки тяжести состояния пациентов возможна при учете совокупности показателей, характеризующих состояние организма.
