Острый панкреатит является одним из наиболее распространенных тяжелых заболеваний органов брюшной полости и представляет серьезную медико-социальную проблему. Наиболее тяжело протекают деструктивные панкреатиты, удельный вес которых достигает 15-25 % [6,8].
Формирование некроза поджелудочной железы происходит в течение 1-2 суток болезни, и именно в это время терапевтические мероприятия максимально эффективны. Вместе с тем, при поступлении больного данные лабораторных и инструментальных методов обследования не всегда позволяют однозначно судить о тяжести состояния и дальнейшем течении заболевания [5,7,11].
По мнению ряда авторов, одним из важнейших звеньев в патогенезе является расстройство кровообращения на уровне микроциркуляторного русла [1,2,9]. Гемодинамические нарушения появляются на ранних стадиях и сопровождают все периоды заболевания. Ангиоспазм, венозный застой, микротромбозы, интерстициальный отек, и гипоксия тканей вызывают первичное повреждение панкреоцитов и приводят к развитию ишемического острого панкреатита. Развитие нарушений микроциркуляции является основой развития локального воспаления и неотъемлемым спутником процесса системной воспалительной реакции, которая является одним из проявлений острого панкреатита [2,3,10].
В связи с этим важное значение приобретает изучение состояния микроциркуляторного русла при остром панкреатите.
Материалы и методы. На базе МУЗ «Городская клиническая больница №1», г. Читы нами проведено исследование состояния микроциркуляции у 57 больных с различными формами острого панкреатита.
I группу составили 30 больных с отечной формой панкреатита, II группу – 27 больных с деструктивной формой острого панкреатита. Группу клинического сравнения составили 19 практически здоровых человек.
С целью изучения состояния микроциркуляторного русла проводили запись осцилляций кровотока на аппарате ЛАКК-02 (НПП «Лазма», Россия). Обследование людей проводилось с соблюдением стандартных условий для методики лазерной допплеровской флоуметрии.
Исследования проводились в одно и то же время суток. Перед исследованиями пациенты и здоровые люди не принимали пищу или напитки, изменяющее состояние микроциркуляции, не курили.
При тестировании все обследуемые находились в положении лежа на спине. Исследования проводились при одинаковой температуре в помещении: +22-24°С. В течение 15 минут до начала диагностики испытуемые находились в спокойном состоянии.
ЛДФ-граммы регистрировались в течение 7-10 минут. Измерения проводили в стандартной зоне Захарьина – Геда для поджелудочной железы. Оценивались: коэффициент вариации (Кv), отражающий соотношение между перфузией ткани и величиной ее изменчивости; показатель микроциркуляции (М), характеризующий поток эритроцитов в единицу времени через единицу объема ткани; индекс эффективности микроциркуляции (ИЭМ), который отражает соотношение активных и пассивных механизмов в регуляции кровотока по микрососудам. Перечисленные показатели измеряли в перфузионных единицах (пф. ед.). С помощью вейвлет-анализа устанавливались показатель шунтирования (ПШ), а также максимальных амплитуд: эндогенного, нейрогенного, миогенного, дыхательного и сосудистого диапазонов.
Статистическую обработку полученного материала проводили с использованием пакета STATISTICA 6.1 для Windows. Проверку на нормальность распределения количественных показателей проводили с использованием критерия Шапиро-Уилка. Так как не все изучаемые показатели подчинялись нормальному закону распределения, применяли непараметрические методы: описательная статистика изучаемых параметров представлена медианой и межквартильным интервалом (25-го; 75-го прецентилей); сравнение независимых выборок с помощью U-критерия Манна-Уитни и Вилкоксона для парных признаков. Для проверки статистических гипотез при сравнении независимых выборок применяли непараметрический дисперсионный анализ Краскела-Уоллиса и медианный тест. Критический уровень значимости при проверке статистических гипотез принимался р<0,05.
Результаты и обсуждение. Исследование проводилось больным острым панкреатитом при поступлении в стационар. Полученные данные представлены в табл. 1.
Таблица 1. Показатели микроциркуляции при различных вариантах течения острого панкреатита (Ме (25-й; 75-й))
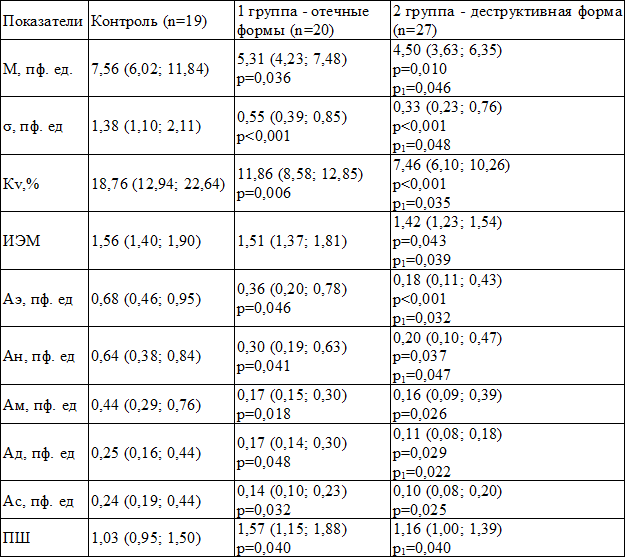
Примечания: n - число обследованных; р - уровень значимости достоверных различий по сравнению с контролем; р1 - уровень значимости достоверных различий между группами
Параметр М характеризует средний приток эритроцитов в единице объема ткани в зондируемом участке в интервале времени регистрации. Значение М характеризует увеличение или снижение перфузии [4]. При анализе полученных данных, показатель М в контрольной группе в 1,4 раза превышал данные в 1 группе (р=0,036). Вместе с тем, во 2 группе значение М оказалось ниже в 1,7 раза, чем в контрольной и в 1,2 раза чем в 1-й группе (р=0,010, p1=0,046).
Показатель σ – это среднее колебание перфузии относительно среднего арифметического потока крови М. Он характеризует временную изменчивость перфузии, отражает среднюю модуляцию кровотока во всех частотных диапазонах. Чем выше значение σ, тем более глубокая модуляция микрокровотока происходит. Снижение данного показателя свидетельствует об угнетении активных вазомоторных механизмов модуляции тканевого кровотока или преобладании в регуляции тонических симпатических влияний [2,4]. По полученным результатам, значение σ в группе контроля выше, чем в 1 группе в 2,5 раза (p<0,001). Показатель σ во 2 группе в 4,2 раза ниже, чем в группе контроля и в 1,7 раза чем в 1 группе (p<0,001, p1=0,048).
Параметр Кv характеризует соотношение М и σ. Увеличение значения Кv отражает улучшение микрогемодинамики. Показатели Кv, М и σ дают общую оценку состоянию микроцикуляторного русла [4]. Показатель Кv в контрольной группе выше, чем в 1 группе больных в 1,6 раза (р=0,006). Уменьшение значения Кv зарегистрировано во 2 группе - в 2,5 раза по сравнению с контролем и в 1,9 раза по сравнению с 1 группой (p<0,001, p1=0,035).
Значение индекса эффективности микроциркуляции (ИЭМ) характеризует соотношение пассивных и активных механизмов регуляции микроциркуляции [4]. Наибольшее снижение ИЭМ отмечено во 2 группе – в 1,1 раза по сравнению с контрольной и 1 группами (р=0,043, p1=0,039).
Каждый ритмический компонент при спектральном анализе ЛДФ-граммы характеризуется двумя параметрами: частотой и амплитудой. Природа колебательных процессов в системе микроциркуляции достаточно сложна. На сегодняшний день установлено, что спонтанные колебания кровотока в тканях во многом обусловлена вазомоциями. Римическая структура флаксмоций, которая выявляется с помощью спектрального анализа ЛДФ-граммы, есть интегральный результат суперпозиции миогенных, нейрогенных, дыхательных, сердечных и других косвенных влияний на состояние микроциркуляции [2].
Все регистрируемые амплитуды осцилляций кровотока эндотелиального, нейрогенного, миогенного, эндотелиально-независимого происхождения прямо связаны с величинами просвета микрососудов, и следовательно, с мышечным тонусом. Снижение осцилляций сочетается с повышением тонуса и жесткости самой сосудистой стенки, и наоборот, повышение амплитуд является следствием снижения сосудистого тонуса [4].
При анализе максимальных амплитуд кровотока установлено, что Аэ в контрольной группе превышает показатели в 1 и 2 группах больных в 1,9 и 3,8 раза (р=0,046, p<0,001). В тоже время, показатель Аэ во 2 группе ниже, чем в 1 группе в 2 раза (p1=0,032).
При анализе полученных данных, уровень Ан выше, чем показатели в группах больных в 2,1 и 3,2 раза (р=0,041, р=0,037). Значение Ан во 2 группе больных ниже, чем показатель в 1 группе больных в 1,5 раза (p1=0,047).
По результатам исследования, уровень Ам в контрольной группе превышает показатели в 1 и 2 группах больных в 2,6 и 2,7 раза (р=0,018, р=0,026).
Показатель Ад в контрольной группе превышает показатели в группах больных в 1,5 и 2,3 раза (р=0,048, р=0,029). В тоже время, во 2-й группе значение Ад ниже, чем показатель в 1 группе больных в 1,5 раза (p1=0,022).
Исходя из полученных результатов, значение Ас в контрольной группе выше показателей в 1 и 2 группах больных (р=0,032, р=0,025).
По результатам исследования, значение ПШ в контрольной группе ниже, чем показатель в 1 группе больных в 1,5 раза (р=0,040). Вместе с тем, уровень ПШ в 1 группе больных выше в 1,3 раза, чем во 2 группе (p1=0,040).
Заключение. Таким образом, у больных панкреатитом изменяется состояние микроциркуляции. Идет обеднение кровотока, снижение вариабельности, что свидетельствует о снижении активных факторов регуляции микроциркуляции и повышении сосудистого тонуса у больных с данной нозологией. Очевидно, что развивается эндотелиальная дисфункция с нарушением механизмов локального поддержания кровотока. У больных с отечной формой повышается шунтовой сброс крови минуя нутритивное русло, при этом при деструктивной форме по сравнению с первой регистрируются более существенные изменения микроциркуляции и компонентов регуляции сосудистого тонуса.
