Введение. Репаративная регенерация – это процесс восстановления или воссоздания новых структур в результате их повреждения физическими, механическими, химическими травмами и различными патологическими процессами [4]. Одна из основных задач регенераторного процесса при заживлении ран заключается в закрытии дефекта с целью восстановления барьерно-защитных свойств кожного покрова, при этом на месте каждого дефекта возникает неполноценный регенерат.
В связи с этим актуальным является поиск методов лечения, обеспечивающих не только ускорение сроков заживления раневого дефекта, но и восстановление первоначальной структуры утраченной части кожи [2]. Кроме того, любая травма сопровождается воспалительным процессом, который включает в себя комплекс изменений на молекулярном, клеточном и тканевом уровнях, составляющий в целом механизм начальной стадии регенерации [4].
Несмотря на существующий широкий перечень препаратов, повышающих уровень репаративной активности, интерес к изысканию более дешевых, безвредных и доступных стимулирующих регенерацию средств остается высоким [6]. Перспективным направлением создания безопасных ранозаживляющих средств является получение препаратов из пиявки медицинской (Hirudo medicinalis). Известно, что водное извлечение из порошка пиявки медицинской лиофилизированной (НМ-1, ЗАО «Международный Центр Медицинской Пиявки», Россия) обладает выраженным противовоспалительным действием [8,9] В секрете пиявки медицинской содержится большое количество биологически активных веществ, которые сохраняются при сублимационной сушке, что позволяет создать новые ранозаживляющие лекарственные формы на основе лиофилизированного порошка.
Целью исследования явилась экспериментальная оценка ранозаживляющей активности водного извлечения из порошка пиявки медицинской лиофилизированной.
Материалы и методы. Оценку ранозаживляющей активности водного извлечения из порошка пиявки медицинской лиофилизированной (препарат НМ-1, ЗАО «Международный Центр Медицинской Пиявки», Россия) проводили в экспериментах на 60 крысах линии Вистар обоего пола массой 200±20 г. Животных содержали в стандартных условиях вивария Тверской государственной медицинской академии в соответствии с правилами качественной лабораторной практики [7]. Перед постановкой эксперимента животные проходили карантин в течение 10-14 дней.
У всех подопытных животных под эфирным наркозом удаляли лоскут кожи площадью 225 мм2 на левой боковой поверхности тела. Величина травмы составляла приблизительно 5% от общей поверхности кожи животных. Заживление ран происходило открытым способом. В течение всего эксперимента оценивали общее состояние подопытных животных, определяли массу тела. Ежедневно проводили планиметрию ран c помощью прозрачной пленки и миллиметровой бумаги [10], оценивали внешний вид ран, наличие и характер отделяемого, вид струпа, отмечали сроки полного заживления ран.
Относительное уменьшение площади раны (∆S) определяли по формуле Л.Н. Поповой (1) [10]:
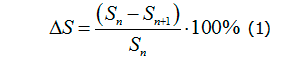
где Sn– величина площади раны при первом измерении (мм2); Sn+1 – величина площади раны в день последующего измерения (мм2).
Скорость заживления ран (процент уменьшения площади за сутки) вычисляли по формуле (2):
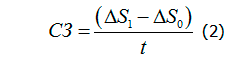
где СЗ – скорость заживления, 1 - процент уменьшения площади ран от исходной на момент измерения, 0 - процент уменьшения площади ран при предыдущем измерении, t – количество дней между измерениями.
Подопытным животным группы наблюдения ежедневно, начиная со 2-го дня, в течение 21-го дня после нанесения травмы наносили на раневую поверхность водное извлечение из пиявки медицинской лиофилизированной (0,05 мл). Животные группы контроля в те же сроки получали изотонический раствор натрия хлорида.
Ранозаживляющую активность исследуемого препарата пиявки медицинской оценивали по выживаемости подопытных животных, продолжительности полной эпителизации раневого дефекта по сравнению с контролем. До начала исследования, а также на 5, 10 и 15-е сутки производили биопсию краев ран с прилежащими к области дефекта участками неповрежденной кожи. Материал фиксировали в 10% формалине (pH=7,4) в течение 24 часов с последующей проводкой по спиртам восходящей концентрации и ксилолам. Гистологические срезы окрашивали гематоксилином и эозином. Микроскопическое исследование полученных срезов выполняли на бинокулярном микроскопе «Микромед» при увеличении в 400 раз. С помощью окуляр-микрометра проводили биометрию участков образующихся тканей: высоту струпа, грануляционной ткани, пограничной зоны эпителия, лейкоцитарного вала и протяженность эпителиального клина [12].
Результаты исследования обработали статистически с применением стандартного пакета программ Microsoft Office Excel 2003. Для ряда выборок вычисляли среднюю арифметическую и среднюю квадратическую ошибку. Определение нормальности распределения переменных проводили на основании гистограмм распределения, величины ассиметрии и эксцессы. Для оценки достоверности различия выборок, имеющих нормальное распределение, применяли параметрический t-критерий Стьюдента. За достоверное принимали различие при уровне вероятности 95% и более (p<0,05).
Результаты исследования и их обсуждение. Анализ результатов экспериментального исследования показал, что у всех подопытных крыс на 2-е сутки эксперимента раневой дефект полностью покрыт рыхлым струпом. У крыс группы контроля течение первых 5 дней наблюдали гнойно-воспалительную реакцию мягких тканей, окружающих дефект, и сопровождающаяся экссудацией с примесью крови. Вокруг раны отмечали зону гиперемии шириной 5-6 мм. У животных, получавших накожно изотонический раствор натрия хлорида, в среднем на 13,2 сутки (p<0,05) произошло отделение струпа от вновь образованного эпителия. Полное заживление раневого дефекта в группе контроля произошло на 19,2±1,4 сутки.
У животных, получавших наружно водное извлечение из пиявки медицинской лиофилизированной, было отмечено уменьшение гнойно-экссудативной воспалительной реакции. Об этом свидетельствовало отсутствие скопления гноя под струпом. В ходе планиметрического исследования было установлено, что начиная в среднем с 4-х суток (p<0,05) площадь раневой поверхности у крыс опытной группы была достоверно меньше, чем в контроле (рис. 1).
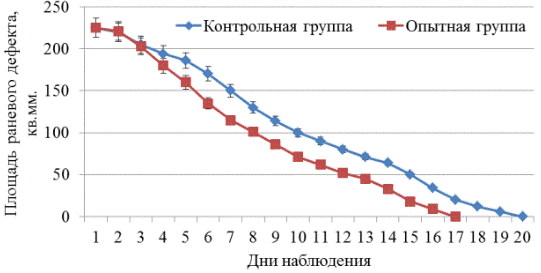
Рис. 1. Изменения площади полнослойной раны у подопытных крыс под влиянием водного извлечения пиявки медицинской лиофилизированной.
Полное отделение струпа у животных опытной группы наблюдали в среднем на 11,2 сутки(p<0,05), что в 1,2 раза позже, чем в контроле. Скорость заживления ран у крыс, получавших наружно извлечение из пиявки медицинской, была достоверно (p<0,05) выше по сравнению с контролем только в первые 7 суток после нанесения травмы (рис. 2).
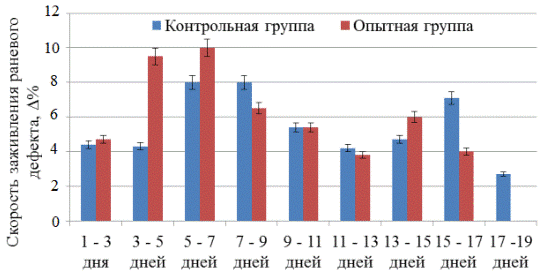
Рис. 2. Динамика изменения скорости заживления раневых дефектов у крыс под влиянием водного извлечения пиявки медицинской.
Полное заживление полнослойных хирургических ран отмечали в среднем на 16,4 сутки (p<0,05), что в 1,2 раза (p<0,05) быстрее, чем у крыс, получавших наружно изотонический раствор натрия хлорида.
Проведенные гистологические исследования позволили установить, что применение водного извлечения из пиявки медицинской лиофилизированной способствовало активации процессов регенерации и созревания соединительной ткани, а также рост эпителия по поверхности раны. Так, анализ морфологических данных показал, что до начала лечения у крыс опытной и контрольной групп поверхность раны была покрыта массивным струпом, состоящим из свернувшейся плазмы и дегенеративно измененных клеток и плотно спаянным с подлежащими структурами. Наблюдали инфильтрацию лейкоцитов в соединительную ткань и подкожную жировую клетчатку. Полученная картина свидетельствовала о первой стадии воспалительного процесса. В краях раны отмечали наличие волосяных фолликулов и сальных желез.
На 5-е сутки эксперимента у крыс группы контроля не было обнаружено значимых изменений поверхности раны, дермы и подкожной жировой клетчатки по сравнению с исходным состоянием. На поверхности дефекта сохранялся струп толщиной 247,2±13,5 мкм. Рана была заполнена грануляционной тканью (679±16,3 мкм), в которой были заметны вертикально расположенные кровеносные сосуды, образующие у поверхности петли. Промежутки между сосудами были заполнены клеточным содержимым, в котором преобладали макрофаги, лимфоидные клетки, гистоциты. Отмечали наличие ориентированных в разных направлениях фибробластов. Наблюдали наличие лейкоцитарного вала высотой 102,3±4,6 мкм. Эпителий на границе с раневым дефектом был гипертрофирован (183,5±10,1 мкм) и образовывал разрастания в подлежащую ткань. От краевого участка отрастал эпителиальный регенерат протяженностью 256,7±10,2 мкм, состоящий из 4 – 5 слоев клеток.
У крыс опытной группы на 5-е сутки наблюдения струп, закрывающий раневой дефект, имел толщину 144±5,6 мкм, что в среднем в 1,5 раза меньше (p<0,05), чем в контроле (221±4,3 мкм). Лейкоцитарный вал по толщине не имел достоверных отличий с контролем и состоял из массы фибрина и дегенеративно измененных лейкоцитов. Наблюдали наличие грануляционной ткани, состоящей из множества параллельно расположенных в вертикальном направлении кровеносных сосудов и имеющую толщину 952,4±19,1 мкм, что в 1,4 раза больше (p<0,05), чем в контроле. По ходу кровеносных сосудов было выявлено наличие активной пролиферации фибробластов. По краям дефекта наблюдали активную пролиферацию эпителия с выростами в подлежащую ткань. В местах выроста отмечали большое количество клеток с отчетливо наблюдающимися фигурами митозов. Эпителий на границе был толще в среднем в 1,1 раза (p<0,05), чем у крыс контрольной группы. Выявили значительную протяженность эпителиальный регенерата (411,3±15,3 мкм), которая была в 1,6 раза больше (p<0,05), чем в контроле (табл. 1).
Таблица 1. Морфологические изменения при полнослойной ране у крыс на 5-е сутки после травмы
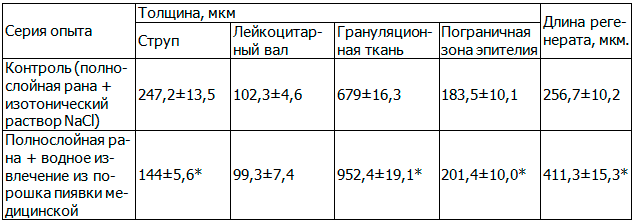
Примечание: здесь и далее * - различия с контролем достоверны (p<0,05).
На 10 сутки наблюдения у животных группы контроля сохранялся небольшой лейкоцитарно-некротический слой. Толщина струпа составила 137,9±11,0 мкм. Лейкоцитарный вал располагался в виде тонкой полосы толщиной 88,6±7,4 мкм. Грануляционная ткань широким пластом (986,0±12,9 мкм) полностью заполняла раневой дефект. В верхней части сохранялся слой вертикально расположенных кровеносных сосудов. Преобладающее место в грануляциях начал занимать слой горизонтально расположенных фибробластов, между которыми были заметны множественные коллагеновые волокна. Большая часть раневой поверхности была покрыта новообразованным эпителием, состоящим из 5–6 слоев клеток. Протяженность регенерата составила 504,5±11,4 мкм. Базальная мембрана эпителиального регенерата была ровная, и лишь в краевых участках она образовывала выросты в подлежащую ткань. Толщина эпителия на границе дефекта составила 125,4±6,0 мкм.
У животных, получавших наружно водное извлечение из порошка пиявки медицинской, на 10 сутки эксперимента наблюдали усиление наметившихся различий с контролем. Так, в 8-и из 10-и образцов препаратов обнаружили полную эпителизацию повреждения. Эпителиальный регенерат имел значительную протяженность и составил 925,1±19,4 мкм, что в среднем 1,8 раза (p<0,05) больше, чем у крыс, получавших наружно изотонический раствор натрия хлорида. На границе дефекта эпителий имел толщину 144, 5±10,2 мкм, что в среднем 1,1 раза (p<0,05) больше, чем в контроле. Струп в среднем в 3 раза (p<0,05) был тоньше по сравнению с контролем и сохранялся только в центре дефекта в виде отдельных фрагментов. Под ним наблюдали наличие лейкоцитарного вала высотой 32,1±6,4 мкм, что в среднем в 2,7 раза (p<0,05) меньше, чем в контроле. В небольших участках раны, не покрытых эпителием, отмечали не полную дифференцировку грануляционной ткани, у поверхности которой был расположен небольшой слой вертикально ориентированных кровеносных сосудов. Наблюдали, заполнение основной части дефекта слоем горизонтально расположенных фибробластов, между которыми было отмечено наличие многочисленных коллагеновых волокон. Выявили небольшое уплотнение грануляционной ткани (904,8±18,3 мкм против 986,0±12,9 мкм в контроле). По краям раневого дефекта отмечено формирование молодой соединительной ткани (табл. 2, рис. 3).
Таблица 2. Морфологические изменения при полнослойной ране у крыс на 10 сутки после травмы
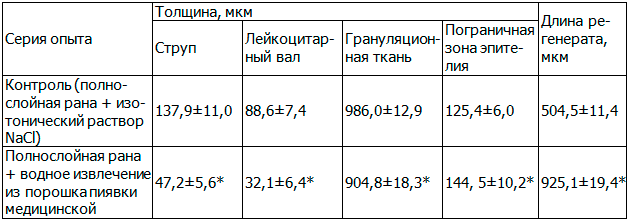

Рис. 3. Гистологическая картина раневого дефекта у крыс опытной группы, 10 сутки. Окраска гематоксилином и эозином. Увеличение 400х.
На 15 сутки наблюдения у крыс контрольной группы наблюдали покрытие раневой поверхности многослойным пластом новообразованного эпителия, состоящим из 7–8 рядов клеток. Отмечали неровную базальную мембрану, образующую в краевых участках выросты в подлежащую ткань. Под эпителием выявили наличие молодой соединительной ткани со всеми характерными для нее клеточными элементами и волокнистыми структурами.
У крыс опытной группы на 15 сутки эксперимента область повреждения покрыта многослойным эпителием, состоящим из 8-10 слоев клеток. У краев дефекта количество слоев было несколько увеличено. Регенерат имел вид тонкой ленты с дифференцировкой на слои. На протяжении всего образованного эпителия базальная мембрана образовывала многочисленные выросты в подлежащую ткань с признаками формирования производных кожи. Отмечали наличие более зрелой соединительной ткани, которая имела признаки здоровой дермы.
Результаты эксперимента показали, что водное извлечение из пиявки медицинской лиофилизированной существенно ускоряет эпителизацию и созревание грануляционной ткани при полнослойной хирургической ране у крыс. Репаративный эффект водного извлечения из препарата пиявки медицинской лиофилизированной можно, по-видимому расценивать, как интегральный результат иммуностимулирующего, антисептического и противовоспалительного действия веществ, входящих в состав пиявки медицинской [5]. Анализ изменения скорости заживления раневого дефекта показывает, что вещества, входящие в состав экстракта, оказывают стимулирующее влияние на фазу воспаления. Известно, что в состав пиявки медицинской входят ингибиторы калликреина [3], которые способствуют также инактивации кинина. Это уменьшает сосудистую проницаемость, что приводит к уменьшению притока в зону дефекта различных клеточных популяций, в том числе лейкоцитов [1]. Этим, возможно, объясняется уменьшение высоты лейкоцитарного вала по сравнению с контролем. Снижается проявление воспалительной реакции. Имеются данные об активации фагоцитарной активности веществами пиявки медицинской [11], что способствует очищению раны от некротических тканей, инородных тел и погибших клеток. Макрофаги высвобождают хемотаксические факторы, которые способствуют увеличению количества фибробластов и развитию сосудов [1]. Уменьшение вязкости крови под действием гирудина, содержащегося в экстракте пиявки, способствует улучшению трофики образующихся тканей и переходу грануляционной ткани в соединительную.
Выводы
- Сроки эпителизации полнослойной раны у крыс при наружном применении водного извлечения пиявки медицинской лиофилизированной составили 16,4±0,3 суток, что было в среднем в 1,2 раза (p<0,05) быстрее, чем в контроле.
- На 10-е сутки после травмы раневая поверхность была покрыта фрагментированным струпом, под которым располагались лейкоцитарный вал, эпителиальный клин, базальная мембрана и грануляционная ткань. При применении экстракта пиявки протяженность эпителиального клина и высота эпителия на границе были соответственно в 1,8 раза (p<0,05) и в 1,1 раза (p<0,05) больше, а толщина грануляционной ткани в 1,1 раза (p<0,05) меньше, чем в контроле.
