Введение. Острый холецистит является самым частым осложнением желчнокаменной болезни. Примерно у 90% больных острый холецистит развивается на фоне желчно-каменной болезни (ЖКБ), а в 10% - при отсутствии камней в желчном пузыре. Чаще всего острый холецистит развивается у тяжелобольных и лиц пожилого возраста, сопровождается большим числом осложнений и, соответственно, более высокой летальностью. Наиболее часто используемая в настоящее время лапароскопическая техника оперативного лечения также имеет ряд недостатков, связанных с созданием напряженного карбоксиперитонеума, что в свою очередь негативно влияет на сердечно-сосудистую и дыхательную системы, особенно у пациентов с повышенным анестезиолого-операционным риском (пожилого и старческого возраста). В статье приводится сравнительный анализ особенностей течения, длительности послеоперационного периода и сведений о послеоперационной летальности у пациентов с повышенным анестезиолого-операционным риском с острым калькулезным холециститом при выполнении традиционной холецистэктомии (ХЭ), лапароскопической холецистэктомии (ЛХЭ) с минимальным давлением (min P) в брюшной полости (6-7 мм рт.ст.) и лапароскопической холецистэктомии с использованием веерообразного лапаролифта (ЛФ). Полученные в ходе исследования данные подтверждают эффективность использования веерообразного лапаролифта во время лапароскопической холецистэктомии у пациентов пожилого и старческого возраста с острым деструктивным холециститом.
Актуальность. По данным ВОЗ у каждого четвертого жителя нашей планеты в возрасте от 60 до 70 лет обнаруживаются желчные конкременты. Наиболее сложную группу, с точки зрения выбора наиболее рационального способа оперативного лечения, представляют больные пожилого и старческого возраста.
В настоящее время около 60% больных, госпитализированных в хирургические стационары по поводу острого холецистита, являются людьми пожилого и старческого возраста. Одновременное наличие возрастных изменений и сопутствующих заболеваний относят этих лиц к категории больных с высоким риском неблагоприятного исхода [5,15,26].
При лечении больных острым холециститом наиболее оправданной является активная лечебная тактика. В настоящее время современные технологии до минимума сократили диагностический период, значительно расширили арсенал хирургических пособий и позволили использовать активную лечебную тактику у большинства больных острым холециститом [6,12,25].
Активная лечебная тактика должна применяться при всех деструктивных формах острого холецистита, протекающего с клиническими признаками гнойной интоксикации или перитонита. Выжидательная лечебная тактика предпочтительна только при катаральной форме острого холецистита, который удается купировать в большинстве случаев в результате проводимого консервативного лечения [12,23].
Наиболее сложную группу, с точки зрения диагностики и выбора рациональной хирургической тактики, представляют больные пожилого и старческого возраста. Сопутствующие заболевания в данной группе встречаются у 84,6-100% пациентов, а у трети больных носят конкурирующий характер. Прогноз у данной категории больных отягощён наличием многогранной сопутствующей патологии и большой частотой развития послеоперационных осложнений, не редко в результате неправильно выбранной лечебной тактики. Данная группа больных относится к категории высокого операционно-анестезиологического риска [7,11,22].
До середины 80-х годов классическим методом оперативного лечения оставалась традиционная холецистэктомия, выполняемая из широкого лапаротомного доступа. Однако широкая лапаротомия, является большой травмой, приводящей в послеоперационном периоде к значительному болевому синдрому и ухудшению показателей функции дыхания, что особенно опасно у больных пожилого возраста [6,10,24]. Меньшую, но также достаточно большую операционную травму наносят пациентам оперативные вмешательства из мини-лапаротомного доступа, с или без применения системы «мини-ассистент» [17].
Лапароскопические операции являются наименее травматичными хирургическими вмешательствами, однако, у лиц пожилого возраста с тяжелой сопутствующей патологией со стороны сердечно-сосудистой системы влияние напряженного карбоксиперитонеума опасно вследствие снижения компенсаторных возможностей организма [16]. При создании пневмоперитонеума внутрибрюшная гипертензия может привести к декомпенсации сердечной деятельности, расстройству дыхания.
Лапароскопические технологии с каждым годом все более утверждаются в клинической практике как высокотехнологичный метод оперативного лечения в экстренной и плановой хирургии [4]. Вместе с тем одной из проблем, ограничивающих лапароскопический метод, является создание напряжённого пневмоперитонеума, применение которого может привести к возникновению осложнений как общего, так и местного характера: сдавление нижней полой вены и увеличение портального давления; нарушение кровотока в органах брюшной полости; снижение сердечного выброса и сердечного индекса; уменьшение остаточной емкости легких, увеличение мертвого пространства, гиперкапния и ацидоз; снижение рН слизистой оболочки тонкой кишки, ухудшение транспорта кислорода тканям этого органа и ее гипоксия [1,2,8]. Описанные нарушения вызывают особо негативные последствия у людей с тяжелой сопутствующей кардиоваскулярной и респираторной патологией [9,21], что соответственно и ограничивает применение лапароскопии у данной категории пациентов.
Перечисленные обстоятельства побуждают к поиску методов выполнения лапароскопии без инсуффляции газа в брюшную полость. Поиск методик, уменьшающих негативное влияние напряженного карбоксиперитонеума на сердечно-легочную систему больного, привел к появлению «безгазовых» методов выполнения лапароскопической холецистэктомии [17,20,26].
Одним из вариантов решения этой проблемы явилось использование лифтинговой технологии, позволяющей создать оперативное пространство в брюшной полости путем подъёма передней брюшной стенки. Многие хирурги предлагают использовать этот вид оперативного вмешательства у пациентов с тяжелой сопутствующей сердечно-легочной патологией [12,13,22]. Однако необходимость наличия дополнительного оборудования и недостаточное совершенство лифтинговых конструкций тормозит достаточно широкое распространение лапароскопической холецистэктомии без применения напряженного карбоксиперитонеума.
К несомненным преимуществам безгазовых лапароскопических операций следует отнести отсутствие гемодинамических и метаболических расстройств во время оперативного вмешательства, а также уменьшение вероятности их возникновения в послеоперационном периоде, что приводит к снижению послеоперационных осложнений и, соответственно, — летальности в указанной группе пациентов [6,12]. В 1995 году И.В. Федоровым было сделано сообщение о внедрении «безгазовой» лапароскопии, которая стала альтернативой напряженного пневмоперитонеума [19]. Известно множество разнообразных по конструкции лапаролифтов. Некоторые из них вводятся через разрез мягких тканей брюшной стенки под кожу живота или в брюшную полость [3,14]. В лапароскопической хирургии выделяются следующие геометрические характеристики лапаролифтинга (точечный, линейный, плоскостной).
В настоящее время известно более десятка различных вариантов подъемников. В зависимости от местонахождения ретракторов выделяют два типа эндолифтов: с подкожным и внутрибрюшинным расположением лапаролифтов [14,18]. Наиболее известными по литературным данным лапаролифтами являются: проволочные, Т-образные, присасывающиеся к коже живота, веерообразные. Мнение большинства авторов в отношении первых трех подъемников негативное - практически все они имеют недостатки.
Поэтому отсутствие в настоящее время универсального лапаролифта и сохраняющаяся необходимость оперативного лечения пациентов с острым деструктивным холециститом с повышенным анестезиолого-оперативным риском побудило нас к проведению данного исследования.
Цель исследования. Разработать алгоритм выбора метода хирургического лечения больных пожилого и старческого возраста с острым деструктивным холециститом и оценить эффективность применения веерообразного лапаролифта у пациентов с повышенным анестезиолого-операционным риском.
Материалы и методы. В работе обобщены результаты лечения 106 пациентов пожилого и старческого возраста с острым холециститом, находившихся на лечении в хирургических отделениях с 2008 по октябрь 2014 г. Средний возраст пациентов составил 74,2±4,3 года.
Холецистэктомия из лапаротомного доступа выполнена 40 (37,7%) пациентам (I группа), 35 (33,0%) больным - лапароскопическая холецистэктомия с минимальным давлением в брюшной полости 6-7 мм рт.ст. (II группа), и 31 (29,2%) пациенту выполнена лапароскопическая холецистэктомия с использованием, разработанного в нашей клинике, веерообразного лапаролифта (III группа) [10] (рис.1).
Мужчин - 19 (17,9%) больных, женщин - 87 (82,1%) (табл. 1).

Рис. 1. Веерообразный лапаролифт
Таблица 1. Распределение пациентов по полу
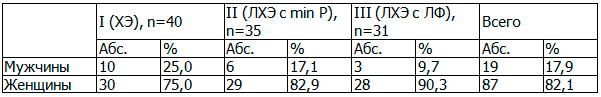
У всех больных имелись сопутствующие заболевания, в ряде случаев по тяжести клинических проявлений, конкурировавшие с основным заболеванием (табл. 2).
Таблица 2. Сопутствующие заболевания
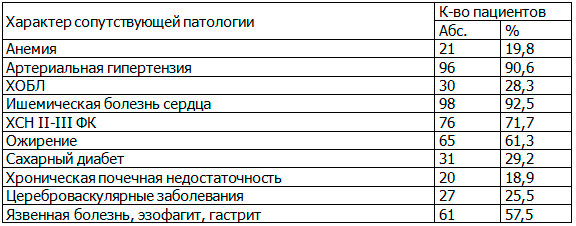
Примечание: ХОБЛ — хроническая обструктивная болезнь легких, ХСН — хроническая сердечная недостаточность, ФК — функциональный класс.
Всем пациентам в течение первых суток проводились следующие лабораторные методы исследования: общий анализ крови, коагулограмма, общий анализ мочи, биохимический анализ крови. Инструментальные методы обследования: ультразвуковое исследование (УЗИ) органов брюшной полости, электрокардиография, рентгенография органов грудной клетки.
Достоверных отличий по возрасту, половой принадлежности, характеру сопутствующей, а также острой и хронической патологии при поступлении между группами не выявлено.
С целью объективизации оценки тяжести общего состояния и прогнозирования исходов лечения использована шкала Simplified Acute Physiology Score – SAPSII (табл. 3).
Таблица 3. Шкала SAPSII
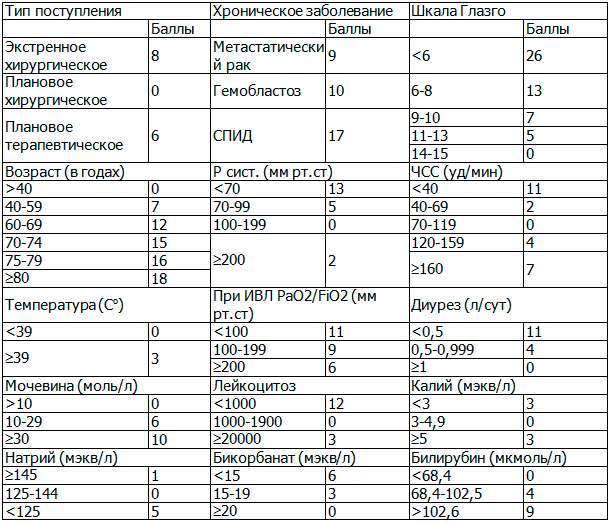
Примечание: СПИД — синдром приобретенного иммунодефицита, ИВЛ — искусственная вентиляция легких, ЧСС — частота сердечных сокращений, Р сист. — систолическое артериальное давление.
Определение степени тяжести общего состояния по SAPSII заключалось в суммировании балльных показателей шкалы с вычислением величины прогностического индекса внутрибольничной летальности. В ходе исследования оценка тяжести состояния пациентов по системе SAPSII производилась в момент госпитализации.
Хранение результатов исследования и первичная обработка материала проводились в оригинальной базе данных Microsoft Excel 2000. Проверка на нормальность распределения проводилась с помощью критерия хи-квадрат. При анализе материала рассчитывались средние величины (M), их стандартные ошибки (m), стандартные отклонения (SD) и 95% доверительный интервал. Так как большинство выборок подчинялось нормальному закону распределения, с целью унификации данные представлены в виде М±m.
Результаты исследования. Все больные оперированы в экстренном порядке, после предоперационной подготовки, которая включала в себя дезинтоксикационную, противовоспалительную, инфузионную, противоязвенную, антибактериальную терапию, лечение сопутствующих заболеваний и определение балльного показателя по шкале SAPS II.
Показатели SAPS II у больных основной группы (III) равнялся 30,9±1,3 балла (p<0,05). В группах сравнения степень тяжести по шкале SAPSII: I — 30,6±2,3 балла, в II — 31,9±1,6 балла. Предположительный риск смерти у пациентов основной группы (III) составил – 9,5±0,6% (p<0,05). В группах сравнения (I, II) — 9,7±0,9%, 11,2±0,6% - соответственно (табл. 4).
Таблица 4. Сумма баллов по шкале SAPSII и предположительный риск смерти пациентов в исследуемых группах

Показаниями для экстренного оперативного вмешательства являлся острый деструктивный холецистит, который имел место у всех пациентов данных групп.
В основной группе (III) эмпиема желчного пузыря выявлена у 5 пациентов (16,1%), а в группах сравнения (I,II) – у 10 (25,0%) и 8 (22,9%) пациентов соответственно. Острый флегмонозный холецистит диагностирован у 27 (87,1%) пациентов основной группы, а в группах сравнения (I,II) — у 31 (77,5%) и 28 (80,0%) пациентов, соответственно. Перивезикальный инфильтрат выявлен у 13 (37,1%) пациентов, которым выполнялась лапароскопическая холецистэктомия при минимальном пневмоперитонеуме, а также у 12 (30,0%) пациентов I группы, и у 11 (35,5%) больных, которым во время лапароскопической холецистэктомии использован веерообразный лапаролифт. Местный перитонит выявлен у 12 пациентов I группы (30,0%), у 11 пациентов II группы (31,4%) и у 10 (32,3%) пациентов основной группы.
В одной из контрольных групп, где операция выполнялась с пневмоперитонеумом с минимальным давлением газа в брюшной полости (6-7 мм рт. ст.) - был отмечен недостаточный обзор операционного поля, что существенно затрудняло выполнение оперативного вмешательства.
При сравнительной оценке динамики клинических показателей у больных контрольных групп, перенесших традиционную холецистэктомию и лапароскопическую холецистэктомию с минимальным давлением в брюшной полости, отмечается более медленная их нормализация. Длительность болевого синдрома в послеоперационном периоде после лапароскопической холецистэктомии с использованием веерообразного лапаролифта в среднем составила 3,4±0,8 суток, после открытой холецистэктомии боли в области послеоперационной раны сохранялись 7,3±1,2 суток, а в группе у пациентов с использованием минимального давления во время лапароскопической холецистэктомии — 3,9±0,9 (p<0,05).
В основной группе отмечалась наиболее ранняя активизация больных (на 1,1±0,6 сутки) после операции; более поздняя во второй группе (1,9±0,3 суток) и самая длительная — после традиционной холецистэктомии - на 3,8±1,3 сутки (p<0,05). В наибольшей степени это связано с различием в оперативном доступе, и, следовательно, с объемом операционной травмы, что играет немаловажную роль для ранней активизации пациентов в послеоперационном периоде, а следовательно и в профилактике тромбоэмболических осложнений.
Нормализация температуры тела у пациентов основной группы проходила в наиболее ранние сроки после операции, достигая нормы к 4,1±1,1 суткам, в то время как больным контрольных групп (I, II) на это требовалось больше времени - 6,9±1,4 и 5,3±1,4 суток, соответственно (p<0,05).
При сравнении количества лейкоцитов периферической крови, биохимических показателей крови в послеоперационном периоде отмечается нормализация всех исследуемых параметров у больных основной группы к 3,9±1,0 суткам. После традиционной холецистэктомии и лапароскопической холецистэктомии с использованием минимального давления газа в брюшной полости динамика нормализации клинических и лабораторных показателей была хуже: I группа – 6,5±1,3 суткам, II группа - 6,1±1,2 (p<0,05).
Продолжительность пребывания пациента в стационаре больных после традиционной холецистэктомии составила 16,2±2,2 койко-дней, у пациентов, которым выполнялась лапароскопическая холецистэктомия с минимальным давлением газа в брюшной полости - 11,6±1,2 койко-дней, а в основной группе - 8,9±1,1 койко-дней (p<0,05), что также является немало важным критерием при выборе способа оперативного лечения.
Процент послеоперационных осложнений и летальность в исследуемых группах представлена в табл. 5.
Таблица 5. Послеоперационные осложнения и летальность

В группе, где использована традиционная холецистэктомия, выявлены следующие послеоперационные осложнения: у 5 (12,5%) больных выявлена пневмония, у 4 (10,0%) пациентов острый панкреатит, транзиторная ишемическая атака у 1 больного (2,5%).
В группе, где использована лапароскопической холецистэктомия с минимальным давлением, выявлены следующие послеоперационные осложнения: у 2 (5,7%) пациентов выявлена пневмония с экссудативным плевритом, у 1 (2,9%) пациента - острый панкреатит; острый коронарный синдром (нестабильная стенокардия) выявлен у 1 (2,9%) больного и транзиторная ишемическая атака - у 1 пациента (2,9%).
В III группе, послеоперационные осложнения выявлены у 3 пациентов (9,7%). Отмечен острый панкреатит в послеоперационном периоде у 2 (6,5%) пациентов, у одной пациентки развилась тромбоэмболия мелких ветвей легочной артерии (3,2%). Данные осложнения купированы медикаментозной терапией.
Сравнивая количество и тяжесть послеоперационных осложнений у больных, где был использован веерообразный лапаролифт, отмечено меньшее количество осложнений и меньшая их тяжесть. Со стороны послеоперационных ран осложнений отмечено не было.
В группе, где использована традиционная холецистэктомия летальность составила 15,0% (6 пациентов), во II группе – 8,6% (3 пациента) и в основной (при использовании веерообразного лапаролифта) - 3,2% (1 пациент).
Выводы. Полученные в ходе исследования данные позволяют сделать вывод, что применение веерообразного лапаролифта, при лапароскопической холецистэктомии для лечения острого деструктивного холецистита у пациентов с повышенным анестезиолого-операционным риском улучшает результаты лечения данной категории больных (улучшает течение раннего послеоперационного периода, снижает процент послеоперационных осложнений и летальность, уменьшается длительность пребывания пациента в стационаре), и следовательно позволяет расширить показания к выполнению лапароскопических операций у пациентов, имеющих противопоказания к пневмоперитонеуму.
