Лечение больных с неспецифическими эмпиемами плевры на разных стадиях заболевания требует различных подходов. При первой и второй стадиях неспецифических эмпием плевры (ЭП) возможно излечить больного с помощью малотравматичных хирургических вмешательств, таких как пункция, дренирование, торакоскопия. В третьей стадии больным необходимо выполнение обширных операций, таких как плевропульмонэктомия, плевролобэктомия, декортикация легкого и др. [1, 6, 11].
Именно поэтому особенно важно дифференцировать третью стадию ЭП от других стадий процесса. В нашей работе при определении стадии ЭП мы столкнулись с двумя трудностями. Во-первых, для определения стадий ЭП существуют несколько параллельных классификаций. Наиболее часто используются классификация N. Andrews и соавт. (1962) [8]. Так же широко используется классификация по морфологическим стадиям ЭП Г.И. Лукомского (1976) [4]. С одной стороны эти классификации дополняют друг друга, однако такое разнообразие свидетельствует об отсутствии однозначных количественных критериев перехода одной стадии ЭП в другую. Во-вторых, во всех известных классификациях присутствуют морфологические характеристики, поэтому наиболее точно определить стадию ЭП позволяет биопсия с полноценным гистологическим исследованием. Однако выполнение биопсии неизбежно ведет к травме легкого, что у больных с ЭП может вызвать формирование бронхиального свища и резко ухудшить прогноз. Поэтому для исследования обычно забирают небольшой участок легкого, что мешает с абсолютной уверенностью вынести заключение о стадии процесса. Именно поэтому особенно важно дифференцировать третью стадию ЭП от других стадий процесса. Наиболее точно определить стадию ЭП позволяет биопсия с полноценным гистологическим исследованием. Однако, выполнение биопсии неизбежно ведет к травме легкого, что у больных с ЭП может вызвать формирование бронхиального свища и резко ухудшить прогноз. Сказанное и определило цель нашего исследования.
Целью нашего исследования стало совершенствование методов диагностики стадии ЭП.
Материалы и методы. В первой части работы мы решили разработать количественные критерии, позволяющие достоверно диагностировать стадию ЭП при морфологической оценке даже небольшого биоптата. По данным литературы наиболее эффективно провести количественную оценку позволяет иммуногистохимическое исследование [2, 3, 5, 7, 9, 10].
Мы провели исследование по результатам аутопсии 88 больных с неспецифическими ЭП, умерших в стационаре. Мы выделили пациентов, которые наиболее полно соответствуют первой, второй и третьей стадиям известных классификаций. Первую стадию определили у 12 больных, вторую стадию определили у 16 больных, третью стадию выявили у 15 больных.
У этих больных провели иммуногистохимическое исследование в ходе которого оценивали распространенность экспрессии ядерного маркера - регуляторного протеина Ki-67 (в ядрах клеток, вступивших в митоз). Наш выбор основывался на том, что при видимом отсутствии гистологических и гистохимических признаков фиброза, появление большого количества иммунопозитивных клеток к регуляторному белку Ki-67, то есть возрастание пролиферативной активности клеток (без появления клеточной атипии) свидетельствует о начавшемся формировании фиброзных изменений в этих участках ткани легкого - вследствие пролиферации фибробластов [2, 5, 7]. Индекс пролиферации определяли, учитывая число позитивных ядер на 100 учтенных ядер в процентах.
Результаты и обсуждение. Первая стадия ЭП по классификации [8] характеризуется появлением в плевральной полости серозного экссудата. Согласно классификации морфологических стадий ЭП в первой стадии воспалительные изменения в плевре распространяются через глубокую эластическую сеть, отделяющую легкое от его серозного покрова на решетчатый эластическо-коллагеновый слой плевры. В соответствии с этими классификациями первую стадию определили у 12 больных, у которых выявляли воспалительную (лимфолейкоцитарную) инфильтрацию висцеральной плевры и субплеврально расположенной легочной паренхимы, сосудистые расстройства, выражающиеся в полнокровии мелких кровеносных сосудов, а также - умеренно выраженную эмфизему в ткани легкого. Глубже выявляли легочную ткань нормального строения, без эмфиземы и воспалительных изменений.
Согласно полученным данным исследования экспрессии регуляторного протеина Ki-67 у больных в первой стадии ЭП индекс пролиферации составил ≤1%. Таким образом, у этих пациентов сколько-нибудь существенной экспрессии Ki-67 в ткани легких мы не выявили, за исключением единичных клеток, что соответствует естественному (физиологическому) уровню тканевой регенерации (2, 3) и объясняется, с нашей точки зрения, короткими сроками течения заболевания в этой группе больных и преобладанием острых воспалительных процессов над пролиферативными.
Вторая стадия ЭП по классификации [8] характеризуется гнойным экссудатом, возникновением на плевре фибринозных пленок и сращениями между листками плевры, которые разграничивают внутриплевральные осумкования. По классификации морфологических стадий ЭП - во второй стадии (стадии фибринозно-гнойного плеврита) воспалительные процессы развертываются в сосудах эластическо-коллагенового слоя плевры: между коллагеновыми волокнами выявляется фибрин, появляется много сегментоядерных лейкоцитов, происходит разрушение поверхностного и даже глубокого эластического слоев.
Вторую стадию определяли у 16 пациентов, у которых при проведении гистологического исследования на фоне выраженного гнойного воспаления субплеврально расположенной ткани легкого и (в меньшей степени) в висцеральной плевре выявляли новообразование соединительной ткани. Висцеральная плевра у этих больных была утолщена за счет появления хаотично ориентированных коллагеновых волокон. Выявлялись также зрелые фибробласты и лимфоциты, большое количество новообразованных мелких сосудов.
У этих больных в препаратах хорошо визуализировалась пограничная зона, где на фоне воспалительных процессов в легком происходило формирование фиброзных изменений. В этой зоне структурная организация ткани легкого в значительной степени была сохранена, отмечался фиброз отдельных межальвеолярных перегородок, появлялись соединительнотканные тяжи. В глубжележащих участках легочной паренхимы выявляли воспалительную инфильтрацию, незначительные фиброзные изменения в виде появления тонких коллагеновых волокон и фибробластов, что обусловливало появление участков с нарушением структуры альвеол и ацинусов.
У пациентов с второй стадией ЭП в фиброзно-измененных участках плевры и легкого экспрессия Ki-67 обнаруживалась в 3±0,014% ядер клеток соединительной ткани. Здесь находили выраженную воспалительную инфильтрацию и интенсивное новообразование капилляров, в эндотелиоцитах которых определяли наиболее высокую пролиферативную активность. В участках формирующихся фиброзных изменений, в клетках инфильтратов межальвеолярных перегородок выявили средний уровень пролиферации в 17,67±3,63%. В структурно сохраненной легочной ткани экспрессия Ki-67 определялась в 5,6±0,966% ядер. Полученные результаты не противоречат литературным данным, касающимся выраженности пролиферативных изменений, сопровождающих развитие продуктивного воспаления в ткани легких [5].
Третья стадия ЭП по классификации [8] характеризуется образованием плотных шварт, покрывающих коллабированное легкое, и возникновением плеврогенного цирроза легкого. По классификации морфологических стадий ЭП - в третьей стадии на плевре появляется пиогенный слой, листки париетальной и висцеральной плевры по периферии пораженной зоны плотно срастаются, образуя осумкованную полость с гнойным содержимым.
Третья стадия выявлена у 15 больных, у которых плевра и непосредственно прилегающая к ней часть легкого были замещены зрелой волокнистой соединительной тканью, деформирующей орган. В ней выявляли новообразованные сосуды, тесно лежащие пучки коллагеновых волокон и фибробласты. У этих больных также хорошо прослеживалась последовательность патологических изменений ткани легкого. Сразу после зоны выраженного фиброза выявляли переходную зону - зону формирующихся фиброзных изменений, затем зону выраженных воспалительных изменений. Глубже находили ткань легкого, имевшую визуально не измененное строение.
У пациентов с третьей стадией ЭП индекс пролиферации в зоне фиброзных изменений составил 6±2,828 %; в зоне формирующихся фиброзных изменений («переходной зоне») - 18,62±1,652%; в ткани легкого с сохранной гистологической структурой - 12,25±0,831%.
Сравнительное иммуногистохимическое исследование условно выделенных в ткани легкого зон у пациентов данной группы показало, что наиболее выраженная экспрессия Ki-67 отмечается в зоне воспалительных изменений.
Вместе с тем, в зоне легкого с визуально не измененной гистологической структурой экспрессия Ki-67 была также достаточно высока и значительно превышала уровень пролиферации в зоне морфологически не измененного легкого у пациентов со второй стадией ЭП, что говорит о большей активности и склонности к прогрессированию продуктивного воспалительного процесса у больных с выраженными фиброзными изменениями. Результаты исследования представлены в табл. 1.
В результате проведенных исследований мы определили количественные критерии стадий ЭП. Таким образом, при определении в исследуемом образце индекса пролиферации не более 1% диагностируют I стадию ЭП. При определении индекса пролиферации клеток соединительной ткани в зоне воспалительных изменений более 17% и в зоне легкого с визуально не измененной структурой от 5 до 12% диагностируют вторую стадию ЭП, при индексе пролиферации в зоне воспалительных изменений более 17% и в зоне легкого с визуально не измененной структурой более 12% - третью стадию ЭП. Эта методика определения стадии ЭП была запатентована нами как изобретение (Способ диагностики стадии эмпиемы плевры: патент на изобретение №2400752 РФ от 27.09.2010 г.).
Таблица 1. Выраженность экспрессии регуляторного протеина Ki-67 в ткани легкого у пациентов с неспецифическими ЭП (%)
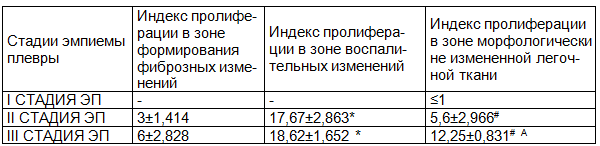
Примечания: критерий Крускала-Уоллиса; * p<0,05 по сравнению с зоной формирующихся фиброзных изменений; # p<0,05 по сравнению с зоной воспалительных изменений; А p<0,05 по отношению к пациентам со II стадией ЭП.
Разработанную нами методику мы внедрили в клиническую практику. При поступлении больного с острой ЭП в клинику, ему проводили торакоскопию и определяли больных, у которых нельзя было исключить третью стадию ЭП. Им выполняли биопсию. Торакоскопию заканчивали санацией и дренированием плевральной полости. В послеоперационном периоде проводили обычное лечение гнойного плеврита. Через 5-7 дней, после получения результата исследования, если у больных определялась первая или вторая стадия ЭП, лечение продолжали с помощью методик миниинвазивной хирургии. При определении третьей стадии ЭП делали вывод о необходимости применения открытых операций - декортикации, плеврэктомии, плевропульмонэктомии и плевролобэктомии, торакопластики и торакомиопластики. Лечение дренированием продолжали до стабилизации общего состояния в целях предоперационной подготовки, после чего выполняли операцию.
Однако, нередко даже такую, сравнительно нетравматичную биопсию выполнять опасно. При этом взятие биопсии париетальной плевры абсолютно не опасно для больного. Поэтому следующим этапом нашего исследования стала разработка нового способа диагностики стадии эмпиемы плевры, позволяющего оценить состояние висцеральной плевры и легкого при исследовании париетальной плевры. На этом этапе работы мы использовали результаты предыдущей части исследования и новые разработки.
В ходе гистологических исследований, мы обратили внимание на то, что визуально зоны фиброза в париетальной и висцеральной плевре были сопоставимы по размерам. Для подтверждения этой гипотезы мы провели гистологическое исследование аутопсийного материала, полученного от 23 пациентов с эмпиемой плевры - ткань легкого с висцеральной плеврой и париетальную плевру.
Исследуемая выборка была разделена на две группы:
- I группа - 12 пациентов с преобладанием в ткани легкого и плевры клеточных (воспалительных) реакций (I и II стадии эмпиемы плевры),
- II группа - 11 пациентов с преобладанием пролиферативных изменений (III стадия эмпиемы плевры).
При проведении статистического анализа данных (линейной регрессии и корреляции) установлено, что ширина фиброзно-измененной висцеральной плевры и легкого и ширина фиброзно-измененной париетальной плевры у одного и того же пациента коррелируют между собой (р=0,02037). Как показано в первой части наших исследований, толщина висцеральной плевры и патологически измененной легочной паренхимы более 1,83±0,87 мм свидетельствует о третьей стадии эмпиемы плевры. Учитывая наличие корреляции между толщиной фиброзных изменений в париетальной плевре и висцеральной плевре и легком, можно сделать вывод, что толщина париетальной плевры более 1,83±0,87 мм так же свидетельствует о третьей стадии эмпиемы плевры. Биопсия париетальной плевры абсолютно безопасна для пациента, что дает возможность диагностировать III стадию эмпиемы плевры при выявлении в биоптате париетальной плевры фиброза толщиной более 1,83±0,87 мм.
В период с 2008 по 2013 г. в отделении торакальной хирургии МУЗ Городская клиническая больница №4 г. Перми 247 (100%) с острыми ГП при поступлении была выполнена торакоскопия. У 52 (21,05%) пациентов при первичном торакоскопическом осмотре плевральной полости нельзя было исключить третью стадию ГП. 33 (13,36%) больным была выполнена биопсия легкого, а 19 (7,69%) пациентам - биопсия париетальной плевры.
Из 33 (13,36%) больных, которым была выполнена биопсия легкого, первую стадию не выявили ни у одного больного. Вторую стадию диагностировали у 15 (6,07%) пациентов. Этим больным после выполнения торакоскопии продолжено лечение миниинвазивными методами. 1 (0,41%) больной умер. У 1 (0,41%) больного на фоне массивных бронхиальных свищей легкое расправить не удалось, сформировалась хроническая эмпиема плевры, была выполнена плевролобэктомия, после чего достигнуто выздоровление. У остальных 14 (5,67%) пациентов удалось расправить легкое и достигнуть выздоровления. Третья стадия ГП была определена у 18 (7,29%) пациентов. 2 (0,81%) пациента умерли. У 3 (1,21%) человек за время, необходимое для получения результатов биопсии с помощью торакоскопических технологий, удалось добиться формирования небольшой остаточной полости, которая в дальнейшем облитерировалась. У 13 (5,26%) из этих пациентов тенденции к расправлению легкого не было, после стабилизации общего состояния им были выполнены различные открытые операции, направленные на закрытие эмпиемной полости.
В лечении 19 (7,69%) пациентов мы использовали новый способ диагностики стадии эмпиемы плевры. Им мы выполнили биопсию париетальной плевры. У 9 (3,63%) больных зоны фиброза плевра была менее 1,83±0,87 мм. Этим больным после выполнения торакоскопии продолжено лечение миниинвазивными методами. У 8 (3,24%) пациентов удалось расправить легкое и достигнуть выздоровления. У 1 (0,41%) больного легкое расправить не удалось, потребовалось выполнение торакопластики. Третья стадия ЭП была определена у 10 (4,05%) пациентов. 2 (0,81%) пациента умерли. У 8 (3,24%) человек зоны фиброза плевры была более 1,83±0,87 мм. Им диагностирована III стадия эмпиемы плевры. У этих пациентов тенденции к расправлению легкого не было, им потребовалось выполнение открытых операций.
Заключение. Несмотря на относительно небольшое количество наблюдений, полученные результаты позволяют сделать вывод об эффективности использования разработанных методик биопсии и исследования биоптата для эффективного определения стадии эмпиемы плевры и для выбора правильной программы хирургического лечения.
