Под понятием опухоль опорно-двигательной системы, подразумевают, большую группу опухолеподобных заболеваний, злокачественных и доброкачественных опухолей скелета [4].
Стоит отметить, что нередки случаи встречаемости, как доброкачественных так и злокачественных форм новообразований среди одной нозологической группы. Наряду с этим доброкачественная природа некоторых опухолей может сопровождаться агрессивным течением, интенсивным ростом, выраженным деструктивным процессом в костной ткани, вплоть до разрушения кортикального слоя кости, появлением и даже выходом мягкотканого компонента опухоли [1].
Остеобластокластома (гигантоклеточная опухоль) — является одной из наиболее часто встречающихся опухолей скелета. Она составляет от 15 до 20% доброкачественных и 4-5% всех опухолей костей [4].
Преимущественная локализация опухоли — эпиметафизы длинных трубчатых костей, реже поражаются лопатка, кости таза, позвоночника, ребер. Остеобластокластома (ОБК) развивается в местах, богатых миелоидным костным мозгом [2]. Нередко приводит к большим деформациям и укорочению конечности при несвоевременной диагностике и поздно начатом лечении. При рентгенологическом обнаружении ОБК суставного конца кости, она всегда, хотя бы на небольшом участке, доходит до субхондрального слоя. Нередко (около 40%) опухоль поражает весь суставной конец кости, вздувает его, разрушает кортикальный слой и выходит за пределы кости. Благодаря исследованиям последних лет, взгляд на ОБК как на доброкачественную опухоль пересмотрен, она отнесена в разряд агрессивных новообразований [6]. Эта весьма непредсказуемая в своем клиническом течении и многоликая опухоль может быть доброкачественной, первично-злокачественной и подвергаться озлокачествлению. Такое разнообразие форм ОБК создает большие трудности как клиницисту, рентгенологу, так и морфологу в решении вопроса, к какой форме отнести опухоль и какой метод лечения избрать. Вторично-озлокачествленная ОБК, наблюдается как после нерадикально проведенных оперативных вмешательств, так и после нерационального лучевого лечения [5].
При лечении ОБК основным методом является оперативный: резекция пораженного участка кости в пределах здоровых тканей. Подавляющее большинство авторов придерживаются мнения, что экскохлеация патологического очага не должна применяться как самостоятельный этап в лечении, так как эта операция нерадикальна, дает большой процент рецидивов, способствует малигнизации новообразования. В отдельных случаях при обширных дефектах суставных концов показано эндопротезирование. При злокачественных ОБК этапность в лечении должна согласовываться с онкологами и лечение должно быть комбинированным [2].
ОБК дистального отдела лучевой кости - сложный хирургический вызов. При небольших по размеру внутрикостных опухолях, хирургическое лечение может включать костную пересадку и кюретаж. Сохранение хряща суставной поверхности дистального отдела лучевой кости позволяет достичь хороших функциональных результатов и снизить число рецидивов. Однако при протяженных опухолях, распространяющиеся на суставную поверхность и дистальнее, попытка сохранить лучезапястную артикуляцию и дистальный луче-локтевой сустав связана с высоким риском местных рецидивов. Отдаленные результаты показали, что агрессивный кюретаж с дополнительными широким разрезами снижают риск рецидивов [3]. Маленький размер и анатомическая сложность кистевого сустава совместно создают очень сложные условия для удаления опухоли. Эти технические трудности совместно с высоким риском рецидива ОБК в дистальном радиусе несравнимы ни с одной из частей скелета человека, которая поражена опухолью. Более того, в результате удаления агрессивной опухоли часто остаются частицы структуральной костной ткани, что, в свою очередь, нарушают функцию лучезапястного и дистального лучелоктевого суставов.
Существуют различные варианты реконструктивных операций после дистальной резекции луча. Процедуры, сохраняющие движение кистей, включают в себя: эндопротезирование; костно-суставной малоберцовый трансфер; костно-суставной аллотрансплантат; луче-локте-запястный артродез.
Молодой возраст пациентов, непредсказуемость и агрессивность течения гигантоклеточного опухолевого процесса, высокие риски местного рецидивирования и крайне высокие функциональные требования, как в повседневной, так и в трудовой деятельности, предъявляемые к верхней конечности а, именно, к кисти и лучезапястному суставу побуждают исследователей к поиску новых сочетаний радикально выполненного удаления опухоли и пострезекционного реконструктивно-пластического этапа.
Цель работы - улучшить функциональные результаты хирургического лечения больных с ОБК, путем применения и внедрения в широкую практику нового способа пластики пострезекционного дефекта дистального отдела лучевой кости.
Материалы и методы. Клиника травматологии, ортопедии и экстремальной хирургии им. академика РАН А.Ф. Краснова ГБОУ ВПО Самарского государственного медицинского университета под руководством академика РАН Г.П. Котельникова, располагает значительным опытом лечения больных с поражением дистального отдела лучевой кости, в том числе и опухолевой природы. При хирургическом лечении большой группы этих пациентов, пластика дефектов выполнялась общеизвестными методами. Основываясь на многолетнем опыте применения традиционных способов костной реконструкции, учитывая определенные недостатки и современные требования, нами впервые был разработан новый способ пластики дистального отдела лучевой кости (приоритетное право на патент от 28.01.2016 г. Рег. № 2016102518).
Клинический пример. Пациентка К. 37 лет, обратилась за помощью в ГБУЗ «Самарский областной клинический онкологический диспансер», в марте 2015г., с диагнозом: «остеобластокластома дистального отдела левой лучевой кости», с жалобами на опухолевидное образование в области нижней трети левого предплечья. При поступлении кожные покровы предплечья чистые, без признаков воспаления, границы области деформированы, область лучезапястного сустава отечна. Отмечается наличие опухолевидного образования в нижней трети левого предплечья размером около 6 х 7 см, при пальпации образование плотной консистенции, не смещаемо, резко болезненно. Движения в левом лучезапястном суставе грубо нарушены в связи с выраженным болевым синдромом. На рис. 1 представлен общий вид конечности при поступлении. Пациентке была выполнена операция по разработанному нами способу.
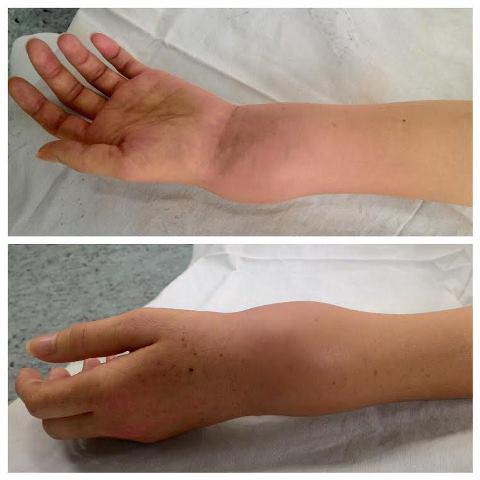
Рис. 1. Общий вид конечности до операции.
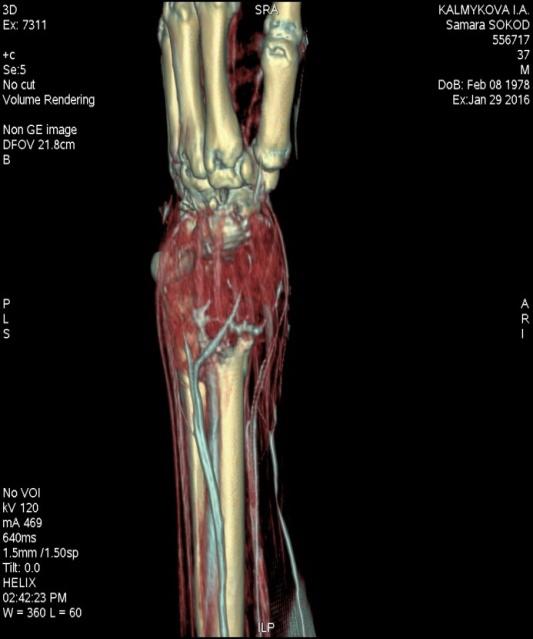
Рис. 2. Компьютерная томограмма до операции (3D модель).
Ладонным доступом путем S-образного рассечения кожи, подкожно-жировой клетчатки и собственной фасции предплечья осуществляли доступ к дистальному отделу лучевой кости с опухолью (рис. 3).
Затем выделяли срединный нерв и лучевую артерию, отдвигали при помощи «турникетов». Мобилизовали и отодвигали в лучевую сторону длинную ладонную мышцу и лучевой сгибатель запястья. Тупо и остро обнажали дистальной отдел лучевой кости. При помощи пилы выполняли остеотомию лучевой кости, отступя 3 см от мягкотканого компонента опухоли. Дистальный сектор длиной около 8 см удаляли и отправляли на гистологическое исследование. Границы резекции обрабатывали с помощью аргонно-плазменной установки в режиме коагуляции мощностью 80 Вт (рис. 3).
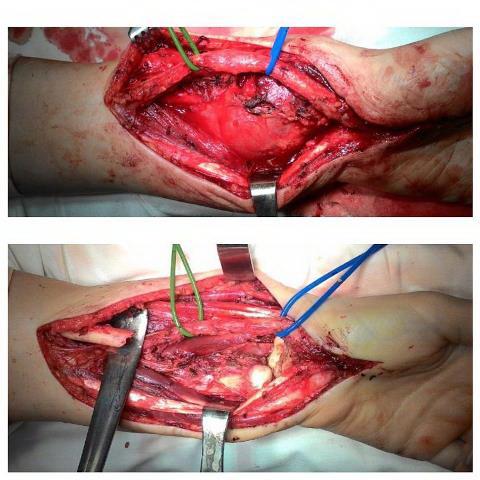
Рис. 3. Этапы операции. Мобилизация лучевой артерии, срединного нерва; удаление опухоли (дистальный метаэпифиз левой лучевой кости).
Далее линейным разрезом длиной до 7 см в проекции диафиза малоберцовой кости левой голени, рассекали кожу и подкожную клетчатку. Тупо и остро выделяли малоберцовую кость на протяжении 10 см. Мобилизованы сосуды: малоберцовая артерия и вена, питающие выделенный сегмент. При помощи пилы выполняли резекцию фрагмента кости размером 8 см, вместе с участком малоберцовой артерии и вены около 3 см и участком мышцы сгибателя большого пальца стопы (рис. 4).
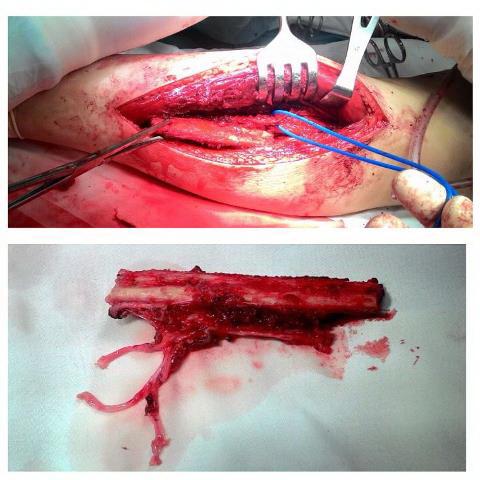
Рис. 4. а) забор свободного аутотрансплантата малоберцовой кости с малоберцовыми сосудами; б) общий вид аутотрансплантата.
На уровне рассеченной поперечной связки запястья выполняли пластику аутотрансплантата и локтевой кости, охватывая по типу хомута и фиксируя лавсановой лентой. Полулунную кость и дистальный конец аутотрансплантата фиксировали трансоссальным швом (рис. 5).
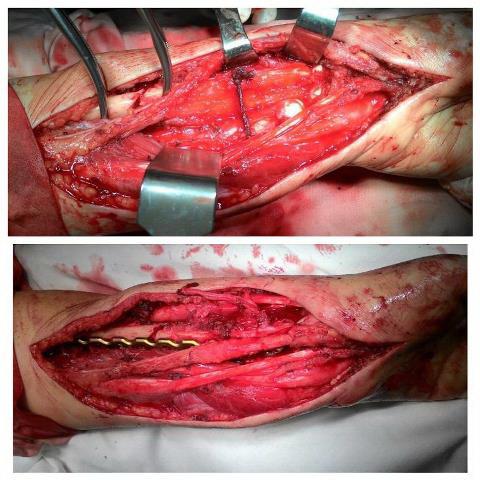
Рис. 5. а) замещение пострезекционного дефекта и пластика стяжкой локтевой и лучевой костей, трансоссальная стяжка полулунной кости и трансплантата; б) остеосинтез пластиной с угловой стабильностью.
Производили замер пластины, последняя приложена и отмоделирована по кости. Выполняли остеосинтез титановой пластиной с угловой стабильностью и винтами. Проверка на стабильность: патологической подвижности, крепитации костных отломков не выявлено, остеосинтез стабилен.
Накладывали сосудистый анастомоз, подшивая участок малоберцовой артерии аутотрансплантата к лучевой артерии, а малоберцовую вену к подкожной вене предплечья, так же участок мышцы сгибателя большого пальца подшивали к мышцам предплечья. Анастомоз стабилен, функционирует (рис. 6).
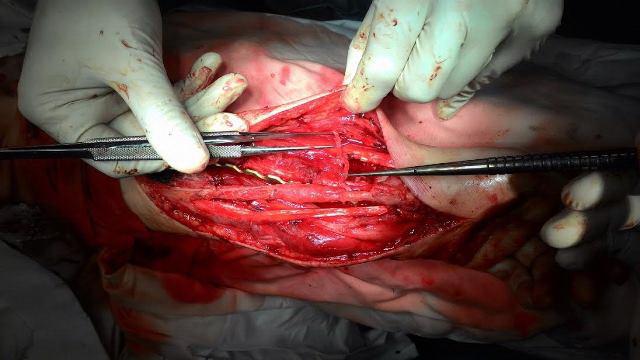
Рис. 6. Наложение сосудистого анастомоза «конец-в-бок» (участок малоберцовой артерии трансплантата к лучевой артерии).
На первые сутки отмечали умеренный отек в послеоперационной области. По дренажу около 30 мл геморрагического отделяемого. Швы состоятельны.
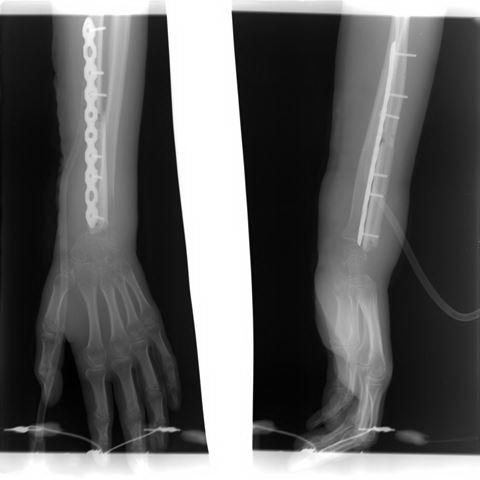
Рис. 7. Контрольная рентгенограмма (первые сутки, стрелкой указана зона оперативного вмешательства).
На контрольной рентгенографии данных за миграцию аутотрансплантата нет. Стояние отломков удовлетворительное. Остеосинтез стабилен.
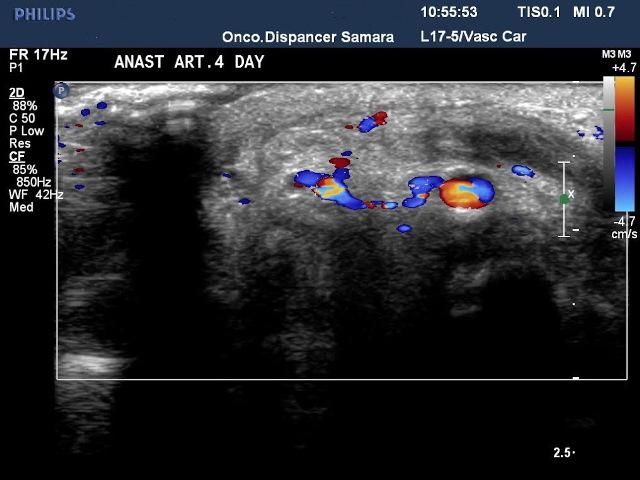
Рис. 8. Цветное допплеровское картирование (ЦДК) сосудов левой верхней конечности.
По данным ЦДК сосудов верхней конечности: анастомозы проходимы и состоятельны, просвет артерий и вен сохранен. Кровоток удовлетворительных качеств.
Результаты и обсуждение. Общее время операции составило 4 часа 20 минут, объём кровопотери 200 мл.
В послеоперационном периоде проводили иммобилизация циркулярной повязкой из полиуретановых бинтов сроком на 8 недель, антибактериальную и антикоагуляционную терапию. Болевой синдром составил 4 балла (по шкале Visual Analogue Scale (VAS)).
При контрольном осмотре через 8 недель после снятия полиуретановой повязки: сила мышц предплечья и кисти прооперированной конечности составила 3 балла (по шкале Harrison), объём движений в лучезапястном суставе составил: тыльное сгибание 30°, 20°- ладонное сгибание, радиальное отведение 5°, ульнарное отведение 10°. Оценка болевого синдрома 2 балла (по шкале VAS). Онкологический критерий в виде рецидива - не выявлен.
На контрольном осмотре через 10 недель после проведения восстановительно-реабилитационных мероприятий объём движений в лучезапястном суставе составил: тыльное сгибание 50°, 45°- ладонное сгибание, радиальное отведение 10°, ульнарное отведение 15°. Болевой синдром не беспокоил. Онкологический критерий в виде рецидива - не выявлен.
Таким образом, несмотря на достаточно высокую травматичность предложенного способа пластики, немалую продолжительность, большую трудоемкость и энергозатратность операции, хороший функциональный результат наряду с достаточной радикальностью оправдывает применение предложенного способа.
Вывод. Новый способ пластики пострезекционного дефекта дистального отдела лучевой кости позволяет улучшить результаты хирургического лечения больных с остеобластокластомами и может быть внедрен в широкую практику.
