Лечение послеоперационной боли относится к числу наиболее важных проблем хирургии. Эта проблема не теряет своей актуальности, несмотря на значительный прогресс в создании новых анальгетиков и схем обезболивания [5-7]. По данным IV конгресса европейских ассоциаций по изучению боли около 35% пациентов после хирургических операций страдают от послеоперационной боли, причем ее интенсивность в 50% случаев характеризуется как средняя или высокая [3]. Новые знания о патофизиологии болевого синдрома привели к осознанию важности адекватного послеоперационного обезболивания. В мультимодальных схемах применяются различные ненаркотические анальгетики (парацетамол, нестероидные противовоспалительные препараты) [8]. Чаще всего в этих целях используют нестероидные противовоспалительные препараты (НПВП) [2]. Эффективность НПВП (нестероидные противовоспалительные препараты) кетопрофена в послеоперационном обезболивании показана в ортопедии, в гинекологии, в абдоминальной хирургии [14,15,17]. Опасность таких побочных эффектов, как увеличение послеоперационного кровотечения и угнетение функции почек являются причиной того, что НПВП не находят широкого применения в терапии боли у пациентов, особенно после искусственного кровообращения [9]. Среди аналгетиков особое место занимает препарат нефопам, появившийся в 1970-х годах во Франции, представляющий собой рацемическую смесь двух энантиомеров и относящийся к ненаркотическим аналгетикам центрального действия [11]. Существуют многочисленные исследования по применению нефопама в абдоминальной хирургии, ортопедии и травматологии [12,16]. В то же время его эффективность для послеоперационного обезболивания у хирургических больных альтернативных методик, в частности метода электроанальгезии не изучена.
Цель исследования. Оценить показатели болевого синдрома и маркеров стресс-ответа в послеоперационном периоде у больных в различных группах послеоперационной анальгезии, перенесших операции высокой травматичности на органах брюшной полости.
Нами у 79 пациентов были изучены результаты различных вариантов послеоперационной анальгезии у хирургических пациентов, оперированных на органах брюшной полости в условиях комбинированной общей анестезии (КОА) и сочетанной анестезии (СА) в хирургических отделениях ГБУЗ ОКБ Тверской области. Произведена оценка методик послеоперационного обезболивания и нежелательных побочных явлений в трех группах сравнения. Все пациенты были оперированы на органах брюшной полости и забрюшинного пространства: субтотальная резекция желудка по поводу стеноза выходного отдела желудка (язвенная болезнь) - 15 пациентов (18,9%) , гастрэктомия в объеме D3 по поводу аденокарциномы желудка у 8 пациентов (10,1%). Панкретатодуоденальная резекция по поводу хронического индуративного панкреатита 7 пациентов (8,8%), панкреатодуоденальная резекция по поводу кисты поджелудочной железы 5 пациентов (6,3%). Тотальная гистерэктомия по поводу миомы матки 24 пациента (30,3%). Радикальная простатэктомия по поводу рака предстательной железы 10 пациентов (12%). Бифуркационное аортобедренное протезирование 10 пациентов (12%)
Согласно современным представлениям данные оперативные вмешательства относятся к категории высокой травматичности и требуют комплексного подхода к проведению анестезии. Наилучшей тактикой с точки зрения антистрессовой защиты обширных абдоминальных операций на сегодняшний день признана концепция сочетанной анестезии (ОА+ЭА) (общая анальгезия + эпидуральная анальгезия) с последующей мультимодальной послеоперационной анальгезией [1,13], что обеспечивает не только преемственность интра- и послеоперационного обезболивания, но и определяет темп послеоперационной реабилитации хирургических больных, снижает частоту сердечно-сосудистых, легочных инфекционных осложнений. Именно концепция позволяет не прерывать обезболивание у хирургических больных на момент окончания операции, и сохранять надежную антистрессовую защиту в ближайшем послеоперационном периоде. Нейроаксиальная аналгезия с помощью местных анестетиков или опиоидов сама по себе или в комбинации с нестероидными противовоспалительными препаратами, представляются наиболее эффективными мерами. Преимущества нейроаксиальных методов обезболивания должны всегда оцениваться вместе с потенциальными их недостатками; это особенно важно при рассмотрении возможности нейроаксиальной блокады у пациентов, длительно получающих антитромбоцитарную терапию, в связи с повышенным риском развития геморрагических осложнений [4,10]. Поэтому, когда возникла необходимость доказать целесообразность использования альтернативных методов послеоперационной анальгезии, мы обратились к нашему опыту и проанализировали динамику и темпы восстановления функциональной активности при операциях на органах брюшной полости под общей и сочетанной анестезией.
Материал и методы. В основу работы положены результаты рандомизированного, проспективного, клинического исследования, выполненного у 79 хирургических больных, оперированных в плановом порядке в ГБУЗ «Областная клиническая больница Тверской области» за период 2013-2016 гг. Всем пациентам периоперационно выполнен единый комплекс клинико-биохимических и инструментальных методов исследования, включая инвазивную оценку параметров ЦГД (центральной гемодинамики). Указанные методы обследования оценивались регулярно у пациентов в послеоперационном периоде согласно протоколу исследования до операции, через 2 часа после окончания оперативного вмешательства и через 24 часа после операции.
Для выявления статистически значимых отличий применялись критерии Манна-Уитни, Вилкоксона, ANOVA по Краскелу-Уоллису.
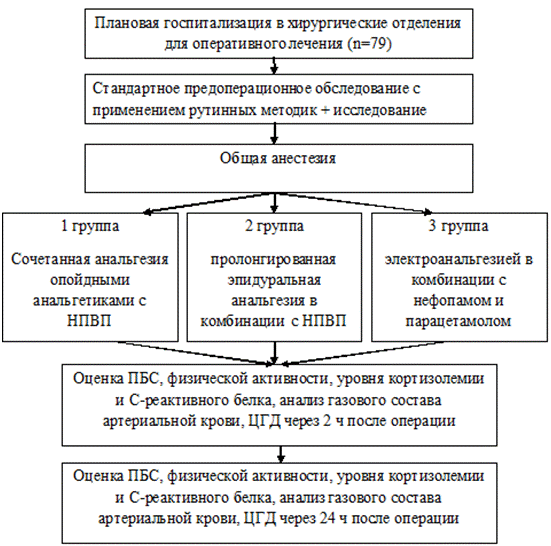
Рис. 1. Общая схема исследования. ПБС - послеоперационный болевой синдром: НПВП - нестероидные противовоспалительные препараты. ЦГД - центральная гемодинамика.
Критерии включения пациентов в исследование:
- выполнение плановых операций большого объема и высокой травматичности на органах брюшной полости требующие лапаротомии,
- согласие пациента на участие в исследовании,
- ранний послеоперационный период - первые 2 суток после операции и 24 часа после экстубации трахеи,
- уровень сознания - ясное сознание или легкое оглушение, 14-15 баллов.
Критерии исключения пациентов из исследования:
- наличие в анамнезе психических заболеваний,
- наличие в анамнезе противопоказаний к назначению НПВП, нефопама и индивидуальная непереносимость препаратов этих групп,
- бронхиальная астма, нарушение функции почек (креатинин 2 мг%, олигурия),
- эрозивно-язвенные поражения желудочно-кишечного тракта,
- пациенты, идущие на экстренное хирургическое вмешательство,
- отказ пациента от участия в исследовании на любом этапе.
Согласно критериям включения/исключения на различных этапах из исследования было выбрано 79 пациентов.
Распределение пациентов по полу и возрасту. В структуре хирургических больных превалировали женщины - 56,9% (45 пациентки), мужчин - 43,1% (34 пациентов). Средний возраст больных составил 66±13 лет, где 5 человек (6,3%) относились к лицам пожилого и старческого возраста (рис. 2), что предопределило общий спектр сопутствующих заболеваний в группах исследования в целом (рис. 3).
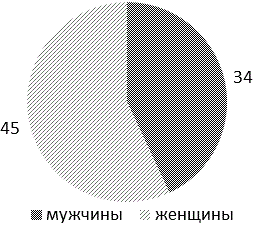
Рис. 2. Распределение больных по полу.
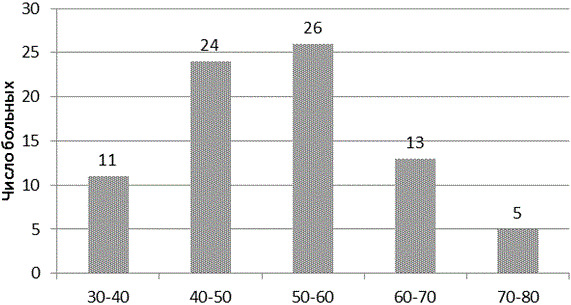
Рис. 3. Распределение больных по возрасту.
У всех пациентов имела место ишемическая болезнь сердца II-III ФК. 79 человек (100 %). При этом отмечалась артериальная гипертония - у 72 человек (91,1%), 5 пациентов (6,3%) страдали сахарным диабетом 2 типа, у 8 больных (10,1%) было выявлено ожирение 1-2 типа. Мерцательная аритмия 12 больных (15,2%).
Характеристика вида и объема оперативных вмешательств. Структура хирургической патологии у больных представлена в рисунке 4; из которой следует, все пациенты были оперированы на органах брюшной полости и забрюшинного пространства: субтотальная резекция желудка по поводу стеноза выходного отдела желудка (язвенная болезнь) - 15 пациентов (18,9%), гастрэктомия в объеме D3 по поводу аденокарциномы желудка у 8 пациентов (10,1%). Панкретатодуоденальная резекция по поводу хронического индуративного панкреатита у 7 пациентов (8,8%), панкреатодуоденальная резекция по поводу кисты поджелудочной железы у 5 пациентов (6,3%). Тотальная гистерэктомия по поводу миомы матки у 24 пациентов (30,3%). Радикальная простатэктомия по поводу рака предстательной железы у 10 пациентов (12%). Бифуркационное аортобедренное протезирование у 10 пациентов (12%).
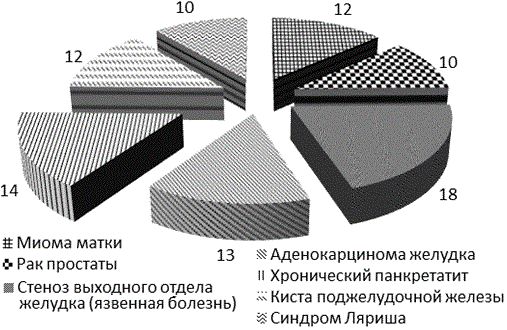
Рис. 4. Нозологическая структура оперированных больных.
Всех больные в зависимости от вида послеоперационного обезболивания были разделены на 3 группы:
Группа 1 - 26 пациентов (15 женщин и 11 мужчин), которым в послеоперационном периоде выполнялась анальгезия с применением опиоидных анальгетиков и НПВП.
Группа 2 - 24 пациент (13 женщин и 11 мужчин), которым в послеоперационном периоде выполнялась продленная эпидуральная анальгезия с использованием НПВП и парацетамола.
Группа 3 - 29 пациента (17 женщин и 12 мужчин), которым в послеоперационном периоде выполнялась электроанальгезия с применением центрального ненаркотического анальгетика нефопама и парацетамола.
Методики послеоперационной аналгезии в группах. В первой группе исследования проводилось обезболивание в послеоперационном периоде по следующей схеме: внутримышечное введение опойдного анальгетика. Тримеперидина по 20 мг внутримышечно каждые 6 часов или по требованию в суточной дозировке до 100 мг. НПВП - кеторолака трометамина в дозе 30 мг каждые 12 ч. Пациентам второй группы в ближайшем послеоперационном периоде проводилась следующая схема: парацетомол внутривенно 1000 мг каждые 8 ч. В эпидуральное пространство при помощи шприцевого насоса осуществлялась продленная инфузия местного анестетика ропивакаина гидрохлорида 0,2% со скоростью 6-10 мл/час. Если выраженность ПБС по визуальной аналоговой шкале (ВАШ) составляла 5 баллов и выше, то дополнительно эпидурально назначался фентанил в дозе 50 мкг однократно, суммарная суточная доза которого не превышала 100 мкг. Пациентам 3 группы в послеоперационном периоде выполнялась следующая методика обезболивания: Для обеспечения электроанальгезии применялся аппарат «ТРАНСАИР-05», г. Санкт-Петербург, Россия (соответствие ТУ-9444-005-44333151-2005) по следующей методике: закреплялись электроды на голове пациента на сосцевидные отростки; накладывалось оголовье с затылочными электродами поверх прокладок и закреплялось с помощью текстильной застежки; смачивалась лобная прокладка и накладывалась на лоб пациента, расположив ее нижний край на уровне бровей; оголовье с лобными электродами поверх лобной прокладки и закреплялось с помощью текстильной застежки. Проводился курс 5-7 сеансов 3-4 раза в день, по 30-40 мин, монополярным током 1,0-3,0 мА.
Медикаментозная анальгезия осуществлялась при помощи Нефопама в дозе 30 мг внутримышечно 3 раза в день в суточной дозировке до 90 мг, и анальгетика (парацетамол) внутривенно 1000 мг также каждые 8 ч.
Особенностью электрического воздействия, проводимого с помощью аппарата «ТРАНСАИР-05», является стимуляция специальными электрическими прямоугольными импульсами тока фиксированной частоты и длительности. Строго фиксировано также положение электродов на голове - отрицательный электрод располагается всегда в области лба, положительный - на коже за ушами. Таким образом, от пациента не требуется подбора параметров воздействия (кроме величины лечебного тока) и положения электродов, что значительно упрощает процесс лечения и делает его безопасным. Ток от аппарата проникает через кожу и мягкие ткани головы, череп и действует в конечном итоге на антиноцицептивные структуры головного мозга. Тем самым обеспечивается активация защитных механизмов мозга. Показано, что уже через 10-15 минут после начала стимуляции происходит усиление выделения опиоидных пептидов (бета-эндорфина) и повышение их концентрации в мозге, спинномозговой жидкости и крови в несколько раз. Также установлено, что в развитии эффектов ТЭС-терапии (транскраниальная электростимуляция), помимо опиатергического, участвуют также серотонинергический и холинергический нейротрансмиттерные механизмы. Анальгезия обусловлена активацией опиоидных механизмов антиноцицептивной системы. Поток восходящих болевых импульсов частично или полностью блокируется на разных уровнях проведения. Анальгетический эффект не зависит от локализации болевого очага и более выражен при интенсивной постоянной боли. Анальгезия устраняется блокатором опиоидных рецепторов - налоксоном, не возникает при толерантности к морфину и другим опиатам. Несмотря на то, что механизм обезболивания при ТЭС-терапии опиоидный, явлений привыкания и пристрастия к процедурам не возникает. Наоборот, по мере лечения длительность противоболевого последействия увеличивается.
Результаты. В группе пациентов №1 в послеоперационном периоде через два часа отмечается достоверно значимое усиление болевого синдрома. Так показатель ВАШ вырос на 77% (р<0,001), а значения 5 БВШ (пятибалльная визуальная шкала боли) увеличились на 84% (р<0,001). Данная динамика прослеживается и через 24 часа с момента окончания оперативного вмешательства. Значения ВАШ были на 73% (р<0,001)выше исходных значений (непосредственно после операции), а показатель 5 БВШ на 77% (р<0,001) больше исходных значений (табл. 1, рис. 5).
Таблица 1. Группа 1 - анальгезия с применением опиоидных анальгетиков и НПВП (N=26)
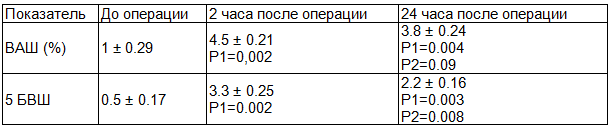
Примечания: здесь и далее P1 - достоверность показателей между показателями до операции и через 2 часа после операции, P2 - достоверность показателей между показателями до операции и через и 24 часа после операции.
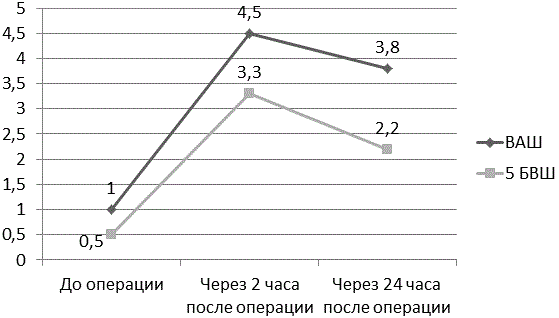
Рис. 5. Динамика показателей ВАШ и 5 БВШ в 1 группе больных.
Результаты оценки физической активности у пациентов 1-й группы представлены в табл. 2, из которой следует, что физическая активность на 1-м этапе исследования была самая низкая, на 2-м и 3-м этапе исследования физическая активность увеличилась.
Таблица 2. Физическая активность пациентов группы 1 (N=26); Mo (Xmin; Xmax)

Однако, несмотря на хороший и адекватный уровень ПО (послеоперационного обезболивания), восстановление функциональной активности пациентов в ПП (послеоперационном периоде) имело поступательный характер. Так в раннем послеоперационном периоде через 2 часа после операции она составляла только 1,2±0,3 балла (табл. 2). Чем выше оценка в баллах по 5-ти бальной шкале, тем выше функциональная активность хирургического больного в ПП. Наличие дренажей в брюшной полости, назогастрального (или назоеюнального зонда) и др. также ограничивало двигательную активность больных. К 3-му этапу исследования (через 24 часа ПП) физическая активность подавляющего числа пациентов была восстановлена на 86%, но при этом наблюдались и малоактивные больные, у которых физическая активность сохранялась минимальной и оценивалась в 2 балла при отсутствии ПБС (табл. 2).
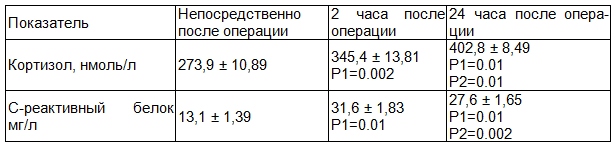
При изучении показателей стресс-ответа в группе 1, было выявлено следующее, что через 2 часа после операции показатель кортизола составил 345,3± 13,81 нмоль/л, что на 22% (р<0,001) выше исходных значений. Через 24 часа показатель кортизола был выше уже на 32% (р<0,001) исходных показателей. Уровень С-реактивного белка после операции был выше на 58,5% (р<0,001) через два часа от исходных значений и на 52% (р<0,001) через 24 часа соответственно (табл. 3).
Таблица 3. Группа 1 - анальгезия с применением опиоидных анальгетиков и НПВП (N=26)
В группе пациентов 2 для послеоперационной анальгезии у которых применялась продленная эпидуральная блокада в сочетании с блокатарами ЦОГ 1 и ЦОГ 3 было выявлено: через 2 часа значения ВАШ составили 2,1± 1,22, что на 61% (р<0,001) выше значений полученных непосредственно после операции. Через 24 часа показатель ВАШ был на 60% (р<0,001) выше показателей непосредственно после операции (табл. 4). При следовании показателей вербальной шкалы болевого синдрома отмечено нарастание болевого синдрома через 2 часа после операции на 66% (р<0,001), а через 24 часа на 57% (р<0,001) от исходных значений (табл. 5).
Таблица 4. Группа 2 - продленная эпидуральная анальгезия с использованием НПВП и парацетамола (N=24)
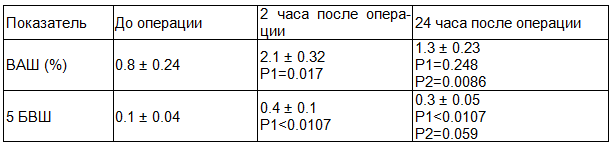
Таблица 5. Физическая активность пациентов группы 2 (N=24); Mo (Xmin; Xmax)

Результаты оценки физической активности у пациентов 2-й группы представлены в табл. 5, из которой следует, что физическая активность на 1-м этапе исследования была самая низкая, на 2-м и 3-м этапе исследования физическая активность увеличилась.
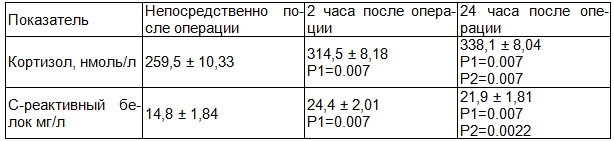
В отношении показателей стресс-ответа в группе пациентов №2 было отмечено достоверно значимый прирост показателей кортизола через 2 часа после операции на 17% (р<0,001), а С-реактивного белка на 39% (р<0,001). Через сутки с момента оперативного вмешательства данные показатели составили 338,1±8,04 ннмоль/л, и 21,9±1,81 мг/мл, что на 23% (р<0,001) и 32% (р<0,001) выше показателей до операции по кортизолу и с-реактивному белку соответственно (табл. 6).
Таблица 6. Группа 2 - продленная эпидуральная анальгезия с использованием НПВП и парацетамола (N=24)
У больных группы 3 также отмечено нарастание послеоперационного болевого синдрома уже через 2 часа после операции по шкалам ВАШ и 5 БВШ на 29% (р<0,001) и 50% (р<0,001) соответственно. Через 24 часа прослеживается данная динамика, однако прирост показателей оказался меньше чем через 2 часа после операции, и составил по шкале ВАШ 15% (р<0,001), а по шкале 5 БВШ 22% (р<0,001) (табл. 7).
Таблица 7. Группа 3 - электроанальгезия с применением парацетамола и центрального ненаркотического анальгетика нефопама (N=29)

Таблица 8. Физическая активность пациентов группы 3 (N=29); Mo (Xmin; Xmax)

Результаты оценки физической активности у пациентов 3-й группы представлены в табл. 8, из которой следует, что физическая активность на 1-м этапе исследования также была самой низкой.
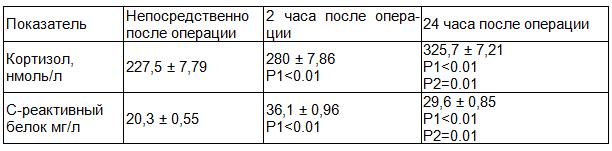
При исследовании значений стресс-ответа в группе 3 нами отмечено достоверно значимый прирост кортизола через 2 часа после операции на 18% (р<0,001), а С-реактивного белка на 43% (р<0,001). Через 24 с момента окончания операции данные показатели составили 325,7±7,21 ннмоль/л, и 29,6±0,85 мг/л, что на 30% (р<0,001) и 31% (р<0,001) выше исходных значений (табл. 9).
Таблица 9. Группа 3 - электроанальгезия с применением парацетамола и центрального ненаркотического анальгетика нефопама (N=29)
Заключение. Таким образом, наиболее адекватной анальгезией в послеоперационном периоде следует считать группы пациентов 2 и 3, при этом динамика послеоперационного болевого синдрома, а так же динамика маркеров стресс ответа и физической активности говорит о благоприятном воздействии выбранных методов послеоперационной анальгезии. При этом, учитывая тот факт, что в ряде случаев имели место противопоказания для выполнения нейроаксилярных методов анальгезии, с нашей точки зрения целесообразным является применение метода электроанальгезии в комплексной схеме послеоперационного обезболивания у пациентов, перенесших высокотравматичные операции на органах брюшной полости.
