Введение. В настоящее время пластика пахового канала по методу Лихтенштейна, не смотря на активное внедрение эндоскопических методик лечения, остается наиболее распространенным видом хирургического лечения больных с паховыми грыжами [1, 2, 5].
При выполнении пластики по Лихтенштейну применяются различные по пространственной структуре, составу и характеру плетения нити синтетические импланты [4, 6, 7], физико-химические параметры которых зачастую определяют особенности течения раневого процесса и течение клинической картины раннего послеоперационного периода [3, 8].
Цель исследования: изучение особенностей течения раневого процесса у больных с паховыми грыжами после выполнения пластики пахового канала по Лихтенштейну с применением наиболее распространенных видов синтетических имплантов.
Материал и методы. Все больные, включенные в данное исследование (64 пациента), были разделены на четыре группы в зависимости от типа импланта, использованного при проведении оперативного вмешательства. Критерием включения больных являлось отсутствие клинических проявлений раневых осложнений в раннем послеоперационном периоде, основным признаком исключения - оперативные вмешательства при рецидиве грыжевого образования.
В первую группу включен 21 больной, пластика пахового канала которым проводилась с применением монофиламентных полипропиленовых имплантов (PMS, PMN; Ethicon). Во вторую группу исследования вошло 13 больных. У этой группы пациентов во время оперативного вмешательства были использованы легкие макропористые композиционные полипропиленовые сетки (Ultrapro; Ethicon). Третью группу больных (16 пациентов) составили клинические случаи пластики самофиксирующимся композиционным полипропиленовым имплантом (Parietene ProGrip; Covidien). Четвертая группа больных была представлена пациентами (14 больных), герниопластика которым проводилось макропористыми мультифиламентными полиэстеровыми эндопротезами, имеющими объемную структуру (TET; Parietex, Covidien).
Пластику пахового канала больным выполняли по методике Лихтенштейна. Для фиксации импланта у пациентов первых трех групп исследования использовали аналогичный по химическому составу вид шовного материала.
Всем включенным в исследование больным для объективизации раневого процесса проводилось ультразвуковое сканирование «зоны оперативного вмешательства» на 2-5 сутки послеоперационного периода. Под «зоной оперативного вмешательства» понимали область пластики пахового канала. В отдаленном послеоперационном периоде (в сроки от 1,5 до 7 месяцев) ультразвуковое исследование выполнялось только при обращении пациентов (12 больных) с жалобами на наличие дискомфорта и боли в области выполненной операции.
Ультразвуковые исследования выполнялись в B-режиме сканирования и при необходимости дополнялись применением режимов ультразвукового ангиосканирования. Во время исследований особое внимание уделяли особенностям эхоструктуры и форме использованного импланта, наличию ограниченных скоплений жидкости в области его расположения и состоянию подкожной жировой клетчатки.
Полученная при проведении ультразвукового сканирования информация верифицировалась данными клинического осмотра и лабораторного обследования больных.
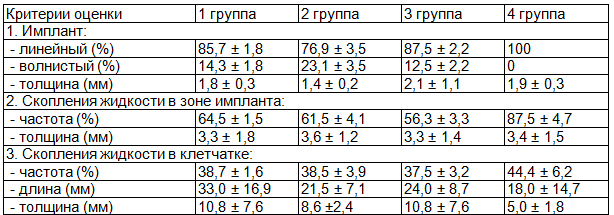
Результаты исследования и их обсуждение. Полученные результаты оценки раневого процесса у пациентов с паховыми грыжами после выполнения пластики пахового канала по Лихтенштейну представлены в табл. 1.
Таблица 1. Ультразвуковые критерии оценки раневого процесса больных после выполнения пластики по Лихтенштейну
Ультразвуковые исследования «зоны оперативного вмешательства» позволили выявить, что отчетливая визуализация всех типов изучаемых синтетических имплантов отмечалась вне зависимости от сроков выполнения оперативного вмешательства, позволяя с высокой точностью дифференцировать сетку от апоневротических анатомических структур пахового канала. У 5 пациентов при проведении сканирований, выполненных на 2-3 сутки послеоперационного периода, визуализация имплантов была частично затруднена из-за выраженной диффузной неоднородности окружающих тканей и наличия ограниченных скоплений воздуха.
Во всех ультразвуковых наблюдениях импланты пациентов первых трех групп исследования имели выраженный гиперэхогенный характер (рис. 1). Однако при сравнительной оценке нами была отмечена более высокая их эхогенность у больных с использованием классических полипропиленовых имплантов (первая группа) и в клинических наблюдениях использования самофиксирующихся сеток (третья группа). Более их высокая эхогенность по сравнению с имплантами пациентов второй группы исследования, у которых применялись легкие макропористые сетки, по нашему мнению, была связана с меньшим (1,0-1,6 мм по сравнению 3-4 мм) размером их ячеек при практически одинаковых показателях толщины нити плетения (130 и 120 мкм).
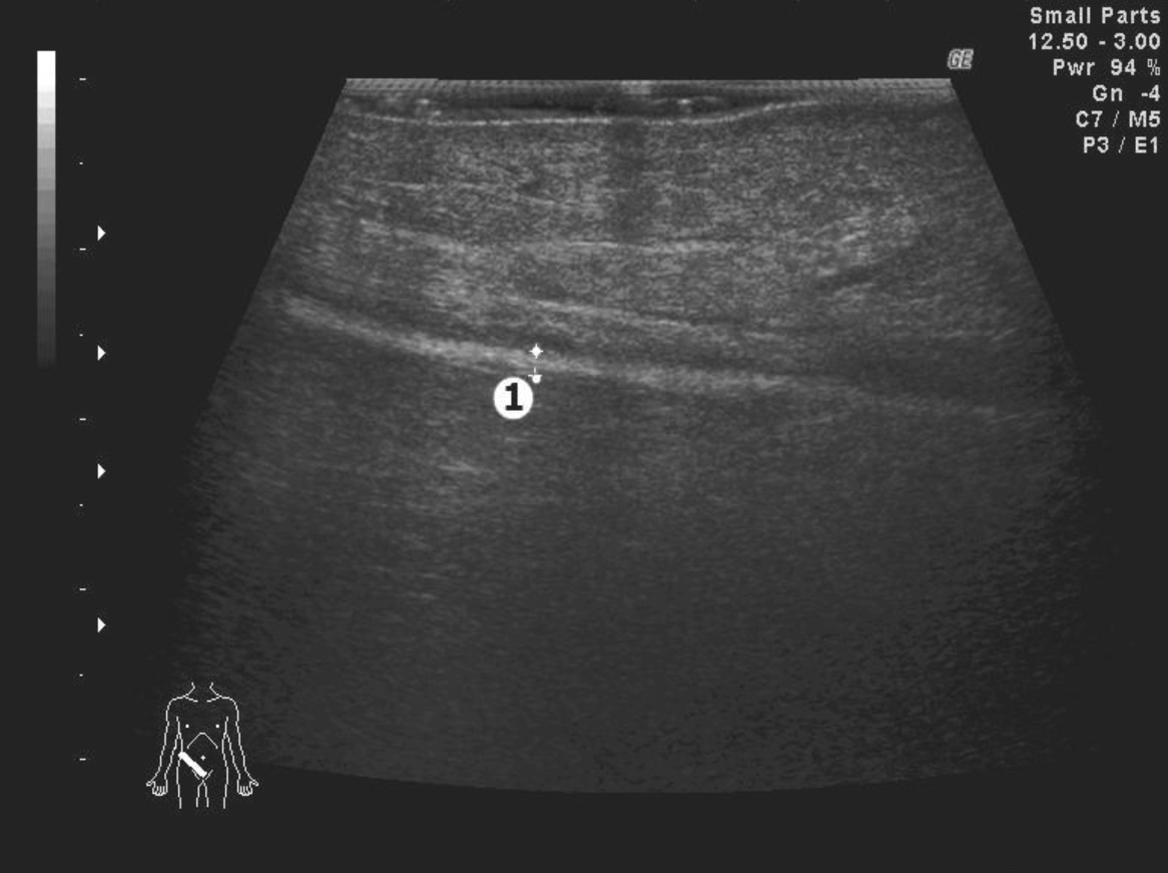
Рис. 1. Эхограмма «зоны оперативного вмешательства» после выполнения пластики пахового канала по Liechtenstein полипропиленовым имплантом. Косое сканирование в правой паховой области: 1 - маркировка толщины импланта.
Результаты проведения ультразвуковых сканирований «зоны оперативного вмешательства» пациентов четвертой группы исследования, показали, что частота визуализации полиэфирных имплантов не отличалась от показателей пациентов с применением полипропиленовых сеток. Тем не менее, у больных данной группы нами было отмечено существенное отличие их ультразвуковой картины. Оно заключалось в более низкой эхогенности сетки (средней интенсивности) и наличии ее двойного контура, соответствующего характеру объемного типа плетения импланта (рис. 2).
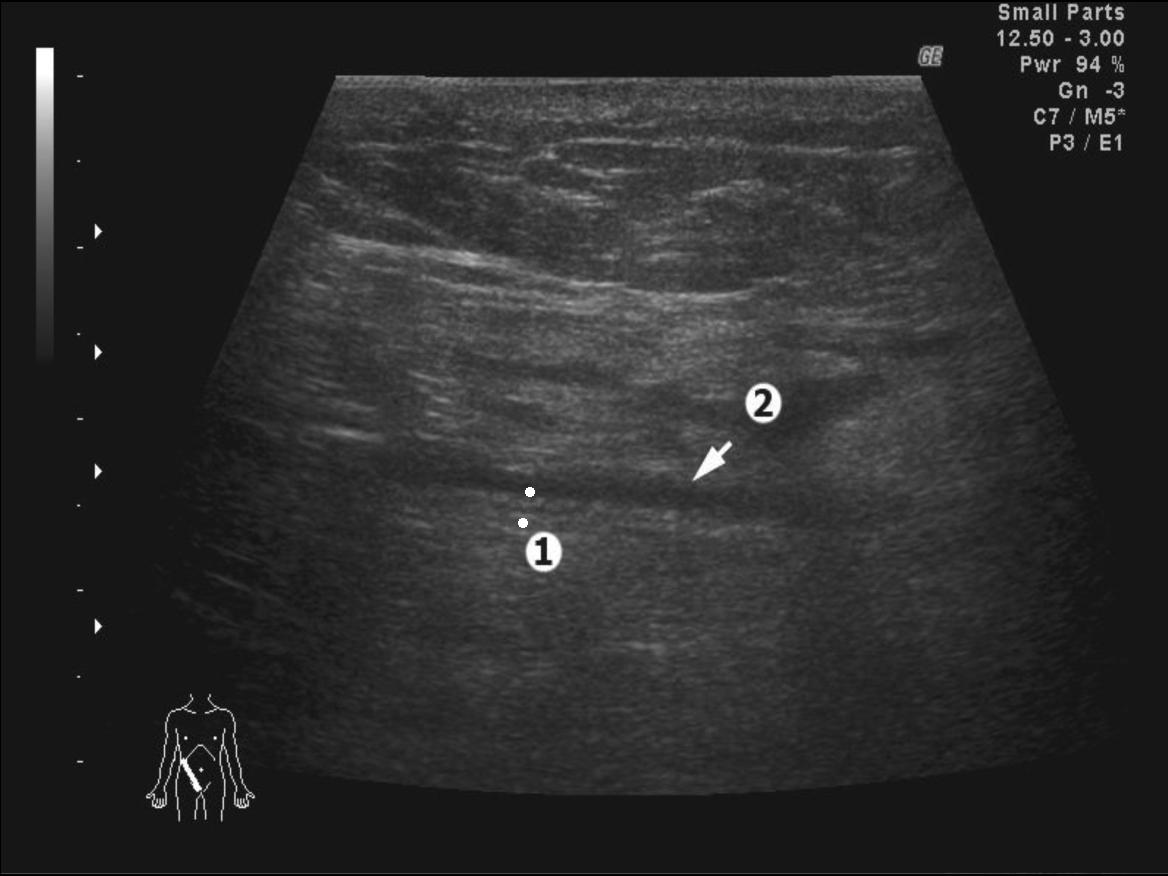
Рис. 2. Эхограмма «зоны оперативного вмешательства» после выполнения пластики пахового канала по Liechtenstein полиэстеровым имплантом. Косое сканирование в правой паховой области: 1 - маркировка толщины импланта, 2 - ограниченное скопление жидкости над имплантом.
По сравнению с полипропиленовыми имплантами дифференциация полиэфирных сеток в окружающих тканях была несколько затруднена, что, по нашему мнению, было обусловлено более низкой эхогенностью объемного полиэстера по сравнению с полипропиленом.
Динамические ультразвуковые исследования в отдаленном послеоперационном периоде выявили, что эхогенность имплантов у пациентов с классическими полипропиленовыми и полиэстеровыми сетками не менялась, в то время как в клинических наблюдениях пациентов второй и третьей групп исследования (композиционные импланты) отмечалось ее умеренное снижение за счет частичного их рассасывания.
Использованные импланты у большинства осмотренных больных визуализировался в виде линейной структуры, и только лишь у части пациентов (от 12,5% до 23,1%) отмечалась их волнистая форма. Более низкая частота визуализации волнистой формы сетки зарегистрирована у пациентов с применением легких макропористых полипропиленовых имплантов, что, по всей видимости, определялось не столько с манипуляционными свойствами и более низким удельным весом материала, сколько с особенностями техники их фиксации (степень натяжения) при выполнении самого оперативного вмешательства. Визуализация волнообразного характера имплантов, по нашему мнению, была также обусловлена и физиологическим покоем мышц передней брюшной стенки во время выполнения ультразвуковых исследований, которые проводились в положении лежа на спине.
При проведении динамических ультразвуковых исследований в отдаленном послеоперационном периоде волнообразный характер имплантов нами визуализирован не был, что объясняется процессами организации «зоны оперативного вмешательства», прорастания и частичного сморщивания синтетических материалов.
Толщина визуализированных имплантов у пациентов всех групп исследования практически не менялась в зависимости от сроков выполнения хирургического вмешательства, находясь в пределах от 1,2 до 2,1 мм. И только лишь в ультразвуковых наблюдениях пластики самофиксирующейся сеткой (третья группа) размеры импланта в области фиксирующего клапана имели значительную вариабельность (от 1,0 до 3,2 мм) из-за размытости его контуров.
В отдаленном послеоперационном периоде толщина имплантов пациентов первой и четвертой групп исследования оставалась прежней, в то время как в первые месяцы послеоперационного периода у больных второй и третьей групп она имела незначительную тенденцию к уменьшению (до 0,8-1,2 мм).
В раннем послеоперационном периоде у больных всех групп исследования при выполнении большинства ультразвуковых исследований отмечалось наличие ограниченных скоплений жидкости в области расположения имплантов. Ограниченные скопления жидкости, как правило, располагались по верхнему контуру сетчатого материала. Частота их визуализации у пациентов с применением полипропиленовых имплантов практически не отличалась между собой и находилась в пределах от 56,3% до 64,5%. Максимальные, статистически достоверно отличающиеся, показатели частоты регистрации ограниченных скоплений жидкости в области импланта были отмечены у больных, которым для пластики пахового канала применялись полиэфирные сетки. Она в 1,4-1,6 раза отличалась от аналогичного показателя больных первых трех групп исследования, составляя 87,5%. Толщина диагностированных скоплений жидкости не зависела от характера использованного импланта, варьируя от 1,9 до 4,5 мм.
При проведении динамических ультразвуковых исследований в раннем послеоперационном периоде частота визуализации скоплений жидкости прогрессивно снижалась, а в отдаленном послеоперационном периоде (более 1,5 месяцев) ни в одном из наблюдений зарегистрирована нами не была.
Подкожная жировая клетчатка в «зоне оперативного вмешательства» в раннем послеоперационном периоде у всех групп больных имела выражено диффузный неоднородный характер. Частота визуализации ограниченных скоплений жидкости в подкожной клетчатке, по нашему мнению, не отличалась от вида имплантированной сетки, и находились в пределах от 34,3% до 50,6% . Статистически достоверных различий в размерах ограниченных скоплений жидкости также отмечено не было. Их усредненные показатели составляли: 18,0-33,0 мм - в продольном и 5,0-10,8 мм - в поперечном размерах. В отдаленном послеоперационном периоде ограниченные скопления жидкости у осмотренных пациентов нами визуализированы не были.
Полученные результаты динамических ультразвуковых наблюдений раневого процесса у больных с паховыми грыжами после выполнения пластики по Лихтенштейну с применением различных видов синтетических имплантов позволил выявить следующие закономерности.
При проведении ультразвуковых сканирований «зоны оперативного вмешательства» все виды имплантов визуализируются в виде эхогенных структур линейной формы, и только лишь в единичных клинических наблюдениях сетчатый имплант может иметь волнообразный характер. Визуализация волнистости сетки в отдельных клинических наблюдениях может быть обусловлена физиологическим покоем мышц передней брюшной стенки во время сканирований.
Максимальная эхогенность при сканированиях отмечается у полипропиленовых синтетических имплантов, которая не меняется в зависимости от сроков выполнения оперативного вмешательства. При применении композиционных синтетических материалов в отдаленном послеоперационном периоде эхогенность имплантов снижается, что связано с процессами их частичной биодеградации. Более низкой (средней) эхогенностью сопровождается визуализация полиэстеровых имплантов, которые отличает их соответствующий плетению характерный двухконтурный вид.
При типичном течении раневого процесса толщина полипропиленовых и полиэстеровых сеток не имеет достоверного различия в зависимости от сроков и фазы раневого процесса. В отличие от них, биодеградация имплантированных композиционных полипропиленовых имплантов сопровождается постепенным уменьшением их толщины в отдаленном послеоперационном периоде.
Анализ частоты визуализации и размеров ограниченных скоплений жидкости в области расположения сетки позволили сделать заключение, что процесс имплантации всегда сопровождается развитием экссудативной реакции, являющейся критерием неосложненного раневого процесса. При этом размеры ограниченных скоплений жидкости могут иметь значительную вариабельность, обусловленную как индивидуальными особенностями реактивности тканей «зоны оперативного вмешательства», так и химически составом импланта.
Изменения структуры подкожной жировой клетчатки, частоты визуализации и размеров ограниченных скоплений жидкости в ней являются отражением фазности течения раневого процесса и не связаны с процессом имплантации сетки.
Таким образом, на основании полученных результатов динамических ультразвуковых исследований «зоны оперативного вмешательства» нами были изучены особенности течения раневого процесса у больных с паховыми грыжами после выполнения пластики пахового канала по Лихтенштейну. Выявлено, что применение для пластики синтетических материалов сопровождается развитием различной по степени интенсивности экссудативной реакцией тканей «зоны оперативного вмешательства», которая определяется видом использованного импланта. Ультразвуковое сканирование является высокоинформативным методом визуализации области герниопластики, позволяющим уточнить пространственное расположение сетки, его вид и структуру, а также уточнить особенности реакции тканей пахового канала в ответ на имплантацию.
Выводы
- Применение для пластики синтетических материалов сопровождается развитием различной по степени интенсивности экссудативной реакцией тканей «зоны оперативного вмешательства», которая определяется видом использованного импланта.
- Ультразвуковое сканирование является высокоинформативным методом визуализации области герниопластики, позволяющим уточнить пространственное расположение сетки, ее вид и структуру, а также уточнить особенности реакции тканей пахового канала в ответ на имплантацию.
