Актуальность. Проблема врожденных пороков развития продолжает оставаться в ряду наиболее актуальных и имеет серьезную социально – медицинскую значимость.
Врожденные пороки опорно-двигательной системы занимают одно из лидирующих мест среди всех врожденных аномалий. В структуре врожденных пороков развития первое место занимают врожденные пороки сердца (0,8 – 2,5% всех новорожденных), далее примерно с одинаковой частотой 1% следуют врожденные пороки центральной нервной системы и аномалии скелета [4].
Актуальность определяется трудностью своевременной диагностики данной патологии.
В настоящее время перед врачом ставится задача диагностировать дисплазию тазобедренных суставов и врожденный вывих бедра в условиях родильного дома или детской консультации в первые дни или недели жизни ребенка. Это вызвано тем, что в процессе роста ребенка нарастают патологические изменения в суставе и окружающих его тканях.
Несвоевременно начатое лечение, а тем более его отсутствие, приводит к тяжелым анатомо-функциональным изменениям в тазобедренном суставе и в конечном итоге к инвалидности ребенка [9].
В тоже время проведение функционального консервативного лечения с первых дней жизни ребенка в 90 - 95% случаев заканчивается полным анатомо-функциональным восстановлением сустава [2, 9, 14].
В отечественной и зарубежной литературе нам не встретились данные об изучении особенностей метаболизма соединительной ткани у детей с дисплазией тазобедренных суставов. Согласно одной из теорий «дисплазии тазобедренных суставов» первичной является дисплазия всех элементов тазобедренного сустава, в том числе сумочно-связочных и сосудистых структур [6]. Коллаген, являющийся основным компонентом соединительной ткани, составляет более 30% общей массы белков тела человека и присутствует почти в каждой ткани. Около 50% его приходится на скелетные ткани. Концентрация коллагенов на сырой вес ткани в сухожилиях составляет – 25-30%, костях и хрящах – 10-20%, в стенках кровеносных сосудов – 5-6%, в скелетных мышцах – 1-2%. Распад коллагена происходит под действием коллагеназ, проявляющих свою активность при pH=7,0-9,0. Образующиеся в результате деградации коллагена пептиды либо выводятся с мочой, либо расщепляются специфическими ферментами до аминокислот. Гидроксипролин, освобожденный из этих пептидов, оказывается в крови, моче, часть его окисляется в печени [8].
Интерес к проблемам изучения метаболизма соединительной ткани обусловлен тем, что качественные и количественные нарушения синтеза, созревания и распада коллагена являются важным звеном патогенеза многих заболеваний [1, 7]. В настоящее время выяснены молекулярные механизмы нарушения обмена коллагена, лежащие в основе некоторых вариантов врожденной патологии соединительной ткани, таких как синдромы Элерса–Данлоса и Менле, несовершенный остеогенез [3, 15]. Таким образом, анализ различных фракций гидроксипролиа, как индикаторов направленности обмена коллагенов позволяет оценить состояние соединительных и скелетных тканей у новорожденных детей, и возможно будет играть роль одного из критериев ранней диагностики врожденного вывиха бедра.
Цель: изучение особенностей обмена соединительной ткани у детей с врожденным вывихом бедра.
Материалы и методы. Содержание свободного (СОП) и пептидсвязанного (ПСО) гидроксипролина в биологических жидкостях пациентов определяли по методам П.Н. Шараева [11, 12]. Уровень различных фракций гидроксипролина выражали в мкмоль/л.
Исследование свободного оксипролина и его фракций в сыворотке крови. Из локтевой вены или поверхностных вен головы пациентов в шприц забиралось около 1,5 – 2,0 мл крови. Методом центрифугирования получали около 1,0 мл сыворотки, которую в дальнейшем использовали для определения уровня фракций гидроксипролина.
Принцип. Гидроксипролин-содержащие пептиды подвергают кислотному гидролизу. Затем свободный гидроксипролин подвергают окислению хлорамином Б или Т и продукты его окисления конденсируют парадиметиламинобензальдегидом, при этом образуется хромоген.
Реактивы. 1) 8,5 М (57%) хлорная кислота; 2) 0,3 М (5%) трихлоруксусная кислота; 3) 3,1 мМ (0,1%) раствор фенолфталеина в 16,1 М (94%) этаноле; 4) 6 М (24%) раствор едкого натра; 5) 0,26 М (7%) раствор хлорамина Б или Т в 0,1 М фосфатном буфере pH 8,0 (стойкость до 7 дней); 6) 0,67 М (10%) раствор парадиметиламинобензальдегида в 16,1 М (94%) этаноле (стабилен до 15 дней); 7) водные растворы, содержащие 1,5,10,20 мкг гидроксипролина1(Sigma, США) в 4 мл (молекулярная масса гидроксипролина 131 Да).
Ход исследования. В пробирку наливают 2 мл сыворотки или плазмы крови, 1 мл 0,3 М трихлоруксусной кислоты и 1 мл 8,5 М хлорной кислоты. Содержимое пробирок перемешивают и центрифугируют в течение 5-6 мин при 3000 оборотов/мин. Надосадочную жидкость количественно переносят в мерную центрифужную пробирку. Осадок сохраняют для дальнейших исследований.
Ровно половину надосадочной жидкости переносят в 1-ю центрифужную пробирку. В нее добавляют 1 каплю раствора фенолфталеина и содержимое пробирки нейтрализуют 6 М раствором едкого натра, добиваясь появления устойчивой слабопурпурной окраски по всему объему жидкости. В случае появления интенсивной окраски в смесь добавляют каплю хлорной кислоты и вновь нейтрализуют ее щелочью (при завершении нейтрализации кислоту и щелочь в пробы лучше добавлять на кончике стеклянной палочки).
Вторую половину надосадочной жидкости (2-я центрифужная пробирка) закрывают специальными каплеуловителями или центрифужной пробиркой с холодной водой и гидролизуют в кипящей водяной бане в течение 40 мин, охлаждают до 18-22ºС и нейтрализуют, как указано выше.
К полученному осадку (см. выше) добавляют по 1 мл дистиллированной воды, 0,3 М трихлоруксусной кислоты и 8,5 М хлорной кислоты. Осадок эмульгируют. Пробирку закрывают каплеуловителем, ее содержимое гидролизуют при 100ºС в течение 6 ч и охлаждают до 18-22ºС. Охлажденную смесь центрифугируют в течение 5-6 мин при 3000оборотов/мин. Надосадок гидролизата отделяют и нейтрализуют его в 3-й центрифужной пробирке, как указано выше.
Содержимое всех 3-х пробирок доводят до 4 мл дистиллированной водой; 4-я пробирка (контроль) содержит 4 мл воды.
Во все 4 пробирки при перемешивании добавляют по 0,5 мл раствора хлорамина, а через 4 мин – 0,5 мл реактива 6 и хлорной кислоты. Все 4 пробирки одновременно помещают в кипящую водяную баню на 120 с. Содержимое пробирок встряхивают, оставляют на 10 мин при 18-22 ºС и центрифугируют (10 мин, 3000оборотов/мин). Супернатанты отделяют в соответствующие пробирки, к ним добавляют по 0,5 мл н-пропанола, затем их перемешивают и фотометрируют при 560 нм (зеленый светофильтр) в кюветах с длиной оптического пути 1 см против контроля. Окраска супернатанта в темноте при 18-22ºС устойчива в течение 3-4 ч.
Содержимое свободного гидроксипролина (1-я пробирка), свободного и пептидсвязанного гидроксипролина (2-я пробирка) и белоксвязанного гидроксипролина (3-я пробирка) рассчитывают по калибровочной кривой, построенной с использованием данных растворов гидроксипролина и выражают в микромолях на 1 л сыворотки крови. По разности количеств гидроксипролина в 1-й и 2-й пробирках находят содержание пептидсвязанного гидроксипролина.
Учитывая, что в исследовании принимали участие новорожденные дети, в т.ч. недоношенные, количества забираемой крови хватало для получения 1 мл сыворотки. В связи с этим объемы трихлоруксусной кислоты и хлорной кислоты (для осаждения и гидролиза белков) сокращали вдвое. При работе необходимо использовать вытяжной шкаф.
Особенности исследования мочи. Для исследования берут разовую (утреннюю, собранную с 7 до 8 ч; случайную). При исследовании мочи анализ необходимо проводить сразу в двух параллельных пробирках – один из них контроль. В обеих пробах анализ проводят согласно представленному методу, при этом в контрольные пробы вместо хлорамина добавляют 0,5 мл воды.
Проведено исследование показателей метаболизма биополимеров соединительной ткани в биологических жидкостях (сыворотка крови, моча) у 20 детей с нормальными тазобедренными суставами и у 17 детей с врожденным вывихом бедра. Отбор детей для данного исследования проводили методом случайной выборки, достоверность результатов исследования определяли непараметрическим статистическим методом Вилкоксона – Манна – Уитни. Возраст детей составил от 2 недель до 3 месяцев. Забор крови и мочи производился в утренние часы.
Для оценки полученных отклонений изучаемых показателей метаболизма биополимеров костной ткани использовали литературные данные [5, 10].
Одним из основных показателей метаболизма коллагена является содержание оксипролина в сыворотке крови и моче. Оксипролин (производное пролина) — одна из основных аминокислот коллагена, что позволяет считать его маркером, отражающим метаболизм этого белка. Около 20% оксипролинсодержащих пептидов, высвобождаемых из коллагеновых молекул, экскретируется с мочой. Только 1% оксипролина мочи находится в свободном виде, остальные 99% являются компонентами пептидов.
В большинстве разновидностей соединительной ткани, для которых одной из главных функций является опорная, содержание коллагена резко повышается. В разновидностях этой ткани наблюдается пролиферация фибробластов, хондробластов и остеобластов. В этих клетках активируется биосинтез различных типов коллагена и структурных гликопротеинов, которые участвуют в построении тканей и органов. В обмене коллагена важная роль принадлежит ферментам гидроксилирования (пролил- и лизилгидроксилаза) и глюкозилирования (глюкозил- и галактозилтрансфераза), которые внутриклеточно модифицуруют коллаген. Эти модификации коллагена в онтогенезе являются одним из важных факторов, которые определяют биологические, микроархитектурные и механобиохимические свойства коллагеновых волокон.
Таблица 1. Содержание фракций гидроксипролина в биологических жидкостях (сыворотка крови, моча) в зависимости от типа тазобедренного сустава (мкмоль/л)
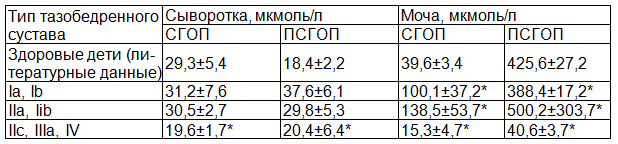
Примечание: * - при оценке достоверности различий использовался критерий Вилкоксона – Манна – Уитни, при расчете которого различия в содержании различных фракций гидроксипролина являются достоверными (p<0,05).
Из табл. 1 видно достоверное различие в содержании свободного и пептидсвязанного гидроксипролина как в сыворотке крови, так и в моче у детей с врожденным вывихом бедра по отношению к детям с нормальными и физиологически незрелыми тазобедренными суставами (тип Ia, Ib, IIa, IIb по Р. Графу). Определяется резкое снижение свободного и пептидсвязанного гидроксипролина в моче в несколько раз по отношению к норме (здоровым детям). Для установления степени преобладания процессов синтеза коллагена над его распадом у детей, имеющие различные типы тазобедренных суставов, мы использовали определение величины отношения пептидсвязанного гидрооксипролина и свободного гидроксипролина – ПСГОП/СГОП, предложенное Н.С. Стрелковым [10].
После проведенного анализа полученных данных в группе детей с врожденным вывихом бедра на фоне пониженного содержания СГОП данный коэффициент был значительно снижен, напротив, у детей с нормально развитыми тазобедренными суставами наблюдали увеличение показателя представленного коэффициента. В результате полученные данные у детей с нормально развитыми тазобедренными суставами свидетельствуют об активизации фибриллогенеза, т.е. преимущественно анаболической направленности обмена соединительной ткани, что соответствует литературным данным [5]. У детей с дисплазией тазобедренных суставов процессы синтеза коллагеновых волокон протекают медленнее, возможно вследствие замедления образования или уменьшения количества поперечных связей в фибриллах коллагена, в целом угнетения процессов метаболизма соединительной ткани, что наблюдается при других формах дисплазии соединительной ткани [11, 13].
Выводы:
- У детей с врожденным вывихом бедра процессы метаболизма соединительной ткани резко замедленны, что приводит к изменению структуры и свойств соединительной ткани.
- Анализ различных фракций гидроксипролиа, как индикаторов направленности обмена коллагенов, позволяет оценить состояние соединительных и скелетных тканей у новорожденных детей, и возможно будет играть роль одного из критериев ранней диагностики дисплазии тазобедренных суставов.
