Заболевания области тазобедренного сустава, чаще выявленные на поздних или диагностируемые на ранних стадиях заболевания заслуживают пристального внимания и требуют хирургического лечения. Нарушение биомеханики походки, стойкие контрактуры, деформации, выраженный болевой синдром приводят к ухудшению качества жизни пациента, ранней инвалидизации и способствуют уменьшению количества активного работоспособного населения. Всё это негативно сказывается на экономических и демографических показателях многонационального государства. С увеличением общей продолжительности жизни населения будет возрастать и частота заболеваемости тазобедренного сустава [1-5].
В отделении ортопедии ГБУЗ ГКБ №12 ДЗМ на базе кафедры травматологии и ортопедии РУДН был проведен анализ клинических и рентгенологических наблюдений 75 операций тотального эндопротезирования тазобедренного сустава, в ходе которых применялись бедренные компоненты бесцементной фиксации с системой модульных шеек фирмы «Wright»: Preserve, Profemur L, Profemur Z, произведенных из сплавов с содержанием кобальта и хрома.
Легирование кобальтом стали повышает её жаропрочность, улучшает механические свойства. Потребность человека в кобальте колеблется от 0,007 до 0,015 мг ежедневно. В теле человека содержится 0,2 мг кобальта на каждый килограмм массы человека. При отсутствии кобальта развивается акобальтоз. Избыток кобальта может привести к склерозу легких, кардиомиопатии, контактному дерматиту, гиперплазии щитовидной железы, невриту слухового нерва, увеличению содержания липидов, количества эритроцитов в крови и повышению артериального давления.
Хром - важный компонент во многих легированных сталях (в частности, нержавеющих), а также в ряде других сплавов. Добавка хрома существенно повышает твердость и коррозийную стойкость сплавов. Хром является одним из биогенных элементов, постоянно входит в состав тканей человека. У человека хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Наибольшее количество ионов хрома обнаруживается в костях, волосах и ногтях. Снижение содержания хрома в крови приводит к уменьшению скорости роста, увеличению холестерина в крови. Данный металл вызывает специфическое поражение кожи (дерматит, язвы), изъязвление слизистой оболочки носа с характерной перфорацией хрящей носовой перегородки, гастриты, язву желудка и двенадцатиперстной кишки (неблагоприятно протекающую), хромовый гепатоз, нарушение регуляции сосудистого тонуса и сердечной деятельности. Острое отравление возникает при его поступлении в организм в дозе более 1,5 мг/кг массы тела и связано с его высокими окислительными способностями, которые приводят к гемолизу, острой почечной и печеночной недостаточности. Кроме того, соли хрома способны вызывать аллергические реакции.
Из этого следует, что баланс кобальта и хрома является актуальной проблемой и определение его концентрации у пациентов возможно путем эмиссионного спектрального анализа тканей, масс-спектрометрии с индуктивно-связанной плазмой и атомно-адсорбционной спектрометрии с электротермической атомизацией.
Последние 20 лет в литературе упоминания о модульных бедренных компонентах эндопротезов тазобедренного сустава были сосредоточены на двух основных возможных проблемах:
1. Накопление дебриса и ионов металлов в организме вследствие нормального износа компонентов эндопротеза и дополнительного узла трения, особенно с парой трения металл-металл. Использование пары трения метал-метал было приостановлено большинством производителей, а импланты отозваны с рынка в связи с негативным воздействием ионов металлов на организм пациентов.
2. Перелом модульной шейки вследствие щелевой и фреттинг-коррозии (рис. 1 а, б) [8] и перелом медиальной стенки ножки в узле сочленения с шейкой (рис.2).
![Рис. 1. Перелом модульной шейки вследствие фреттинг-коррозии в месте сочленения с бедренным компонентом, данные Wright C.G. [8].](/images/articles/2015/5.1/15211/p1.png)
Рис. 1. Перелом модульной шейки вследствие фреттинг-коррозии в месте сочленения с бедренным компонентом, данные Wright C.G. [8].
![Рис. 2. Перелом медиальной стенки ножки в узле сочленения с шейкой, данные Wodecki P. [7].](/images/articles/2015/5.1/15211/p2.png)
Рис. 2. Перелом медиальной стенки ножки в узле сочленения с шейкой, данные Wodecki P. [7].
По результатам испытаний рядом авторов во главе с Baleani M. [6] в растворе Рингера было смоделировано 20 миллионов циклов работы эндопротеза тазобедренного сустава с модульной шейкой, что соответствовало 20 годам использования эндопротеза в организме человека. Данных, свидетельствующих о первичной коррозии, не было, были отмечены единичные точечные коррозийные повреждения. Количество дебриса составило менее чем 1 мг/год. С 1995 по 2001 г. Baleani M. было произведено 864 операции по первичному эндопротезированию тазобедренного сустава с использованием систем модульных шеек бедренных компонентов: 458 женщин и 406 мужчин. Средний возраст составил 55 лет (16-81 лет). Выживаемость оценивали по методу Каплана-Мейера. Было получено 3 осложнения: 2 вывиха головки эндопротеза и 1 миграция (проседание в канале) бедренного компонента, что потребовало ревизионных вмешательств. Ни одного случая перелома модульной шейки и конически-эллиптического узла сочленения не выявлено. За 6 лет наблюдений выживаемость бедренного компонента с модульной шейкой составила 99,4%. Модульные бедренные компоненты показали отличные клинические результаты, так как риск развития нестабильности может возникнуть при увеличении количества дебриса до 10 мг/год.
Известно, что факторами асептической нестабильности компонентов эндопротеза являются продукты износа дополнительного узла трения в области сочленения модульной шейки и бедренного компонента, вызывающие резорбцию кости грануляционной тканью. Накопление ионов металлов в тканях организма, вследствие фреттинг-коррозии или износа дополнительного узла трения, принято называть металлозом. Для количественного определения содержания ионов кобальта и хрома в крови у пациентов после тотального эндопротезирования тазобедренного сустава с применением модульной шейки бедренного компонента с целью оценки степени токсичности и износа в области модульного сочленения была проведена атомно-адсорбционная спектрометрия с электротермической атомизацией в сроки наблюдения от 3,5 до 4 лет (рис. 3).
Из всех пациентов была отобрана контрольная группа (15 мужчин и 15 женщин) со схожими антропометрическими показателями, возрастом и степенью физической активности. Средние количественные значения ионов кобальта и хрома в крови у пациентов представлены в табл. 1.
Таблица 1. Средние количественные значения ионов кобальта и хрома в крови у пациентов из 1 группы
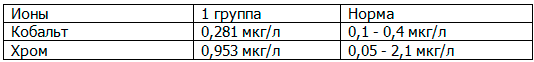
Анализ результатов атомно-адсорбционной спектрометрии с электротермической атомизацией у пациентов из группы модульного бедренного компонента в отдаленном периоде наблюдения до 4 лет показал, что степень токсичности дополнительного узла трения незначительно превышает референсные значения по количественному содержанию кобальта и хрома в венозной крови, что указывает на умеренную (ожидаемую) степень износа в области модульного сочленения бедренного компонента
