Введение. Травматизм является одной из ведущих причин общей заболеваемости взрослого населения [2]. В Российской Федерации переломы костей верхней конечности составляют около 11%, а нижней конечности - около 7% от всех травм [10]. Согласно данным, приведённым в [11], открытые переломы длинных костей конечностей встречаются у 21,4-48,9% пострадавших с травмами.
Одной из причин неблагоприятных исходов у пациентов с переломами конечностей является нарушение процессов нормальной консолидации переломов. Существуют определённые факторы риска для развития таких нарушений. Это высокоэнергетичные травмы, полученные в результате дорожно-транспортных происшествий, падений с высоты. Такой механизм приводит к большей выраженности локального повреждения и последующим трофическим расстройствам в области открытого перелома [6]. При политравме, наличии переломов нескольких сегментов также высок риск несращения [5,7].
К настоящему времени определен ряд способов воздействия на консолидацию переломов. Это использование костнопластических материалов на основе трикальцийфосфата [3]; препаратов костного мозга [17], обогащенной аутоплазмы [1]; применение физических факторов - электромагнитного излучения [4], импульсного ультразвука [8].
Одним из направлений исследований воздействия на консолидацию переломов является применение различных биологически активных веществ - факторов роста, в частности, фактора роста фибробластов (ФРФ). ФРФ - многофункциональные белки с большим набором эффектов; чаще всего они являются митогенами, но также оказывают регуляторное, структурное и эндокринное воздействие [13]. ФРФ обладает мощным ангиогенным действием [15].
В результате многолетних исследований в Оренбургской государственной медицинской академии был обнаружен природный штамм бактерий Bacillus subtilis 804, продуцирующий бактериальный ФРФ [9]. Был создан экспериментальный препарат, содержащий метаболиты Bacillus subtilis 804. Существенный научный и практический интерес представляет изучение влияния метаболитов Bacillus subtilis 804, содержащих ФРФ, на процессы консолидации переломов.
Цель работы заключалась в установлении влияния метаболитов Bacillus subtilis 804, содержащих ФРФ, на репаративный остеогенез открытых переломов в эксперименте.
Материал и методы. Исследование выполнено с использованием 112 белых крыс-самцов линии «Wistar» массой 185 - 215 г. Все манипуляции с животными выполнены в соответствии с требованиями «Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей» [12], Хельсинской декларации от 2000 г. «О гуманном отношении к животным» и приложении №8 «Правил гуманного отношения к лабораторным животным», правил лабораторной практики в РФ (приказ МЗ РФ №267 от 19.06.2003). Было получено одобрение Локального этического комитета ГБОУ ВПО ОрГМУ Минздрава России.
Всем животным осуществлялась остеотомия средней трети бедра с последующим интрамедуллярным остеосинтезом спицей.
Рис. 1. Остеосинтез бедра крысы спицей. «Обзорная» рентгенограмма.
Рис. 2. Рана через сутки после операции.
Операции проводились под внутрибрюшинным наркозом 1% раствором тиопентала натрия в дозе 40 мг на 1 кг массы животного. 56 животным опытной группы дважды вводили в область перелома по 0,2 мл метаболитов Bacillus subtilis 804 - непосредственно после наложения швов и через 24 часа. Крысы контрольной группы получали раствор натрия хлорида 0,9% в том же количестве.
Ежедневно у животных этих двух групп оценивалось клиническое состояние ран, регистрировались потребление корма и воды, особенности поведения, масса тела животных. Выполнялись рентгенограммы с помощью цифровой С-дуги.
На 3, 7, 14, 21, 28, 44 и 61 сутки по 8 крыс каждой группы были подвергнуты эвтаназии путём декапитации под эфирным наркозом. Забирались ткани области перелома для морфологических исследований.
Метаболиты Bacillus subtilis 804 содержат ФРФ. Обнаруженный ФРФ - это комплекс термостабильных (до 128ºС) четырех белков молекулярной массой от 11 до 14 кДа. В разведении 1:10 - 1:20 он оказывает почти такое же стимулирующее действие на рост культуры клеток эмбриональных фибробластов человека и опухолевых клеток С6 глиомы, как и 5% фетальная сыворотка (стандарт). Фактор роста чувствителен к протеолизу под действием трипсина, имеет изоэлектрическую точку в области 9,2-9,3 [9]. Мы применяли метаболиты штамма Bacillus subtilis 804 в виде стандартизированного экспериментального препарата. Препарат представляет собой стерильную прозрачную жидкость, содержащую 5% метаболитов с новым ФРФ и воду. Содержание белка в нем - не менее 0,1%, а количество фактора роста - не менее 10 нанограмм в мл. РH препарата равен 7,1±0,2.
Фрагменты отломков костей с костной мозолью фиксировали в 10% нейтральном формалине (на фосфатном буфере) с последующей декальцинацией, обезвоживанием в спиртах возрастающей крепости, заливкой кусочков парафином - целлоидином и изготовлением гистосрезов толщиной 5,0-6,0 мкм. Исследования проводили с использованием гистологических, иммуногистохимических методов и морфометрии. Гистологическое исследование включало окраску гематоксилином Майера и эозином. При проведении иммуногистохимических методов исследования для выявления экспрессии CD68 (маркер макрофагов, хондро- и остеокластов) и collagen I использовались соответственно антитела anti-CD68 («SPRING Bioscience», США), anti-Collagene I Type («GeneTex», США). Используемая система детекции - Reveal Polyvalent HRP - DAB Detection System («SPRING Bioscience», США). Подсчет клеток производился в абсолютных значениях (абсолютная численная плотность - АЧП) при общем увеличении х300 на площади соответствующего среза (поля зрения - п.з.) равной 0,077 мм² минимум в 5 полях зрения для каждого показателя. Подсчет площади коллагеновых волокон производился в относительных значениях (относительная объёмная плотность - ООП), как отношение площади коллагена I типа к общей площади тканевых элементов в пределах исследуемого гистосреза на 1 микрофотографии (равной 1 полю зрения) при увеличении х300 минимум в 5 полях зрения (микрофотографий) для каждого показателя.
Статистическая обработка производилась на персональном компьютере с помощью лицензированного пакета прикладных программ приложения Microsoft Office в операционной системе Microsoft Windows 7. Для оценки достоверности различий между количественными показателями групп использовали однофакторный дисперсионный анализ. Различия считали достоверно значимыми при уровне вероятности р≤0,05.
Результаты и обсуждение. Различия в толщине периостальной костной мозоли представлены на рис. 3. На всех сроках исследования наблюдается достоверное различие (p≤0,05) между показателями толщины периостальной костной мозоли животных опытной и контрольной групп. У крыс опытной группы отмечается более быстрый рост мозоли на 7-е сутки, но в целом её толщина значительно меньше, чем в контрольной группе. Это говорит о большей стабильности перелома у животных опытной группы. Так как метод остеосинтеза у всех животных был одинаковый - интрамедуллярный остеосинтез, то стабильность в опытной группе перелома достигалась за счёт лучшего формирования эндостальной костной мозоли.
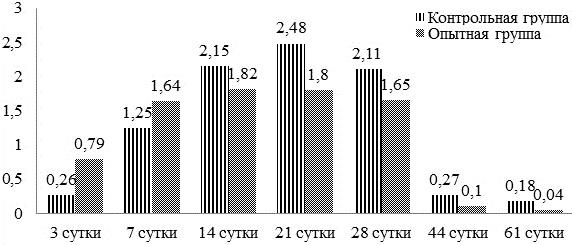
Рис. 3. Динамика изменения толщины периостальной костной мозоли (мм).
В табл. 1 представлены данные о сравнительной численности остеобластов и остеоцитов в области костной мозоли.
Таблица 1. Абсолютная численная плотность остеогенных клеток в области костной мозоли (интермедиарная часть) на различных сроках наблюдения
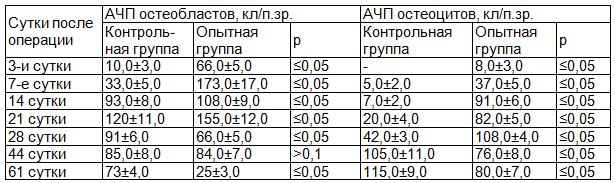
При анализе видно, что на ранних сроках (3 и 7 сутки после перелома) наблюдалась значительная разница между опытной и контрольной группами в содержании остеобластов и остеоцитов.
Сравнительные данные о содержании коллагена I типа в области интермедиарной костной мозоли приведены в табл. 2.
Таблица 2. Относительная объёмная плотность коллагена I типа в матриксе, %
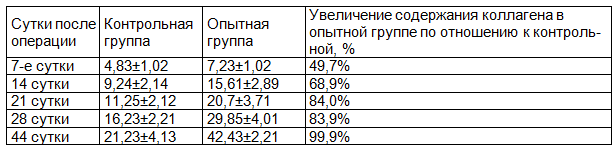
На всех сроках наблюдается достоверное различие в относительном содержании коллагена, p≤0,05.
При детальном гистологическом изучении препаратов выявлено, что на 3 сутки у животных контрольной группы в интермедиарной зоне перелома выражена воспалительная реакция: отёк, лейкоцитарная инфильтрация, появление грануляционной ткани, отсутствие остеокластов. У животных опытной группы в области интермедиарной мозоли воспалительная реакция нивелирована, появившиеся остеокласты формируют лакуны резорбции в интермедиарной зоне костных отломков. На фоне развитой грануляционной ткани заметна выраженная пролиферация клеток мезенхимального происхождения с началом дифференцировки в хондробласты и остеобласты.
Контрольная группа, 7 сутки. В интермедиарной зоне перелома на фоне развитой грануляционной ткани заметна пролиферация клеток мезенхимального происхождения, абсолютная численная плотность (АЧП) которых равна 195,0±13,0 на поле зрения. В небольшом количестве появляется матрикс с волокнами коллагена (волокнистый матрикс), в котором относительная объёмная плотность (ООП) коллагена I типа составляет 4,83±1,02%, также отмечаются группы остеобластов с АЧП остеобластов 33,0±5,0/п.з.
Опытная группа, 7 сутки. Начинает формироваться интермедиарная костная мозоль, состоящая из хряща, клеточный состав которого представлен небольшим числом хондроцитов (АЧП = 25,0±3,0/п.з.). Центральные отделы интермедиарной зоны содержат редуцирующуюся грануляционную ткань с обилием волокнистого матрикса и пролиферирующих остеобластов с АЧП173,0±17,0/п.з. ООП коллагена I типа составляет 7,23±1,02%.
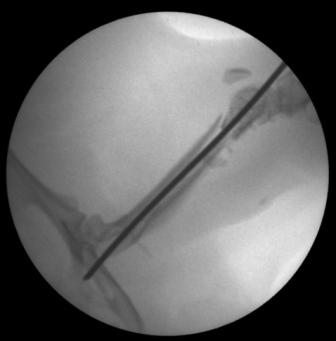
Контрольная группа, 14 сутки. На 14 сутки различия между двумя группами становятся ещё более заметными. В интермедиарной зоне перелома у животных контрольной группы на фоне остатков редуцирующейся грануляционной ткани только появляется волокнистый матрикс (ООП коллагена I типа составляет 9,24±2,14%) с группами пролиферирующих остеогенных клеток, АЧП остеобластов в которых равно 93,0±8,0/п.з. На рентгенограмме признаков костной мозоли не выявлено (рис. 4).
В опытной группе на 14 сутки интермедиарная костная мозоль представлена остатками деградирующего хряща и очагами формирования ретикулофиброзной кости, состоящими преимущественно из остеобластов (АЧП = 108,0±9,0/п.з.), а также значительного числа остеоцитов (АЧП = 91,0±6,0/п.з.), окруженных минерализующимся остеоидом и, непосредственно прилегающим к остеоцитам, узким слоем минерализованного грубоволокнистого костного матрикса и незрелого внеклеточного остеоидного матрикса. При этом центральный отдел интермедиарной мозоли представлен небольшим участком волокнистого матрикса, ООП коллагена I типа в котором составляет 15,61±2,89%. На рентгенограммах появляются признаки костной мозоли (рис. 5).
 |
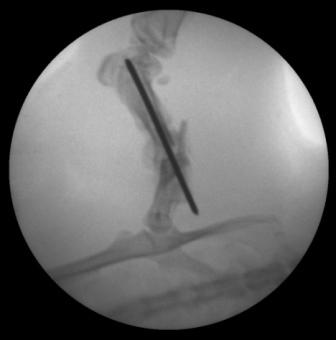 |
| Рис. 4. Рентгенограмма бедра крысы контрольной группы, 14 сутки. | Рис. 5. Рентгенограмма бедра крысы опытной группы, 14 сутки. |
На 44 сутки у крыс контрольной группы интермедиарная костная мозоль состоит из небольших очагов деградирующего хряща (АЧП хондробластов и хондроцитов составляет 40,0±5,0/п.з.) и формирующихся балок ретикулофиброзной кости. Они, в свою очередь, состоят из остеобластов (АЧП=85,0±8,0/п.з.) и остеоцитов (АЧП=105,0±11,0/п.з.), замурованных в остеоидный матрикс, с ООП коллагена I типа равной 21,23±4,13%.
На 44 сутки в опытной группе намечается ремоделированиеинтермедиарной костной мозоли в диафиз трубчатой кости. Из балок пластинчатой кости, хаотично расположенных на более ранних сроках, начинают формироваться компактное и губчатое вещество. В составе компактного вещества присутствует небольшое количество костномозговых полостей. Экспрессия коллагена I типа (ООП 42,43±2,21%) на этом сроке возрастает на четверть.
На 61 сутки у животных опытной группы наблюдалась полная консолидация перелома с полноценной перестройкой костной мозоли в диафиз трубчатой кости с органотипичным строением периоста, компактного вещества и эндоста (рис. 6). В контрольной группе гистологическая картина костной мозоли сходна с таковой, наблюдавшейся в опытной группе на 44 сутки. А именно, интермедиарная костная мозоль представлена разросшейся ретикулофиброзной костной тканью (рис. 7). В некоторых местах ещё сохранялись мелкие очаги деградирующего гиалинового хряща (АЧП хондроцитов составляет 14,0±3,0/п.з.).
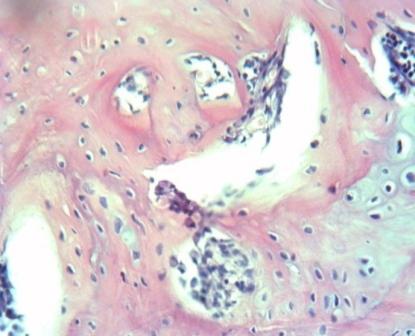
Рис. 6. Контрольная группа. Область перелома бедренной кости (интермедиарная костная мозоль), 61 сутки. Окраска гематоксилин-эозин. Ув. 300.
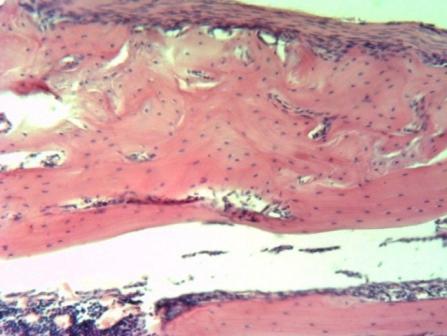
Рис. 7. Опытная группа. Область консолидированного перелома бедренной кости, 61 сутки. Окраска гематоксилин-эозин. Ув. 150.
Выявлено, что у животных опытной группы на 3 сутки наблюдалась значительная активация неоангиогенеза. Усиление ангиогенеза при использовании ФРФ для лечения ран получено в различных экспериментальных работах [16, 19]. По данным ряда авторов [18], ФРФ являются более мощными ангиогенными факторами, нежели фактор роста эндотелия сосудов или фактор роста тромбоцитов. Как известно, ангиогенез является мощным стимулирующим фактором для образования костной мозоли.
Таким образом, обнаружено, что применение метаболитов Bacillussubtilis 804 лимитирует выраженность воспалительного процесса, сокращает фазу ранних посттравматических изменений. В обеих сравниваемых группах сращение отломков кости проходит хрящевую стадию, но в опытной группе, наряду с формированием более массивной хрящевой манжетки уже к 3-м суткам, наблюдается и ранняя резорбцию хряща - на 14 сутки. Благодаря своевременной и надежной фиксации отломков периостальной мозолью в опытной группе интермедиарная мозоль начинает формироваться на 7 сутки (в контрольной группе - на 14 сутки). У животных опытной группы уже на 3 сутки наблюдается значительная активация неоангиогенеза (АЧП эндотелиоцитов 42,0±6,0/п.з., в контрольной группе данный показатель равен 7,0±2,0/п.з.). Это обеспечивает не только более ранние сроки образования костной мозоли, но и преобладание остеобластического типа дивергентной дифференцировки в междифферонной гетероморфии за счет создания лучших условий оксигенации по сравнению с контролем.
Ещё в 1996 г. установлено, что группа белков - факторов роста фибробластов оказывают влияние на различные типы клеток, оказывают регуляторное, структурное и эндокринное воздействие [13].
Эти данные не противоречат полученным нами фактам о стимуляции репаративного остеогенеза.В 2015 г. опубликованы сведения о том, что ФРФ повышает синтез остеопоэтина [14].
Мы выявили, что консолидация переломов бедра у животных опытной группы происходила быстрее, чем у крыс группы контроля. Так, на 61 сутки после перелома гистологическая картина костной мозоли в контрольной группе сходна с таковой, наблюдавшейся в опытной группе на 44 сутки. То есть на сроке 61 день мы видим ускорение консолидации на 17 суток (38%) по отношению к группе контроля.
Выводы
- Метаболиты Bacillus subtilis 804, содержащие ФРФ, влияют на репаративный остеогенез и ускоряют процессы консолидации в эксперименте. На сроке 61 день после травмы ускорение консолидации составило в среднем 17 суток (38%) по отношению к группе контроля.
- Применение метаболитов Bacillus subtilis 804 сокращает фазу ранних посттравматических изменений, а также приводит к значительной активации неоангиогенеза в области костной мозоли в эксперименте.
- Обосновано проведение дальнейших исследований по разработке лекарственного препарата на основе метаболитов Bacillus subtilis 804 для улучшения результатов лечения переломов.
