Введение. Анализ заболеваемости последнего десятилетия в России свидетельствует о неуклонном росте рака эндометрия (РЭ). Заболеваемость раком тела матки занимает второе место среди всех заболеваний репродуктивной системы женщин и по величине показателей прироста колеблется в различных регионах от 4,5 до 22,5 на 100000 женского населения. Частота РЭ резко увеличивается в возрасте после 40 лет [1]. Несмотря на успехи в профилактике РЭ и совершенствование методов диагностики, не возрастает выявляемость ранних форм РЭ, а результаты оценки местного распространения могут трактоваться неоднозначно [2, 3]. Экспертной лучевой технологией в диагностике РЭ является магнитно-резонансная томография (МРТ) [4].
Одним из наиболее распространенных методов обследования при подозрении на РЭ является ультразвуковое исследование (УЗИ) из трансабдоминального и трансвагинального (ТВУЗИ) доступов. При УЗИ органов малого таза всегда учитывают, что вариабельность изображения опухоли эндометрия связано с его размерами и степенью дифференцировки [5, 6].
У больных с диагнозом РЭ при УЗИ в В-режиме определяют локализацию и размеры первичной опухоли, оценивают ее форму, структуру и глубину инвазии с характеристикой степени местного распространения опухоли [7].
В онкогинекологии широко применяется допплерометрия сосудов малого таза с анализом кривых скоростей кровотока. В уточняющей диагностике РЭ, возможно в одном исследовании расширенное использование новых ультразвуковых методик, включающих цветовое допплеровское картирование (ЦДК), энергетическое картирование (ЭК), 3D-визуализацию, соноэластографию (СЭ) и исследование с контрастным усилением [8, 9, 10]. Данные исследования обеспечивают неинвазивную оценку сосудистого русла тела матки и опухолевого узла. Установлено, что вероятность рака эндометрия значительно возрастает, если у пациенток в постменопаузальном периоде помимо увеличения толщины, изменения структуры эндометрия, выявляются зоны повышенной васкуляризации с низкими значениями индекса резистентности и высокими значениями пиковой систолической скорости [11, 12]. Наиболее перспективной методикой визуализации всей сосудистой системы является трехмерная реконструкция органов в ангио-режимах, которая обеспечивает более точное определение степени васкуляризации органа и патологически измененных тканей [13].
На сегодняшний день доступна ультразвуковая методика анализа механических свойств тканей - ультразвуковая эластография. В большинстве случаев, вне зависимости от локализации новообразования характеризуются высокой степенью жесткости. Применительно к РЭ соноэластография может наглядно демонстрировать опухолевую ткань и инфильтрацию, что способствует повышению информативности УЗИ в дифференциальной диагностике опухолевых и воспалительных процессов [14].
Всё большую популярность приобретает новый метод контрастно-усиленного ультразвукового исследования (КУУЗИ). В отличие от допплерографии, КУУЗИ обеспечивает визуализацию сосудов любого калибра, независимо от скорости и направления кровотока, что дает дополнительную информацию об особенностях гемодинамики в зоне интереса [15, 16].
Проведение у больных РЭ комплексного УЗИ с применением современных методик позволит всесторонне оценить параметры опухолевого процесса и прогнозировать течение заболевания. Необходимо учитывать, что до настоящего времени не представлено четкой методики оценки характеристик кровотока при новообразованиях, не изучены возможности КУУЗИ и не установлены эффективные значения плотностей тканей, позволяющих уточнять степень инвазивного роста. Результаты исследования могут быть использованы при динамическом наблюдении за пациентками в процессе лечения.
Материал и методы исследования. Комплексное ультразвуковое обследование выполнено 28 пациенткам с установленным диагнозом рака эндометрия в возрасте от 43 до 81 лет (средний возраст 58±3,6). В менопаузальном периоде находилось 23 (80,4%) пациентки, в репродуктивном периоде 5 (19,5%) пациенток. Диагноз РЭ был верифицирован при морфологическом и гистопатологическом исследовании. Все больные были обследованы ультразвуковым методом в В-режиме, с использованием трансабдоминального (датчиком 3,5 МГц) и трансвагинального (датчиком 6,5 - 7,5 МГц) доступов на современных цифровых аппаратах ACUSON S2000 фирмы SIEMENS и «Aixplorer» фирмы «SuperSonicImagine S.A.» (Франция).
В протокол ультразвукового исследования входила допплерометрия маточных сосудов, ЦДК и ЭДК, с последующей трехмерной реконструкцией изображений, СЭ выделенных зон нормального миометрия и опухолевой ткани, а также исследование матки с контрастным усилением.
При исследовании в В-режиме определяли ширину М-эхо, линейные и объемные параметры матки и опухоли. Рассчитывали индекс инвазивного роста (ИИР) по отношению объема измененного эндометрия (ОИЭ) к объему тела матки (ОМ). Особое внимание уделяли оценке глубины миометриальной инвазии, возможному переходу злокачественного процесса на цервикальный канал и состоянию регионарных лимфатических узлов, что имело решающее значение в определении стадии заболевания.
Допплеровский анализ при ТВУЗИ включал оценку максимальной скорости артериального кровотока в маточных артериях и внутриопухолевых сосудах, а также наименьшего и среднего индекса резистентности. Для маточных артерий использовали частотный фильтр 100 и 50 Гц.
Для качественной характеристики интенсивности артериального и венозного миометриального и внутриопухолевого кровотока в режимах ЦДК и ЭК определяли количество лоцируемых цветовых сигналов от сосудов матки и опухоли. Выделяли: гиповаскулярный, умеренно васкулярный, гиперваскулярный типы кровоснабжения.
СЭ в режиме сдвиговой волны осуществляли по качественным и количественным характеристикам. Для оценки изображения выделяли окрашивание от равномерного синего (низкие значения плотности характерные для нормальных тканей), до равномерного интенсивного окрашивания в красный цвет (высокие значения плотности характерные для опухолевой ткани). Выделяли и третий тип - мозаичное окрашивание с преобладанием участков красного цвета. Для количественной характеристики в автоматическом режиме измеряли минимальные, средние и максимальные значения упругости выделенных зон, которые сравнивали с показателями упругости референсных зон.
КУУЗИ выполняли посредством внутривенного введения 2,0-2,5 мл контрастного препарата второго поколения, представляющего собой суспензию микропузырьков гексафторида серы в оболочке из фосфолипидов. В процессе динамического исследования использовали программы Cadence contrast pulse sequencing technologye Sie Touch иVirtual Touch (ARFI) | Virtual Touche Sie Calc.
На всех этапах исследования оценивали состояние структуры эндо- и миометрия, их однородность. При выявлении очаговых изменений определяли их размеры, степень распространенности и взаимоотношение с окружающими структурами, проводили сравнительную оценку толщины маточной стенки в зоне локализации опухолевого очага. Важнейшей характеристикой новообразования являлась степень и характер его васкуляризации, которую определяли при УЗ-ангиографии. Кровоснабжение опухоли оценивали в режиме реального времени или при ретроспективном анализе, при пошаговых поворотах или в кино-петле. Полученные данные сравнивали с результатами морфологических исследований. На основании полученных данных устанавливали стадию заболевания согласно Международной классификации рака (FIGO 2009).
Результаты и их обсуждение. В результате выполненного морфологического исследования аденокарцинома эндометрия диагностирована у 25(89,3%) пациенток, в двух случаях - аденоакантома, у одной больной - плоскоклеточный рак и в одном случае - сочетание аденокарциномы и эндометриальной стромальной саркомы у больной со II стадией заболевания. В 20(71,4%) случаях рак эндометрия был диагностирован в I стадии заболевания. II стадия была диагностирована у 4(14,9%) пациенток. III стадия заболевания диагностирована у 4(14,9%) женщин старшей возрастной группы в менопаузе.
У больных с верифицированным диагнозом РЭ в процессе УЗИ определяли локализацию и размеры первичной опухоли, оценивали ее форму, структуру и глубину инвазии, что позволяло оценить степень местного распространения опухоли. Для большинства больных характерным являлась локализация процесса в области дна матки либо одного из трубных углов. Некроз опухоли с деформацией полости матки и наличием в ней жидкости определялись при II и III стадии процесса. Вариабельность получаемого ультразвукового изображения злокачественного новообразования эндометрия была обусловлена ее размерами и степенью дифференцировки. Во всех случаях при размере М-эхо до 15 мм структура эндометрия определялась гиперэхогенной, а при увеличении до 20 мм и более она становилась гетерогенной. При размерах более 30 мм преобладала изоэхогенная или смешанная структура эндометрия. Эхогенность злокачественной опухоли эндометрия зависела от её морфологического типа. Для высоко- и умеренно-дифференцированной аденокарциномы была характерна гиперэхогенная структура, в то время как для низкодифференцированного рака более специфичны отражения средней и пониженной эхогенности или неоднородная, смешанная структура.
Относительную количественную оценку первичной опухоли определяли по отношению объема тела матки к объему измененного эндометрия используя индекс инвазивного роста (ИИР) (рис. 1 а, б).
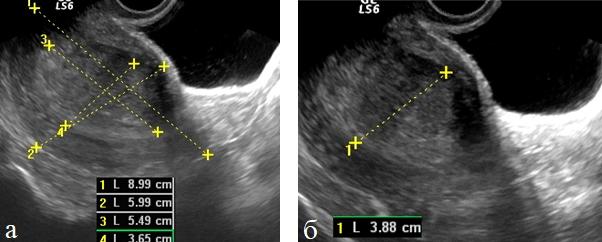
Рис. 1 (а, б). ТВУЗИ. Определение индекса инвазивного роста у больных раком эндометрия.
Объем тела матки и объем эндометрия рассчитывался по стандартной формуле. Данные о толщине М-эхо, объеме тела матки, объеме эндометрия и результаты расчета индекса инвазивного роста при разных стадиях заболевания представлен в табл. 1.
Таблица 1. Данные о толщине М-эхо и результаты расчета индекса инвазивного роста при разных стадиях заболевания
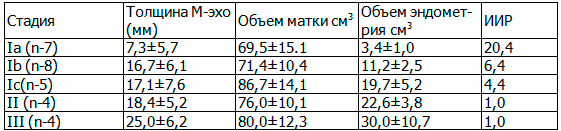
В результате выполненного исследования установлено увеличение толщины М-эхо в начальных стадиях заболевания до 15,0±6,7. Ia стадия заболевания без инвазии в миометрий установлена у 7(25,0%) обследованных. При Iа стадии - толщина М-эхо составила 7,3±5,7 мм, при Ib стадии - 16,7±6,1 мм, при Ic - 17,1±7,6мм. При II стадии - 18,4±5,2мм и при III стадии - 25,0±6,2 мм. Больных с IV стадией заболевания в нашем исследовании не было. Миометриальная инвазия диагностирована у 8(16,7%) больных с Ib стадией. Инфильтративное распространение опухоли на цервикальный канал выявлено у 15(53,6%) больных с Ic стадией заболевания. Патологическое новообразование эндометрия с экзофитным ростом, занимающее определенные сегменты или всю полость определялось у 22(78,5%) пациенток в Ic-III стадиях заболевания. При Tla стадии объем эндометрия составил 3,4±1,0см3, индекс инвазивного роста -20,4, при TIb стадии объем измененного эндометрия-11,2±2,5см3, ИИР -6,4, при Ic стадии ОИЭ-19,7±5,2 см3, ИИР - 4,4±2,6.У пациенток со IIстадией заболевания ОИЭ составил 22,6±3,8см3, а ИИР был равен 1,0. Как показывают приведенные данные, по мере нарастания степени инвазии опухоли в миометрий, отмечалось закономерное увеличение объема измененного эндометрия и увеличение индекса инвазивного роста.
При УЗИ больных раком эндометрия в Iа стадии структура срединного маточного эхо лоцировалась как однородная гиперэхогенная, границы эндометрия в 80% случаев определялись как четкие, с ровными контурами, с отчетливо определяемым гипоэхогенным ободком, при этом ультразвуковая картина не отличалась от нормы. Однако в трех случаях исследование в режиме серой шкалы с последующей трехмерной реконструкцией изображений позволяло выявить начальные признаки микромиометриальной инвазии, не превышающие по глубине 0,5 мм, в виде очага утолщенного эндометрия повышенной эхогенности с нечетким наружным контуром. Выявлялась неоднородность структуры эндометрия за счет включений округлой формы, повышенной эхогенности, средний размер которых составлял 6,3±3,8 мм. В одном из этих наблюдений определялось точечное усиление кровотока в прилежащих отделах миометрия. У большинства больных РЭ при толщине М-эхо более 15 мм, когда миометриальная инфильтрация превышала 5,0 мм ведущими УЗ-признаками злокачественного поражения являлось отсутствие четкой границы и неровность контура между измененным эндометрием и миометрием, наблюдаемое у 22 (78,6%) больных. В 42,9% наблюдений структура опухоли однородная и гиперэхогенная, в 6(21,4%) - однородная гипоэхогенная, а в 10(35,7%) - неоднородная гиперэхогенная за счет включений пониженной эхогенности.
При глубоком инфильтративном процессе толщина М-эхо в среднем составляла 24,0±12,5мм. Границы между опухолью и миометрием были нечеткие, контуры неровные, а у 20 (71,4%) пациенток, в 13 (46,4%) - определялась смешанная структура опухоли.
У всех обследованных проведена оценка показателей гемодинамики в маточных артериях и сосудах опухоли. В таблице 2 приведена сравнительная характеристика допплерометрических показателей злокачественной патологии эндометрия в сравнении с нормой.
Таблица 2. Гемодинамические показатели кровотока в маточных артериях в норме и при раке эндометрия
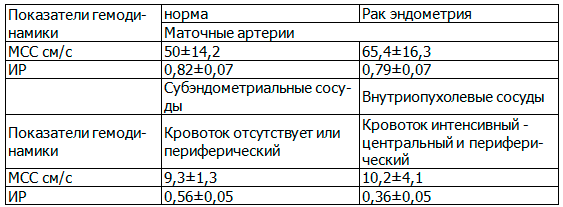
Результаты спектральной допплерометрии у здоровых женщин в менопаузальном периоде в маточных артериях показали, что средние значения кровотока в них не превышали 70,0см/с, а средние значения индекса резистентности 0,82±0,07. Скорость кровотока в выявляемых артериях субэндометриальной зоны были в пределах 10 см/с. В результате выполненной допплерометрии у больных РЭ получены значения количественных показателей гемодинамики: максимальная скорость кровотока в маточных артериях составили 65,4±16,3см/с, в опухоли - 10,2см/с±4,1см/с, (колебания 3-20 см/с), индекс резистентности - 0,56±0,05 и 0,36±0,05 соответственно. Достоверных различий в уровнях максимальной скорости артериального кровотока в норме и при раке эндометрия в наших исследованиях не установлено. Однако показано, что вне зависимости от гистотипа опухоли при раке эндометрия наблюдался внутриопухолевый кровоток с низкими показателями индекса резистентности. Более высокой стадии процесса соответствовала большая максимальная скорость кровотока при более низком индексе периферического сопротивления. Гемодинамика регионарного кровотока при раке эндометрия со значительным увеличением скоростных показателей сосудистого русла матки и выраженным снижением индекса периферического сопротивления в опухолевых сосудах может служить объективным показателем активности патологического процесса.
Степень дифференцировки опухоли коррелировала со стадией заболевания: высоко дифференцированный процесс ограничивался телом матки. Умеренно дифференцированная аденокарцинома чаще отмечалась при II и III стадиях с распространением опухоли на цервикальный канал. Сопоставление стадии заболевания и гистотипа представлено в табл. 3.
Таблица 3. Сопоставление гистотипа и стадии рака эндометрия
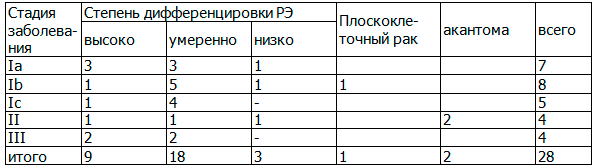
Выделяли три основных типа роста инвазивного рака эндометрия, которые возможно дифференцировать в начальных стадиях заболевания: развитие множественных высокодифференцированных опухолевых очагов на фоне гиперпластических процессов эндометрия, развитие одного высокодифференцированного опухолевого очага, окруженного гиперплазированной слизистой на небольшом протяжении, развитие одного умеренно- или низкодифференцированного опухолевого очага на фоне атрофии слизистой. Высоко и умеренно дифференцированная аденокарцинома в основном диагностирована при Ia и Ib стадиях заболевания. Умеренно и низко дифференцированная аденокарцинома чаще определялась при Iс и III стадиях и при распространении опухоли на цервикальный канал. В двух наблюдениях диагностированная акантома эндометрия сочеталась с низкодифференцированной аденокарциномой. Характер и степень васкуляризации опухоли оценивали с помощью режимов ЦДК, ЭДК и трехмерной ангиографии. При сопоставлении допплерографической картины со стадиями и формами опухолевого роста при РЭ были установлены различные варианты допплерограмм. При анализе характера и степени кровоснабжения опухоли, оцененной с помощью режимов ЦДК и ЭДК выделяли различные варианты интра- и эндометриального кровотока. (рис. 2 а, б).
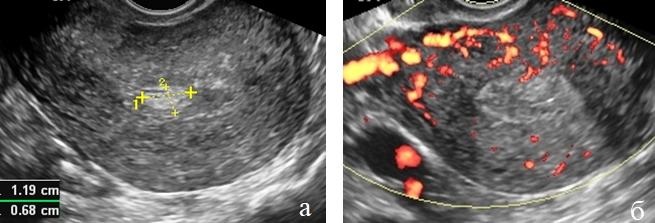
Рис. 2 (а, б). ТВУЗИ а) режим серой шкалы б) энергетическое картирование. Рак эндометрия I стадии. Утолщение эндометрия без четких контуров. Отчетливое нарушение миометриального кровотока.
Выполненное исследование позволило выявить определенную зависимость между характером васкуляризации, стадией заболевания и формой опухолевого роста (рис. 3 а, б).
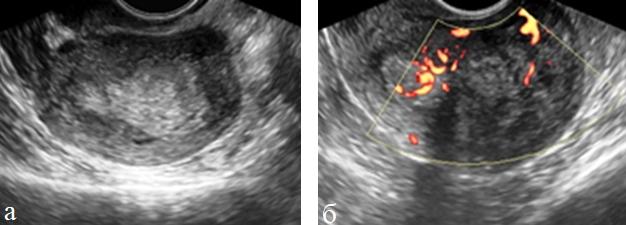
Рис. 3 (а, б). ТВУЗИ а) режим серой шкалы б) энергетическое картирование. Рак эндометрия III стадии. Эндометрий резко утолщен, неоднороден. Определяется внутриопухолевый кровоток и усиление эндометриального кровотока.
Допплеровское картирование показало, что для экзофитной формы роста характерен интенсивный внутриопухолевый кровоток в сочетании неоваскуляризацией и неравномерным распределением сосудов в эндометрии. Подобный интраопухолевый тип неоваскуляризации был выявлен у 8 (28,6%) больных. При эндофитной и смешанной форме РЭ у 12(42,9%) определялась умеренная васкуляризация опухоли, сочетающаяся с усиленной васкуляризацией миометрия и интенсивным интра- и периопухолевым кровотоком. В наших наблюдениях дифференцировать развитие опухолевого процесса из множественных первичных очагов было возможно только у одной пациентки на фоне атрофии слизистой. В других случаях со значительным местным распространением опухоли, возможно существующие множественные высокодифференцированные очаги не определялись. Экзофитная форма роста диагностирована в 30% случаях. В 70% наблюдений отмечалась эндофитная или смешанная форма роста с инвазией в миометрий. Во всех случаях УЗИ дополненное методикой цветовой допплерографии по степени кровоснабжения и характеру распределения кровотока в миометрии несло важную дополнительную информацию, позволяющие характеризовать структуру опухоли. Методикой цветовой допплерографии регистрировали миометриальный и внутриопухолевый кровоток (рис. 4 а, б).
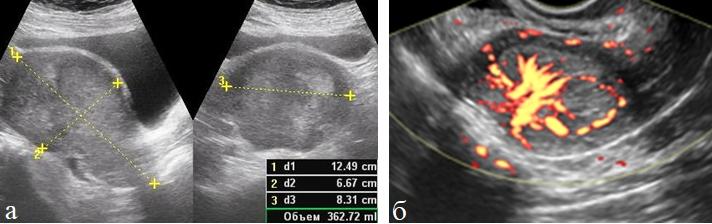
Рис. 4 (а, б). ТВУЗИ а) режим серой шкалы; б) энергетическое картирование. Акантома матки. Отчетливое нарушение внутриорганного кровотока, гиперваскуляризация опухоли.
Трехмерная реконструкция ультразвуковых изображений, выполненная при совмещении режимов серой шкалы и цветового или энергетического картирования, а также режим ангио программы позволяла получать изображения наибольшей наглядности опухоли и сосудов и объективно оценивать характер кровоснабжения матки и опухоли. Патологическая васкуляризация не была выявлена у 8(28,6%) пациенток с установленным РЭ (рис. 5 а, б).
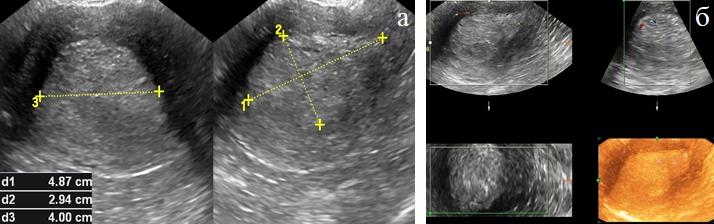
Рис. 5 (а, б). ТВУЗИ а) режим серой шкалы; б) этапы реконструкции трехмерных изображений.
Причиной этого было удаление опухоли малых размеров при аденокарциноме Ia стадии в результате предварительного диагностического выскабливания полости матки, а также в одном случае при аденоакантоме, когда злокачественный процесс развивался на фоне атрофии эндометрия. Аваскулярный или незначительно выраженный кровоток в эндометрии в сочетании с низкими цифрами периферического сопротивления наблюдался у 4(8,2%) больных с высоко дифференцированной аденокарциномой IIстадии. Из числа обследованных, у 21(75,0%) больных была диагностирована патологическая сосудистая сеть неоваскуляризации. Отчетливый внутриопухолевый кровоток визуализировался в 14(50,0%) наблюдении включая 4 случая акантом. Цветовое допплеровское картирование у большинства больных, даже в случаях аваскулярных новообразованиях позволяло выявлять дезорганизованный сосудистый рисунок кровоснабжения миометрия. При этом у 4 из 7 больных с Ia стадией заболевания изменения характера васкуляризации были единственными УЗ-признаками опухолевого поражения (рис. 6 а, б).
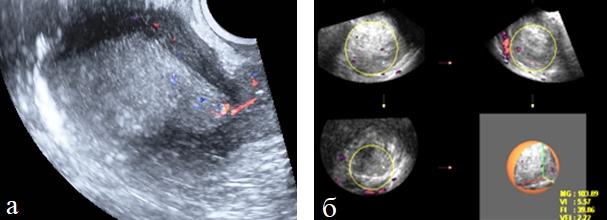
Рис. 6 (а, б). а) Трехмерное изображение тела матки в режиме максимальной прозрачности при раке эндометрия; б) оценка индекса васкуляризации.
Удовлетворительные результаты эластографии были получены у 24(86%) пациенток, при этом у 12 применялся внутриполостной датчик, у 16 - конвексный. Для трактовки результатов эластографии качественных и количественных характеристики патологического образования сравнивали с миометрием, а в случаях экзофитного роста опухоли с зонами неизмененного эндометрия. Средние показатели эластичности миометрия и неизмененного эндометрия находились в интервалах 11,4±5,5 и 13,3±9,3, соответственно. Средние показатели жесткости при раке эндометрия составили 182,9±80 кПа (рис. 7).
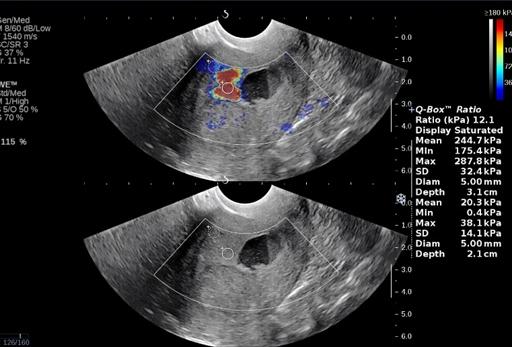
Рис. 7. Соноэластография. Средние значения жесткости 175 kPa.
Полученные значения жесткости референсных зон и опухоли представлены в табл. 4.
Таблица 4. Показатели соноэластографии миометрия, неизмененного эндометрия и опухоли

Примечание: сопоставление частотных характеристик количественных показателей плотностей тканей нормального миометрия, неизмененного эндометрия и рака эндометрия, выраженных в килопаскалях проводилось с помощью непараметрических методов χ2 с поправкой Йетса (для малых групп), критерия Фишера.
При анализе средних показателей эластографии опухоли при РЭ очевидно их значительное повышение по сравнению с референсными зонами, что указывает на выраженное изменение механических свойств тканей и является признаком злокачественности поражения. Для высоко- и умеренно-дифференцированной аденокарциномы характерна более жесткая структура ткани, в то время как для низкодифференцированного рака более специфичны отражения средней и пониженной интенсивности или неоднородная, смешанная структура. При этом не было выявлено достоверных различий показателей плотности в зависимости от гистологической формы опухоли.
Контрастно усиленное УЗИ было выполнено у 20 пациенток. При внутривенном введении 2,5 мл микропузырькового контрастного вещества, контрастирование органов малого таза наступало через 10-15 секунд и продолжалось до 30-45 с усилением контрастирования. В режиме реального времени определялось начало поступления препарата, которое начиналось с периферии и в течение 10 секунд достигало до максимальных значений в опухоли (рис. 8 а, б).
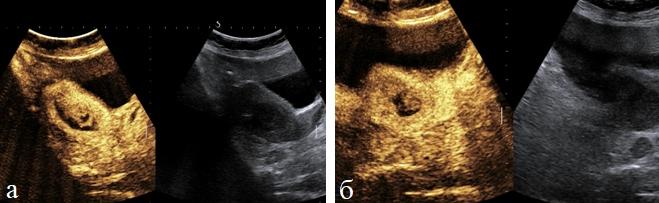
Рис. 8 (а, б). Контрастная сонография. Интенсивное накопление контрастного вещества в эндометрии на 15 секунде после ведения препарата.
Венозная фаза начиналась с 30-45 секунды, в течение которой усиление сначала показывает плато, затем медленно снижалось. В паренхиматозную фазу определялось более интенсивное накопление контрастного вещества в опухоли, а в дальнейшем быстрое его вымывание, начиная с центральных отделов опухоли. Во всех случаях граница миометриальной инвазии отчетливо не определялась. При распространенных процессах в стадиях Ib-II, накопление опухолью контрастного вещества, как и отдельных зон неизмененного миометрия определялось как неравномерное. Результаты КУУЗИ позволили в двух случаях уточнить стадию заболевания с переводом стадии Ia в стадию Ib.
Сопоставление результатов комплексного УЗИ с данными морфологических исследований показало их высокое совпадение в определении степени миометриальной инвазии, по характеру и объему поражения.
Выводы. Основными ультразвуковыми признаками рака тела матки в режиме В-сканирования можно считать: неоднородность структуры и повышение эхогенности эндометрия, наличие неровного его внешнего контура, отсутствие визуализации гипоэхогенного ободка, а при значительном местном распространении - отсутствие четкой границы между опухолевым очагом и миометрием. Основные трудности ультразвукового метода в уточняющей диагностике начальных стадий заболевания связаны с его ограниченными возможностями оценки поражений, не превышающих 5мм, а также при определении объема опухоли у женщин с большими и множественными фибромиомными узлами или при аденомиозе. Внедрение в клиническую практику новых ультразвуковых технологий позволяет проводить диагностику и дифференциальную диагностику рака эндометрия с всесторонней оценкой основных характеристик диагностического процесса. Каждая из использованных современных ультразвуковых методик, импульсная допплерометрия, допплерография, соноэластография и контрастная сонография, вносит свой вклад в оценку новообразования и окружающих тканей.
Полученные результаты свидетельствуют о высокой эффективности использованного диагностического комплекса в выявлении характерных особенностей внутриорганного и опухолевого кровотока, а также жесткости тканей, играющих важную роль в уточнении стадии и прогнозе заболевания.
