Хронический простатит (ХП) в структуре урологической патологии занимает 45-85% [4,12,13], в 35-63% случаев вызывая эректильную дисфункцию (ЭД) [2,4,8]. При ХП нарушается анатомо-функциональное состояние предстательной железы (ПЖ), методы диагностики которого окончательно не разработаны и носят отрывочный характер [14,10]. Одни исследователи считают [1,3], что для диагностики анатомо-функциональных изменений ПЖ достаточно проведения трансректального ультразвукового исследования (ТРУЗИ), другие указывают на обязательное исследование гемодинамики ПЖ, третьи – рекомендуют проводить исследование гемодинамики и микроциркуляции с окружающими тканями [4,5].
Поэтому с целью изучения функционального состоянии ПЖ у больных ХП с ЭД следует исследовать структурные изменения ПЖ, ее гемодинамику и микроциркуляцию, функциональное состояние окружающих ее тканей. Литературные данные о функциональном состоянии ПЖ у больных ХП с ЭД не изучены, что и явилось целью настоящего исследования.
Цель исследования: изучение структуры, гемодинамики и микроциркуляторного русла ПЖ и окружающих тканей у больных ХП с ЭД.
Материалы и методы. Под нашим наблюдением находилось 160 больных ХП в возрасте от 23 до 45 лет (в среднем 32,7±1,4 года) с длительностью ХП от 1 года до 9 лет (в среднем 4,3±1,2 года). Контрольную группу составили 20 здоровых мужчин в возрасте от 23 до 45 лет (в среднем 32,6±1,3 года).
ТРУЗИ ПЖ выполнялось на аппарате «Aloka 2000» (Япония). В спектральном режиме цветного допплеровского картирования изучали характер кровообращения в сосудах ПЖ, скорость венозного оттока в венах парапростатической и параректальной клетчатки. При допплерографии оценивались максимальная систолическая скорость кровотока (Vmax), минимальная диастолическая скорость кровотока (Vmin), пульсационный индекс (JP) и индекс резистентности (IR). Для изучения стадии тумесценции гемодинамики ПЖ интракавернозно вводили 10 мкг каверджекта с последующей видеоассоциативной сексуальной стимуляцией.
Оценку микроциркуляции проводили методом лазерной допплеровской флоуметрии (ЛДФ) с использованием лазерного анализатора микроциркуляции крови «ЛАКК-02» (Россия). Микроциркуляцию в уретре изучали с помощью эндоскопического зонда для эндоуретрального исследования микроциркуляции, микроциркуляцию ПЖ - с помощью накожного зонда в точке J1 (хуэй-инь), имеющую хорошее кровоснабжение в связи с анатомическим расположением сосудистого пучка. С помощью программного обеспечения производилась обработка кривых после каждого исследования.
Коэффициент вариации (Кv) указывает на процентный вклад вазомоторного компонента в общую модуляцию тканевого кровотока, определяется по формуле: Кv = δ / Мх100%, где δ – среднеквадратичное отклонение амплитуды колебаний кровотока от величины М, отражающее усредненную временную колеблемость микроциркуляторного потока, или флакса.
Амплитудно-частотные составляющие (АЧС) ЛДФ-граммы - ритмичные составляющие флаксомоций, которые характеризуются амплитудой (А) и частотой флакса (F).
Формула, отражающая активный механизм регуляции микроциркуляции: Amax LF/3 δ x 100%, где Аmax LF – амплитуда медленных колебаний, обусловленная вазомоторной активностью.
Формула, отражающая пассивный механизм регуляции микроциркуляции: Amax HF/3 δ x 100%, где Аmax HF – амплитуда дыхательных колебаний, связанная с дополнительным включением механизмов активации крови из микроциркуляторного русла за счет дыхательных экскурсий (в норме они выражены слабо).
Формула, характеризующая внутрисосудистое сопротивление:
Аmax/ M х 100%.
Нейрогенный тонус (НТ) прекапиллярных резистентных микрососудов связан с активностью α-адренорецепторов ( в основном α1) мембраны ключевых и отчасти сопряженных гладкомышечных клеток, определяется по формуле: HT= δxPср/Ан х М, где Рср – среднее артериальное давление, Ан - наибольшее значение амплитуды колебаний перфузии в нейрогенном диапазоне.
Миогенный тонус (МТ), отражающий состояние метартериол и прекапиллярных сфинктеров, определяется по формуле: МТ=δ х Рср/Ам х М, где Ам – амплитуда осцилляции миогенного диапазона.
Показатель шунтирования (ПШ) вычисляется по формуле: ПШ=МТ/НТ.
Индекс эффективности микроциркуляции (ИЭМ) характеризует взаимоотношения между колебаниями кровотока в разных областях частотного спектра, определяется по формуле: ИЭМ=АmaxLF/(AmaxHF+AmaxCF).
Выполнялись телевидеомикроскопические исследования нативного препарата секрета ПЖ.
Результаты исследования. Обострения ХП до 1 раза в год были у 92 (57,5%), 2-3 раза - у 32 (20%) больных. Обострений ХП не было у 36 (22,5%) больных. Все больные в той или иной степени предъявляли жалобы на боль тянущего, ноющего характера в низу живота, пояснично-крестцовой области, дискомфорт в промежности, дизурию, ЭД и психо-эмоциональные нарушения. Пальцевое ректальное исследование у 132 (82,5%) больных выявило увеличение ПЖ, у 104 (65%) – снижение ее тонуса, у 67 (41,9%) – уплотнения и «западения» в ткани железы, что давало основание предполагать наличие ранее перенесенных очаговых воспалительных процессов [3], у 29 (18,1%) – тестоватую консистенцию ПЖ. Болезненность при пальпации ПЖ отмечалась у 105 (65,6%) больных, сглаженность междолевой бороздки – у 45 (28,1%).
При видеомикроскопии содержание лейкоцитов от 0 до 10 в полях зрения в нативном препарате секрета ПЖ выявлено у 98 (61,3%), от 11 до 20 – у 35 (21,9%) больных, что свидетельствовало о нарушении оттока секрета из плохо функционирующих желез-ацинусов из-за снижения артериального и венозного кровотока в ПЖ после перенесенного воспалительного процесса. У 21 (13%) больного содержание лейкоцитов было от 21 до 40 в полях зрения, у 6 (3,8%) – свыше 40 лейкоцитов, что могло явиться морфологической предпосылкой к вазоконгестивным процессам в ПЖ и вызвать на фоне конгестии ее инфицирование. У 98 (61,3%) больных выявлено снижение количества лецитиновых зерен.
При ТРУЗИ у 124 (77,5%) больных выявлены увеличение размеров ПЖ, у 27 (16,9%) – нормальные размеры ПЖ и у 9 (5,6%) – уменьшение размеров ПЖ. Нормальные размеры ПЖ выявлены у больных с длительностью ХП не более 5 лет и обострениями ХП до 1 раза в год, а уменьшение размеров ПЖ – с длительным (более 5 лет) и обострениями ХП 2-3 раза в год (табл. 1).
Таблица 1. Зависимость частоты нарушения геометрии предстательной железы у больных хроническим простатитом от длительности заболевания (в %) по данным ТРУЗИ
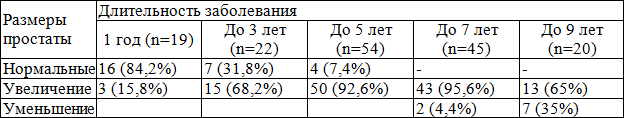
Из табл. 1 следует, что по мере длительности ХП уменьшается число больных с нормальными размерами ПЖ (r=0,71, p<0,05). Что касается взаимосвязи увеличенных размеров ПЖ и длительности ХП, то при длительности ХП до 7 лет выявлена высокая корреляция между изучаемыми показателями, что подтверждается нарастанием частоты увеличения размеров ПЖ от 15,8% при длительности заболевания до 1 года до 95,6% у больных с длительностью ХП до 7 лет (r=0,68, р<0,001). Увеличение размеров ПЖ у пациентов с длительностью ХП до 9 лет наблюдалось достоверно реже по сравнению с больными с длительностью ХП до 7 лет (65% и 95,6%, соответственно), т.е. определялась обратная корреляция (r=0,67, p<0,05). Уменьшение размеров ПЖ выявлялось и нарастало среди больных с длительностью ХП от 7 лет и выше (4,4% и 35% соответственно). Следовательно, изменение размеров ПЖ – одного из основных показателей нарушения ее геометрии, наблюдалось у 133 (83,1%) больных ХП. Объем ПЖ у больных в среднем составил 34,7±2,3 см3, что в 1,6 раза больше по сравнению с нормой (21,9±1,2 см3, р<0,05).
В связи с преобладанием увеличения ПЖ в структуре нарушений геометрии у больных ХП представляло интерес изучить, при какой длительности ХП возникает наиболее выраженное увеличение размеров ПЖ (табл. 2).
Из табл. 2 следует, что отмечается достоверная взаимосвязь увеличения размеров ПЖ от длительности ХП. Обращает на себя внимание, что при длительности ХП от 3 до 5 лет отмечалось резко выраженное достоверное увеличение размеров и объема ПЖ, которое не наблюдалось в другой период длительности ХП и, по всей видимости, связано с более выраженной дисциркуляцией и развитием вазоконгестивных явлений [6,10,14]. Наряду с изменением размеров ПЖ у больных ХП при ТРУЗИ выявлялись признаки нарушения структуры, связанные с изменением паренхимы простаты (табл. 3).
Таблица 2. Зависимость нарушения геометрии предстательной железы у больных хроническим простатитом от длительности заболевания (по результатам ТРУЗИ)
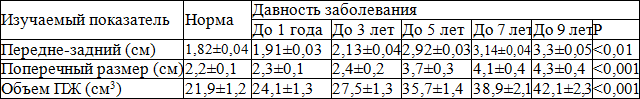
Таблица 3. Ультразвуковые признаки нарушения структуры предстательной железы у больных хроническим простатитом

При ТРУЗИ простаты у 89 (55,6%) больных ХП наблюдалась диффузная неоднородность структуры («мелкосотовый рисунок») в виде чередования гипо- и гиперэхогенных участков, что связано с нарушением кровоснабжения простаты, развитием вазоконгестивных явлений, перерастяжением ацинусов застойным секретом, вследствие нарушения оттока из склерозированных протоков (нарушение дренажной функции ПЖ) [2,6,10,12,14]. Выраженность «мелкосотового рисунка» прямо пропорциональна степени выраженности вазоконгестивных явлений (r=0,89, р<0,05). Как правило, данный рисунок начинает появляться в боковых отделах периферической части ПЖ, распространяясь к центральным отделам, постепенно захватывая все большие участки железы. Участки с равномерной гипо- и гиперэхогенностью встречались в 7,5% и 20% соответственно. Эхогенность периферической зоны ПЖ была диффузно неоднородной у 121 (75,6%) больного. Кроме того, у 81 (50,6%) больного встречались единичные или множественные мелкие кальцинаты, у 28 (17,5%) - ретенционные кисты в ПЖ.
По современным представлениям несомненным условием развития ХП является нарушение локальной гемоциркуляции в ПЖ. При допплерометрическом исследовании у больных ХП в фазу релаксации Vmax снижена в 1,26, Vmin – в 1,83, IP – в 1,13, диаметр сосудов - в 1,23, плотность сосудистого сплетения (ПСС) в 1,5, IR – повышен в 1,2 раза по сравнению со здоровыми (табл. 4).
Гемодинамические нарушения ПЖ у больных ХП наблюдались как при нормальных, так и увеличенных размерах ПЖ (табл. 5). Однако, гемодинамические нарушения ПЖ были выражены достоверно больше у больных с увеличенными размерами ПЖ. Так, у больных ХП с нормальными размерами ПЖ Vmax, Vmin, диаметр сосудов и ПСС были достоверно снижены в 1,16, 1,44, 1,11 и 1,43 раза соответственно, у больных ХП с увеличенными размерами ПЖ Vmax, Vmin, диаметр сосудов и ПСС были достоверно снижены в 1,27, 1,44, 1,26 и 1,88 раза соответственно по сравнению с нормой.
Таблица 4. Показатели гемодинамики предстательной железы в фазу релаксации у больных хроническим простатитом
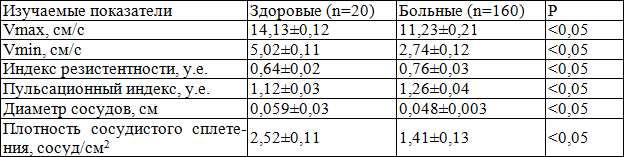
Таблица 5. Допплерометрические показатели предстательной железы в зависимости от ее размеров у больных хроническим простатитом
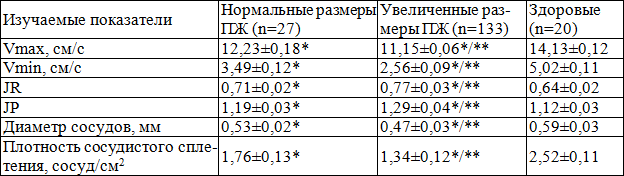
Примечание: * - р<0,05 по сравнению с контрольной группой, ** - р<0,05 по сравнению с группой больных с нормальными размерами ПЖ
Степень увеличения объема ПЖ достоверно зависит от развития вазоконгестивных явлений, о чем свидетельствует однонаправленное снижение Vmin (р<0,001) по мере увеличения объема ПЖ (табл. 6). Расстройство гемоциркуляции по артериальным сосудам (JR и Vmax) не оказывало существенного влияния на увеличение объема ПЖ (р>0,05). Таким образом, по мере длительности ХП усугубляются и утяжеляются нарушения гемодинамики ПЖ, что имеет высокую корреляцию (r=0,92, р<0,05).
При допплеровском исследовании у 144 (90%) больных выявлено нарушение сосудистой архитектоники: у 111 (69,4%) - снижение васкуляризации, у 33 (20,6%) – ее повышение и только у 16 (10%) была нормально выраженная васкуляризация ПЖ. Нами отмечено ослабление васкуляризации несколько чаще в центральной зоне простаты и сохранение ее на периферии.
При допплерометрии выявлено снижение скорости венозного кровотока в ПЖ в 1,21 раза (4,8±0,4 см/с) по сравнению с нормой (5,8±0,2 см/с, р<0,05). Показатели скорости венозного кровотока в ПЖ снижались по мере длительности ХП (табл. 7), что имело высокую корреляцию (r=0,91, р<0,05) и указывало на вазоконгестивный процесс в патогенезе ХП.
Таблица 6. Показатели допплерометрии предстательной железы в зависимости от ее объема у больных хроническим простатитом
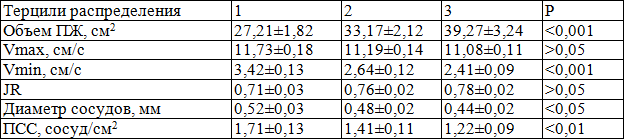
Таблица 7. Зависимость скорости венозного кровотока (см/с) в предстательной железе от длительности хронического простатита
![]()
Примечание: * - р<0,05 по сравнению с нормативными данными. У 143 (89,4%) больных выявлено расширение парапростатических вен в 1,8 раза (4,2±0,2 мм) по сравнению с нормой (2,3±0,2 мм, р<0,05), у 97 (60,6%) – расширение параректальных вен в 1,8 раза (4,1±0,2 мм) по сравнению с нормой (2,3±0,2 мм, р<0,05), что свидетельствует о связях парапростатического венозного сплетения с венами малого таза, о стабильных гемодинамических нарушениях и венозном застое [2,5,6].
При триплексном сканировании ПЖ у 109 (68,1%) больных выявлен низкоскоростной бифазный тип венозного кровотока, у 21 (13,1%) - монофазный и у 30 (18,8%) – кавальный. Данные изменения гемодинамики в венозном русле ПЖ отражают наличие вазоконгестивных явлений, способствующих поддержанию хронического воспаления и провоцирующих рецидивы ХП [6,10].
В фазу эрекции у здоровых мужчин в ПЖ Vmax снижается в 1,83, Vmin – в 1,1, JR – в 1,52, IP – увеличивается в 1,63, ПСС – в 1,13, диаметр сосудов – в 1,1 раза по сравнению с вышеназванными показателями в фазу релаксации, у больных Vmax в фазу эрекции снижается в 1,67, Vmin – в 1,04, IR – в 1,25, IP увеличивается в 1,34, ПСС – в 1,27, диаметр сосудов – в 1,06 раза по сравнению с вышеназванными показателями в фазе релаксации, что показывает снижение гемодинамики, вазоконгестивные явления, снижение тонуса и эластичности сосудов ПЖ у больных ХП (табл. 8). В фазу эрекции Vmax в ПЖ у здоровых снижалась, IP - повышался по сравнению с показателями в фазе релаксации, что могло свидетельствовать об утечке артериальной крови в сосуды полового члена и о связи уретральных и капсулярных артерий ПЖ с кавернозными и дорсальными артериями полового члена, а также о транспорте крови из простаты в сосуды полового члена и малого таза [2,5].
Кровоток по парапростатическому венозному сплетению при пробе Вальсальвы оценивался в баллах от 0 до 2: 0 баллов – отсутствие ретроградного тока, 1 балл – кратковременный ретроградный ток, 2 балла - выраженный ретроградный ток. У больных кровоток по парапростатическому венозному сплетению при пробе Вальсальвы в 0 баллов оценивался у 17 (10,6%), в 1 балл – у 98 (61,3%) и в 2 балла – у 45 (28,1%) больных, у здоровых – у 18 (90%), 2 (10%) и 0 мужчин соответственно, что показывает большой процент (89,4%) ретроградного кровотока по парапростатическому венозному сплетению при пробе Вальсальвы у больных ХП.
Качественные показатели УЗИ с допплерографией ПЖ у больных ХП и здоровых мужчин (табл. 9) оценены полуколичественным способом (в баллах) (M±95% доверительный интервал для долей).
Таблица 8. Показатели гемодинамики предстательной железы в фазу эрекции у больных хроническим простатитом и у здоровых мужчин
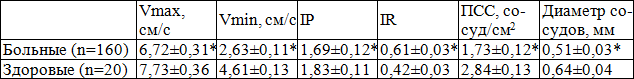
Примечание: * - р<0,05 по сравнению с нормативными данными
Таблица 9. Качественные показатели УЗИ с допплерографией предстательной железы у больных хроническим простатитом и у здоровых мужчин
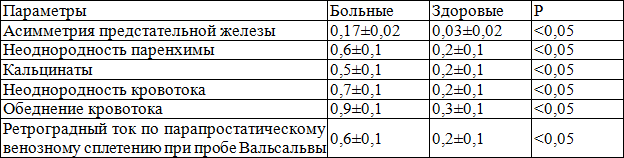
Неоднородность паренхимы ПЖ, кальцинаты, неоднородность и обеднение кровотока, ретроградный кровоток по Санториниеву сплетению при проведении пробы Вальсальвы были у больных ХП в 3, асимметрия ПЖ – в 5,7 раза чаще по сравнению со здоровыми. Высокая частота регистрации ретроградного тока в парапростатическом венозном сплетении с неоднородностью и обеднением кровотока, тазовой вазоконгестией подтверждают значение нарушения микроциркуляции в развитии ХП [2,4-7]. Полученные данные могут свидетельствовать не только о причастности к генезу боли (в том числе за счет индуцированной нарушением микроциркуляции воспалительной реакции), но и указывать на возможный этиологический фактор этого воспаления и связанного с ним болевого синдрома.
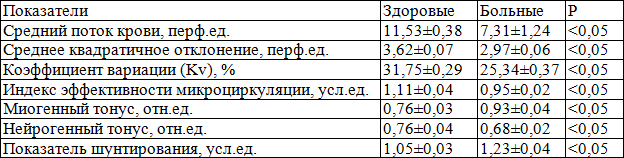
ЛДФ-граммы показали, что в точке проекции ПЖ у больных ХП средний поток крови, среднее квадратичное отклонение, Кv, ИЭМ и НТ снижены в 1,6, 1,2, 1,3, 1,2 и 1,12 раза соответственно по сравнению со здоровыми, МТ и ПШ повышены в 1,2 и 1,17 раза соответственно по сравнению со здоровыми (табл. 10), состояние факторов регуляции кровотока ПЖ показывает преобладание активного механизма микроциркуляции над пассивным в результате усиления симпатической импульсации и кровотока по артериовенулярным шунтам [4].
Таблица 10. Показатели базального кровотока и микрососудистого тонуса в точке проекции предстательной железы у здоровых мужчин и больных хроническим простатитом
ЛДФ-граммы показали, что у больных частота медленных колебаний в точке проекции ПЖ повышена в 1,05 раза, частота дыхательных и кардиальных колебаний снижена в 1,03 и 1,03 раза соответственно, амплитуда медленных и кардиальных колебаний снижена в 1,4 и 2,6 раза соответственно, амплитуда дыхательных колебаний повышена в 1,5 раза, индекс активного механизма регуляции микроциркуляции снижен в 1,6 раза, индекс пассивного механизма регуляции микроциркуляции снижен в 0,86 раза, внутрисосудистое сопротивление повышено в 3 раза по сравнению со здоровыми, что свидетельствует о состоянии вазоконстрикции сосудов микроциркуляции и вазоконгестивных процессов в венулярном звене микроциркуляторного русла [4] (табл. 11).
Таблица 11. Амплитудно-частотный спектр осцилляций кровотока в точке проекции предстательной железы у здоровых мужчин и больных хроническим простатитом
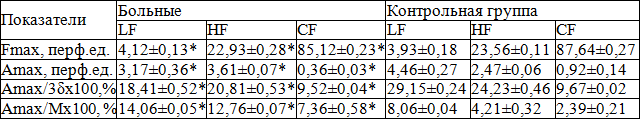
Примечание: * - р<0,05 по сравнению с контрольной группой
У больных средний поток крови в уретре снижен в 1,04, среднее квадратичное отклонение – в 1,5, Кv – в 1,4, ИЭМ – в 1,17, НГ – в 1,1, МТ, ПШ повышены в 1,09 и 1,2 раза соответственно по сравнению с нормой, что свидетельствует о внутрисосудистых нарушениях микроциркуляции в уретре у больных ХП (табл. 12).
У больных ХП амплитуда медленных колебаний снижена в 1,54, амплитуда дыхательных колебаний в 1,2, амплитуда кардиальных колебаний – в 1,3, показатель активного механизма регуляции микроциркуляции – в 0,93, показатель пассивного механизма регуляции микроциркуляции повышен в 1,16, внутрисосудистое сопротивление – в 1,3 раза по сравнению с нормой (табл. 13), что свидетельствует о вазоконстрикции сосудов микроциркуляции и вазоконгесивных процессах в венулярном звене микроциркуляторного русла в уретре у больных ХП [4].
Таблица 12. Показатели базального кровотока и микрососудистого тонуса мочеиспускательного канала у здоровых мужчин и больных хроническим простатитом
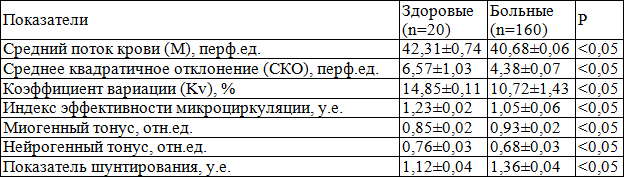
Таблица 13. Амплитудно-частотный спектр осцилляций кровотока уретры у здоровых мужчин и больных хроническим простатитом
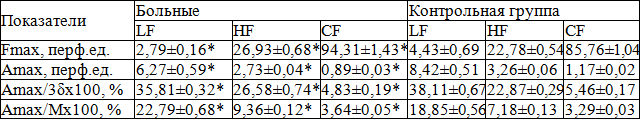
Примечание: * - р<0,05 по сравнению с контрольной группой.
Обсуждение полученных результатов. Анализ количественных характеристик кровотока простаты выявил, что у больных ХП достоверно (р<0,05) нарушена гемодинамика в ПЖ, в большей степени выраженная при увеличении объема ПЖ.
Изучение данных, полученных при сканировании и допплеровском картировании, показало асимметрию ПЖ, неоднородность паренхимы и кровотока, выявление ретроградного тока по венам парапростатического сплетения при пробе Вальсальвы у больных ХП. Высокая частота регистрации ретроградного тока у больных ХП подтверждает значение нарушения микроциркуляции и тазовой вазоконгестии в развитии ХП и обосновывает необходимость включения данного исследования в обязательный алгоритм обследования больных с ХП. Изучение микроциркуляции с помощью ЛДФ в ПЖ и уретре выявило состояние вазоконстрикции сосудов микроциркуляции и вазоконгестивные процессы в венулярном звене микроциркуляторного русла, что является факторами поддержания и развития ХП [4,6-8].
