По данным ряда исследователей [1,2,7,13], хронический простатит (ХП) в 28-37% случаев вызывает бесплодие. Изменения морфологических признаков сперматозоидов у больных ХП проявляются увеличением содержания сперматозоидов с патологией головки, хвоста и шейки [1,11,14]. Нарушения сперматогенеза у больных ХП могут быть причиной мужской инфертильности и аномалий у новорожденных [8,10,11,14]. Для прогнозирования оплодотворяющей способности сперматозоидов проводится анализ их морфологических признаков с использованием строгих критериев нормы, предложенных T.Kruger и соавт. [9]. Однако, качественные, биохимические характеристики эякулята и морфологические особенности сперматозоидов у больных ХП изучены недостаточно.
Цель исследования – изучить качественные, биохимические показатели эякулята и морфологические особенности сперматозоидов у больных ХП.
Материалы и методы. Обследовано 90 больных ХП в возрасте от 22 до 45 лет (в среднем 33,8±1,4 года) с длительностью ХП от 1 до 11 лет (в среднем 4,7±1,2 года), с длительностью бесплодия от 2 до 5 лет (в среднем 3,8±0,7 лет).
Всем пациентам проводилось обследование наружных половых органов, пальцевое исследование предстательной железы (ПЖ) и семенных пузырьков (СП), трансректальное ультразвуковое исследование (ТРУЗИ) ПЖ, ультразвуковое исследование яичек и их придатков, орхидометрия по Прадеру. Изучали индекс образования сперматозоидов (ИОС), который рассчитывали путём деления количества спермы в объёме эякулята (концентрацию сперматозоидов в 1 мл умножают на объём эякулята) на объём яичек, концентрации антиспермальных антител (АСАТ) в сыворотке крови, лактатдегидрогеназы-Х (ЛДГ-Х), кислой фосфатазы (КФ), фруктозы, лимонной кислоты в эякуляте. Исследование эякулята и критерии его классификации осуществляли в соответствии с рекомендациями ВОЗ [15]. Контрольную группу составили 100 здоровых мужчин (не имеющих хронических соматических заболеваний) в возрасте от 23 до 45 лет (в среднем 33,2±1,3 года) с сохранными фертильной (имеющих не менее 2 здоровых детей) и сексуальной функциями (проводящих вагинальные половые акты не менее 2-3 раз в неделю при 70-100% оргастичности у жены).
Эякулят каждого больного исследовали в трех мазках: а) нативном микроскопическом препарате, позволяющем определить количественное содержание и подвижность сперматозоидов; б) в мазках, окрашенных по Фельгену для выявления в клетках дезоксирибонуклеиновой кислоты – ДНК; в наших исследованиях реактив Шиффа, кроме окрашивания ДНК в головках сперматозоидов, позволял оценить состояние эякулята по содержанию слизи, в частности - визуально по количественному наличию в нём мукоидных субстанций, приобретающих в присутствии реактива Шиффа малиново-розовую окраску; в) в мазках, окрашенных по Паппенгейму, рассматривалось общее состояние эякулята и содержащихся в нём сперматозоидов.
Для анализа строения сперматозоидов клетки отделяли от семенной жидкости, наносили тонким слоем на стекло и высушивали. Препараты фиксировали в 70% этаноле в течение 10 мин, после чего высушивали и окрашивали гематоксилином Харриса и бенгальским розовым фирмы “Fisher Scientific”. Анализ структуры клеток проводили при увеличении 1000 (об. 100, ок. 10), анализировали по 200 клеток на каждом препарате. Для морфологически нормального сперматозоида характерна овальная форма головки длиной 5-6 мкм, шириной – 2,5-3,5 мкм, акросомальный участок занимает от 40 до 70% площади головки, при этом отсутствуют аномалии шейки, хвоста, срединное тело не выражено. Пограничные формы, имеющие слегка удлинённую головку диаметром 2-2,5 мкм или небольшие утолщения в области шейки, но хорошо выраженный акросомальный участок, относили к категории аномальных. Особенности строения сперматозоидов, отличающие его от морфологически нормальных, оценивали по классификации T.F.Kruger и соавт. [9]: лёгкая форма патологии головки сперматозоидов, сперматозоиды с неполным развитием акросомы, сперматозоиды с полным отсутствием акросомы, сперматозоиды с аномалиями формы ядра, сперматозоиды с аномалиями хвоста, сперматозоиды с изменённым срединным телом, сперматозоиды с аномальными размерами головки, незрелые формы сперматозоидов, сперматозоиды с другими аномалиями. Кроме определения суммарного количества сперматозоидов с патологией хвоста, учитывали также процентное содержание сперматозоидов с закрученным хвостом и сперматозоидов с другими видами изменений хвоста (сломанный хвост, удвоение хвоста и т. д.). При наличии у сперматозоида нескольких видов изменений его структуры мы относили его к группе с наиболее тяжёлыми повреждениями.
Статистическую обработку материала выполняли с использованием стандартных пакетов программ прикладного статистического анализа (Statgraphics v.7.0, Statistica for Windows v.5.0).
Результаты и обсуждение. Установлено, что ни один из пациентов не подвергался действию гипертермии, промышленных ядов, ионизирующего излучения, не принимал наркотических и гормональных препаратов, не злоупотреблял никотином и алкоголем.
У больных выявлены высокий индекс (2,3±0,3) заболеваний, передающихся половым путём (ЗППП), которые в 56% случаев носили сочетанный характер (хламидиоз+микоплазмоз и т. д.), высокий (6,4±1,3) промискуитетный индекс (количество сексуальных партнёров), высокий инфекционный индекс (3,2±0,3).
При осмотре полового члена, крайней плоти пороков развития выявлено не было. У 57 (63,3%) больных отмечено снижение выраженности складчатости мошонки, у 47 (52,2 %) - снижение тонуса яичек и их чувствительности к пальпации. Размеры яичек у больных в среднем составили 4,38 х 3,21 х 2,47 см, что не отличалось от контрольной группы (4,43 х 3,24 х 2,51 см, р<0,05). Придатки яичек, семенные канатики не имели признаков какой-либо патологии. Результаты пальцевого ректального исследования ПЖ имели корреляцию с данными, полученными при ТРУЗИ ПЖ (r=0,93, p<0,05). Специальными методами исследования у больных установлен ХП, исключены ЗППП, психологический, иммунологический и женские факторы бесплодия. У всех больных концентрация простатоспецифического антигена (ПСА) в крови в среднем составила 2,6±0,7 нг/мл (норма - 3,2±0,3 нг/мл), что исключало возможный злокачественный рост ткани ПЖ.
Запах, цвет и рН эякулята у всех больных соответствовали норме. У 46 (51,1%) больных выявлено снижение объема эякулята, что подтверждают данные литературы о снижении объема эякулята при поражении СП [2,6,13]. Снижение объёма эякулята имело прямую корреляцию с повышением вязкости эякулята (r=0,93, p<0,05), со снижением концентрации сперматозоидов в 1 мл (r=0,71, p<0,01), с процентом сперматозоидов с прямолинейно-поступательным движением (r=0,79, p<0,01) при одновременном возрастании процента сперматозоидов с непрогрессивным движением (r=0,83, p<0,01) и дискинезией (r=0,85, p<0,02). Снижение объёма эякулята может быть вызвано ХП и частичной обструкцией семявыбрасывающего протока (ЧОСП) [4].
У 56 (62,2%) больных отмечено увеличение вязкости эякулята, что обусловлено либо снижением объема эякулята, либо высоким содержанием в нём слизи [5,6]. По данным исследователей [2,5,10,12], вязкость эякулята при олигоастенозооспермии (ОАЗС) была значительно выше, чем при нормозооспермии. Повышение вязкости эякулята у человека снижает оплодотворяющую способность спермы, препятствуя наступлению беременности в естественном цикле и уменьшая эффективность вспомогательных репродуктивных технологий [6,13]. Это объясняется с одной стороны тем, что повышенная вязкость эякулята может мешать движению сперматозоидов в слизи [2,3,6], а с другой – в разной степени сочетаться с остальными видами нарушений оплодотворяющей способности спермы [7,10-14]. У 10 (11,1%) больных отмечено снижение вязкости эякулята, что, очевидно, связано с нарушениями ферментативной, генеративной и эндокринной функции тестикул [2]. СП продуцируют семиногель, который вызывает коагуляцию эякулята: повышение содержания семиногеля вызывает повышенную, снижение – сниженную вязкость эякулята [3].
Во время нормальной эякуляции в первую очередь выделяется секрет ПЖ и придатков яичка [3]. Объём первой фракции эякулята составляет 0,5-1 мл. Она имеет жидкую консистенцию и кислую реакцию (рН=6,0-6,5). Вторая фракция содержит секрет СП, выделяется в виде сгустка и имеет щелочную реакцию. Её объём колеблется от 1 до 5 мл. In vitro в результате ферментативной активности ПСА сгусток примерно через 30 мин. разжижается. Нарушение функций добавочных половых желёз (качественное или количественное) может приводить к изменениям объёма эякулята (менее 1,5-2 мл или более 6 мл), рН спермы, её слабому разжижению или его полному отсутствию. Снижение выработки ПСА приводит к плохому разжижению спермы [5], что доказано в нашей работе. Патологические изменения жидкой части спермы нарушают функцию сперматозоидов [7,13] и снижают стабильность хроматина [5,14] за счёт снижения содержания таких веществ, как цинк [10] и кальций. Кроме того, секрет придатков яичка и ПЖ – основной источник антиоксидантов спермы. В связи с этим нарушение секреторной функции придатков яичек может вызывать снижение антиоксидантных возможностей спермы, что приводит к дисбалансу между свободнорадикальным окислением и механизмами антиоксидантной защиты [8], а также к повреждению оболочки сперматозоидов и структуры ДНК.
У 57 (63,3 %) больных выявлена олигозооспермия (ОЗС) 1-й, у 24 (26,7 %) – ОЗС 2-й, у 9 (10%) - ОЗС 3-й степени (ст.). Определялась высокая корреляция между степенью ОЗС от длительностью ХП: чем больше длительность ХП, тем в большей степени выражена ОЗС (r= 0,93, р<0,05). Выявлена корреляция между количеством спермиев в 1 мл эякулята и степенью их подвижности у больных (r=0,97, р<0,05). Так, у пациентов с ОЗС 1-й ст. астенозооспермия (АЗС) обнаружена в 12%, при ОЗС 2-й ст. - в 82 %, при ОЗС 3-й ст. - в 93% случаев. Наиболее выраженное увеличение вязкости эякулята отмечается при значительной ОЗС: от 0,1 до 5 млн/мл сперматозоидов. Дальнейшее увеличение концентрации сперматозоидов сопровождается постепенным уменьшением вязкости эякулята, однако только при превышении концентрации 20 млн/мл вязкость становится нормальной практически у всех пациентов (р<0,05). Следует отметить, что это происходит вследствие нормального разжижения эякуляционного сгустка, и такое явление надо отличать от состояния аспермии, когда, вероятно, в разжижении просто нет физиологической необходимости. Вероятность оплодотворения при концентрации сперматозоидов более 20 млн/мл будет в меньшей степени зависеть от подвижности и морфологии сперматозоидов [13,14]. Последние две характеристики эякулята имеют небольшую прогностическую ценность, но позволяют отличить фертильную сперму от субфертильной [5,6].
Наиболее чувствительным параметром фертильности при повышенной вязкости эякулята является подвижность сперматозоидов. Полученные нами данные свидетельствуют о том, что это первый показатель, который ухудшается при нарушенном разжижении спермы. При этом доля подвижных сперматозоидов категории [a + b] уменьшается, а доля категории [c] и процент сперматозоидов с дискинетическими движениями увеличиваются. АЗС 1-й ст. отмечена у 58 (64,4%), АЗС 2-й ст. - у 21 (23,3 %), АЗС 3-й ст. - у 11 (12,2%) пациентов. Наибольший процент изолированной АЗС выявлен у больных в возрасте 22-30 лет и этот показатель уменьшается с возрастом, что имеет высокую корреляцию (r=0,84, p<0,05). Изолированная АЗС определяется, очевидно, в фазе манифестации ХП. В дальнейшем происходят более глубокие дегенеративные и иммунологические изменения в тестикулах, приводящие к появлению ОЗС [2]. Перенесённые ЗППП и их осложнения оказывают негативное влияние на фертильность у мужчин [7] и вызывают снижение общего количества сперматозоидов [13]. ХП генерирует реактивные формы кислорода, которые изменяют липидный состав мембраны сперматозоидов в сторону уменьшения её текучести, фузогенной способности и нарушения реактивности акросом, фрагментации ДНК, а также способности сливаться с оолеммой [6,14].
У больных с ОАЗС в нативных мазках эякулята выявлено от 20 до 40% живых сперматозоидов, в отдельных препаратах – резкое уменьшение количества сперматозоидов до 30-50 в поле зрения, остальные формы – неполноценные, дегенеративные, неспособные к поступательному движению. При исследовании мазков эякулята, окрашенных по Фельгену, в каждом случае выявлено большое количество густой слизи, образующей на мазках своеобразное переплетение тяжей и нитей в виде многоэтажных сетей; слизь гомогенная, но из-за различной плотности и толщины тяжей их окраска по интенсивности варьирует. Массивные тяжи окрашены более интенсивно, чем тонкие. Сперматозоиды в таких мазках видны в виде окрашенных в малиновый цвет точек, поскольку окрашена фактически только ДНК, содержащаяся в ядрах сперматозоидов. Сперматозоиды сосредоточены только в пределах слизистого комка; граница слизи фактически определяет на мазке и границу распространения сперматозоидов.
При рассмотрении такого эякулята в нативном состоянии создаётся впечатление, что сперматозоиды настолько связаны плотной слизью, что она исключает возможность освобождения их силой собственного движения. По этой причине в свежей капле неразбавленной спермы сперматозоиды будут оставаться малоподвижными или совсем неподвижными, имитируя картину тератозооспермии (ТЗС). При разбавлении такого слизистого сгустка подвижность сперматозоидов может восстановиться не столько из-за активизации самих сперматозоидов, сколько благодаря устранению вязкости сгустка, сковывающей их подвижность. При исследовании сперматозоидов в окрашенных мазках у этой группы больных наблюдается множество (до 40%) патологически измененных форм сперматозоидов. В головках их интенсивность окраски ДНК заметно ослаблена, либо почти потеряна; в отдельных сперматозоидах остаётся неокрашенной или слабо окрашенной центральная часть головки, от чего она приобретает вид теннисной ракетки. По данным ряда исследователей [11,14], содержание ДНК в сперматозоидах мужчин с пониженной плодовитостью меньше, чем с нормально оплодотворяющей способностью.
У 42 (46,7 %) больных выявлена ТЗС 1-й ст., у 20 (22,2 %) - ТЗС 2-й ст. и у 2 (2,2 %) - ТЗС 3-й ст. В спермограммах этих больных отмечается много дегенеративных форм сперматозоидов. Сперматозоиды почти все деформированы: набухшие, потерявшие чёткие контуры, полное отсутствие хвостов, частичное разжижение головки с образованием просветлений в полюсе или в центре. Выявлена высокая корреляция между степенью ТЗС и количеством содержания клеток сперматогенеза в эякуляте (r=0,91, р<0,05). Преобладание больных с ОЗС, АЗС и ТЗС подтверждало данные литературы о повреждении сперматогенеза у больных с длительным течением ХП [6,7,10-14]. Ни в одном случае ТЗС не протекала самостоятельно, а находилась либо с АЗС или ОЗС. По всей видимости, тератоидные формы сперматозоидов подавляют прямолинейно-активную подвижность сперматозоидов, что имеет высокую корреляцию (r=0,91, р<0,05). ОАТЗС может быть вызвана ЧОСП или частичной блокадой сперматогенеза [4].
У больных с ОАТЗС в нативных мазках эякулята отмечается небольшое количество сперматозоидов – 15-30-50 в поле зрения. Подвижность сперматозоидов составляет от 10 до 40%. Среди неподвижных, в основном – дегенеративные формы с удлиненной головкой, отсутствием выраженной шейки, с резко изогнутой головкой у шейки, оборванными и короткими хвостами, с удвоенными головками. В мазках, окрашенных по Паппенгейму, субстрат эякулята неравномерной плотности с неравномерным распределением сперматозоидов; большинство полей мазков чистые с единичными прожилками, с удвоенными головками, окрашенные в лиловый цвет. Эти хлопья гомогенные, неравномерной плотности, различных размеров и не связаны с концентрацией сперматозоидов. В мазках регистрируется большое количество сегментоядерных нейтрофилов и единичные мононуклеары.
Сами сперматозоиды рассредоточены в мазках более или менее равномерно, но отличаются по форме и размерам. В некоторых фиксированных мазках сперматозоиды расположены редко, все они деформированы, но весьма характерно наличие сперматозоидов с увеличенной головкой, по объёму в два раза превышающей размеры головки нормальных сперматозоидов (тератоидные формы). По морфологическому принципу можно предположить, что появление сперматозоидов с увеличенной головкой – это следствие выхода в сперму не поделившихся сперматоцитов второго порядка. В большинстве мазков сперматозоиды набухшие, с головкой округленной формы и неравномерно окрашенной, другие клетки, составляющие не более 20-30%, имеют характерную нормальную форму головки и чёткие контуры. В набухших клетках контур головки на одном из полюсов расплывчатый, с удвоенными и преломлёнными хвостами. Таким образом, ХП существенно влияет не только на уже образовавшиеся сперматозоиды, но и на сам процесс спермиогенеза, нарушая нормальное деление сперматоцитов, что проявляется, в частности, присутствием в сперме сперматозоидов, созревших из неподелившихся предшественников (тератоидные формы).
В мазках, окрашенных по Фельгену, в головках сперматозоидов интенсивность окраски ДНК заметно ослаблена, либо почти потеряна; в отдельных сперматозоидах остаётся неокрашенной или слабо окрашенной центральная часть головки, от чего она приобретает вид теннисной ракетки. Преимущественная локализация изменений в шейке и хвосте сперматозоидов у больных ХП с бесплодием, возможно, объясняется поражением митохондриального аппарата сперматозоидов, что служит причиной снижения их подвижности.
У больных ИОС был 1,93±0,06 при среднестатистическом объёме яичек 17,4±0,2 см3 , концентрации сперматозоидов в 1 мл 24,3±0,4 млн., объёме эякулята 2,8±0,3 мл3 по сравнению с контрольной группой, у которой ИОС был 3,54±0,12 при среднестатистическом объёме яичек 17,8±0,3 см3, концентрации сперматозоидов в 1 мл 36,2±0,3 млн., объёме эякулята 3,5±0,2 мл3. Таким образом, у здоровых мужчин 1 мл объёма тестикул продуцирует 3,54 млн. сперматозоидов, у больных – 1,93 млн., т. е. в 1,8 раза меньше по сравнению со здоровыми, что указывает на функциональную блокаду процесса спермиогенеза у больных ХП. Выявлена высокая корреляция между снижением ИОС и повышенной концентрацией АСАТ в крови (r=0,83, p<0,05), увеличением длительности ХП и снижением ИОС (r=0,76, p<0,05), снижением количества лецитиновых зёрен и снижением ИОС (r=0,74, p<0,05).
Основными свойствами эякулята являются: количество сперматозоидов во всём эякуляте, процент подвижных сперматозоидов и процент морфологически нормальных сперматозоидов [3]. Исходя из вышесказанного, мы ввели понятие «индекс пенетрации сперматозоидов» (ИПС), который характеризует оплодотворяющую способность эякулята. ИПС вычисляется при умножении объёма эякулята, количества сперматозоидов в 1 мл3 эякулята, процента активно подвижных сперматозоидов, процента морфологически нормальных сперматозоидов, делённое на количество сперматозоидов во всём эякуляте. Так, у больных ИПС снижен в 2 раза (24,1±1,7) по сравнению со здоровыми (47,4±2,8, р<0,05), что показывает снижение оплодотворяющей способности эякулята у больных ХП.
Таким образом, результаты наших исследований свидетельствуют, что при ХП спермограммы характеризуются вначале уменьшением процента подвижных форм, а затем – уменьшением процента подвижных форм и количества сперматозоидов, что свидетельствует о функциональной блокаде сперматогенной функции тестикул у больных ХП.
Наши исследования показали, что у 84,4% больных патологические состояния эякулята носили сочетанный характер: ОАТЗС 1 ст. выявлена у 44 (48,9%), ОАТЗС 2 ст. – у 19 (21,1%), ОАТЗС 3 ст. – у 2 (2,2%), ОАЗС 1 ст. – у 7 (7,8%), ОАЗС 2 ст. – у 2 (2,2%), ОАЗС 3 ст. – у 2 (2,2%), АТЗС 1 ст. – у 7 (7,8%), АТЗС 2 ст. – у 4 (4,4%), АТЗС 3 ст. – у 3 (3,3%). Следовательно, инфертильность наступает в тех случаях, когда имеется биологическая несостоятельность нескольких сперматологических показателей эякулята, характеризующих нормативные данные спермограммы.
У 64 (71,1%) больных выявлено повышение степени агглютинации сперматозоидов (САС), что имело высокую корреляцию между САС и длительностью ХП (r=0,97, р<0,05), между САС и концентрацией антиспермальных антител (АСАТ) в крови (r=0,73, p<0,05). Концентрация АСАТ в крови была увеличена в 1,3 раза (71,36±8,62 ммоль/мл) по сравнению с нормой (54,27±6,41ммоль/мл, р<0,05). Выявлена прямая корреляция между наличием АСАТ в крови и снижением подвижности сперматозоидов (r=0,76, p<0,05) и обратная между наличием АСАТ и снижением концентрации сперматозоидов (r=-0,64, p<0,05), т. к. АСАТ способны влиять на спермиогенез [10]. Присутствие АСАТ на поверхности сперматозоидов вызывает снижение фертильности, но необязательно исключает возможность оплодотворения. АСАТ могут нарушать оплодотворяющую способность сперматозоидов на различных уровнях, включая снижение продолжительности их жизни, подвижности и способности к пенетрации цервикальной слизи, а также нарушение взаимодействия сперматозоида и яйцеклетки [10,12]. Присутствие АСАТ сочетается с избыточным образованием свободных радикалов кислорода, что может дополнительно ухудшать качество спермы из-за окисления мембраны сперматозоидов, белков аксонемы и ДНК [8,10]. Ряд исследователей [10,13,14] считают, что выработку АСАТ вызывает ЧОСП вследствие ХП.
Резистентность сперматозоидов (РС) отражает степень функциональной зрелости сперматозоидов [3]. У 77 (85,6%) больных выявлена сниженная РС (6738,57±149,63) по сравнению с нормой (12756,83±168,47, р<0,05). Отмечена высокая корреляция между показателями РС и длительностью ХП: чем длительнее ХП, тем значительнее снижены показатели РС (r=0,94, р<0,05). При ОЗС различных степеней наблюдалось снижение РС (r=0,97, р<0,05).
Дыхательная способность сперматозоидов (ДСС) отражает степень полноценности сперматозоидов [3]. У 75 (83,3%) больных ДСС была снижена (94,7±12,2 мин) по сравнению с нормой (63,4±11,6 мин, р<0,05). Степень выраженности ДСС коррелировала с длительностью ХП: чем длительное течение ХП, тем более низкими были показатели ДСС (r=0,92, р<0,05). Отмечена высокая корреляция между ДСС и концентрацией фруктозы в эякуляте, ДСС и лимонной кислоты в эякуляте: чем ниже были концентрации фруктозы и лимонной кислоты в эякуляте у больных, тем более низкие степени были ДСС (r =0,94, р<0,05 и r=0,96, p<0,05 соответственно).
Количество лейкоцитов в эякуляте у больных было в пределах нормы, что указывало на наличие стойкой ремиссии ХП на момент обследования. Количество лецитиновых зерен у 65 (73,3%) было сниженным (менее 20 млн/мл), что свидетельствовало о снижении функциональной активности ПЖ и коррелировало с длительностью ХП (r=0,93, р<0,05). У 66 (73,3%) больных феномен кристаллизации секрета ПЖ был снижен, что косвенно свидетельствовало о наличии гипоандрогении у больных ХП [2].
У больных ХП выявлено достоверное уменьшение содержания морфологически нормальных сперматозоидов по сравнению с контрольной группой (р<0,002, табл. 1). Одновременно отмечено значительное увеличение относительного содержания сперматозоидов с патологическими изменениями хвоста (р<0,005), причём в основном за счёт сперматозоидов с закрученным хвостом. Процентное содержание морфологически незрелых сперматозоидов (p<0,0001), сперматозоидов с аномалией срединного тела (р=0,025), сперматозоидов с изменёнными размерами головки (р=0,022) и сперматозоидов с лёгкой формой патологии головки (р<0,0001) у больных ХП было ниже, чем в контрольной группе. По данным ряда исследователей [5,6,14], в 80% случаев успешное оплодотворение происходит при содержании в образце спермы более 14% нормальных форм сперматозоидов. Плохой прогноз оплодотворения (<7,6%) наблюдается при содержании нормальных форм менее 5%. Однако, при этом происходит значительное повышение частоты возникновения беременности при использовании внутриматочной инсеминации. Нормальная морфология акросомы связана с возможностью акросомальной реакции и связыванием сперматозоида с желточной оболочкой яйцеклетки [6,10]. Считают, что сперматозоиды с остатками цитоплазмы содержат больше ферментов (например, креатинкиназы и глюкозо-6-фосфатдегидрогеназы), стимулирующих выработку активных форм кислорода. В сперматозоидах с серьёзными морфологическими нарушениями обнаружена более высокая частота возникновения хромосомных аномалий [11,14].
Таблица 1. Морфологические формы сперматозоидов (в %) у больных хроническим простатитом, оцененные с помощью методики строгой морфологии (М ± m)
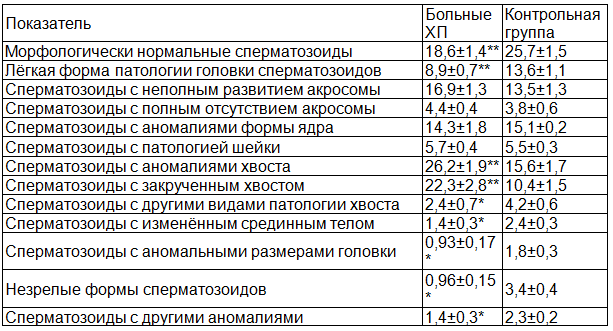
Примечание: * - р < 0,05, ** - р < 0,01 по сравнению с контрольной группой.
У 67 (74,4%) больных снижен фруктолиз в эякуляте (2,67±0,21 ммоль/л) по сравнению с нормой (3,53±0,24 ммоль/л, р<0,05). У 77 (85,6%) больных выявлено снижение концентрации фруктозы в эякуляте (12,74±1,17 ммоль/л) по сравнению с нормой (15,37±1,29 ммоль/л, p<0,05). Отмечена высокая корреляция между снижением концентрации фруктозы в эякуляте и длительностью ХП (r=0,96, р<0,05), между снижением концентрации фруктозы в эякуляте и снижением фруктолиза (r=0,94, р<0,05). ОЗС, снижение фруктозы в эякуляте со снижением его объёма свидетельствуют о ЧОСП [4].
У 79 (87,8%) больных выявлено снижение (18,34±1,27 ммоль/мл) концентрации лимонной кислоты в эякуляте по сравнению с нормой (23,42±1,83 ммоль/мл,p<0,05). Выявлена высокая корреляция между концентрацией лимонной кислоты в эякуляте и длительностью ХП: чем длительное течение ХП, тем более снижена концентрация лимонной кислоты в эякуляте (r=0,95, р<0,05). Снижение концентрации фруктозы и лимонной кислоты в эякуляте косвенно свидетельствует о наличии дегенеративных изменений в придаточных половых железах и гипоандрогении у больных ХП с инфертильностью [2,5,13].
ЛДГ-Х - изофермент ЛДГ, который присутствует в яичках мужчин постпубертатного возраста и поступает в эякулят непосредственно из яичек. Данный фермент специфичен для герминативного эпителия. ЛДГ-Х составляет более чем 80% общего количества ЛДГ в зрелых сперматозоидах. В этих клетках она находится в цитозоле и матриксе митохондрий, которые составляют митохондриальный футляр срединного сегмента. ЛДГ-Х у больных повышена в 1,3 раза (0,76±0,09 ммоль/мл) по сравнению со здоровыми (0,57±0,06 ммоль/мл, р<0,05). Отношение активности ЛДГ-Х к концентрации сперматозоидов составляет индекс функции герминативного эпителия (ИФГЭ). У больных ИФГЭ повышен в 2 раза (3,12±0,13) по сравнению со здоровыми (1,57±0,09, р<0,05), что свидетельствует о функциональной блокаже процесса спермиогенеза. Повышение концентрации ЛДГ-Х было отмечено у больных, имеющих локальные изменения в шейке и хвосте сперматозоидов (r=79, p<0,05). Активность ЛДГ не коррелирует с процентом подвижности сперматозоидов, ДСС, РС.
Концентрация КФ в эякуляте у больных снижена в 1,3 раза (9,34±1,17 мкмоль/мл) по сравнению со здоровыми (12,29±1,23 мкмоль/мл, р<0,05). Концентрации ЛДГ-Х и КФ в эякуляте имеют прямую обратную зависимость: при повышенных концентрациях ЛДГ-Х прямо пропорционально снижается концентрация КФ (r=-0,81, p<0,05).
Заключение. У 84,4% больных патологические состояния эякулята носили сочетанный характер. ХП влияет на строение сперматозоидов, которое выражается в увеличении числа сперматозоидов с патологией хвоста и уменьшении числа морфологически нормальных сперматозоидов. Концентрации АСАТ в крови и ЛДГ-Х в эякуляте были повышены в 1,3 и 1,3 раза соответственно по сравнению со здоровыми. У больных фруктолиз, концентрации фруктозы, лимонной кислоты и КФ в эякуляте снижены в 1,3, 1,2, 1,3 и 1,3 раза соответственно по сравнению со здоровыми. У больных ИОС и ИПС были снижены в 1,8 и 2 раза соответственно, ИФГЭ повышен в 2 раза по сравнению со здоровыми, что свидетельствует о функциональной блокаде спермиогенеза и снижении оплодотворяющей способности эякулята у больных ХП.
