Хронический простатит (ХП) в структуре урологической патологии занимает 35-63% случаев [1,4], который в 27-83% вызывает эректильную дисфункцию (ЭД) [5,8]. Ряд исследователей [9,13] считают, что у 80% больных ЭД возникает вследствие нарушений пенильной гемодинамики. У больных ХП с ЭД пенильная гемодинамика изучена недостаточно, данные носят отрывочный и крайне противоречивый характер в связи с исследованием неоднородного возрастного контингента больных, различными длительностью и количеством обострений заболевания, отсутствием при исследовании пенильной гемодинамики чётких критериев определения фаз индуцированной эрекции [10,11,13]. В настоящее время разработаны нормативные данные пенильной гемодинамики, изменение диаметра пенильных сосудов при циклических изменениях индуцированной эрекции [6,7,15]. Исследования показали, что степень пенильной гемодинамики находится в непосредственной связи с концентрацией тестостерона (Т) в крови, т. к. рецепторы Т находятся в гладких мышцах сосудов и в эндотелии, поэтому снижение уровня Т может привести к нарушениям перфузии ряда органов [3,5,7]. Однако, у больных ХП отсутствуют данные пенильной гемодинамики, изменение диаметра пенильных сосудов при циклических изменениях индуцированной эрекции и их связь с плазменной концентрацией Т, изучение которых поможет в дальнейшей выработке терапевтической тактики.
Цель исследования – изучить пенильную гемодинамику при циклических изменениях индуцированной эрекции и взаимосвязь пенильной гемодинамики с плазменной концентрацией Т у больных ХП.
Материалы и методы. Под нашим наблюдением находилось 160 больных ХП в возрасте от 23 до 45 лет (в среднем 32,7±1,4 года) с длительностью ХП от 1 года до 9 лет (в среднем 4,3±1,2 года) и длительностью ЭД от 6 мес. до 8 лет (в среднем 4,1±0,8 года). Специальными методами исследования у больных выявлен хронический абактериальный простатит (по классификации NIH категория III А, III В и категория IV).
Всем пациентам выполнялось ультразвуковое цветное допплерографическое картирование сосудов полового члена на аппарате “Logig 7000 “Expert” GE” (США). До и после проведения фармакотеста с интракавернозным введением 10 мкг каверджекта (Германия) с последующей видеоассоциативной сексуальной стимуляцией (ВАСС) исследовали кровоток в кавернозных, дорсальных артериях, глубокой дорсальной вене, диаметр кавернозных артерий, площадь поперечного сечения кавернозных тел (эректильная площадь), толщину белочной оболочки, изменения кровотока в кавернозных артериях и глубокой дорсальной вене при циклических изменениях эрекции с использованием пробы Вальсальвы. При допплерографии оценивались максимальная систолическая скорость кровотока (Vmax), максимальная конечная диастолическая скорость кровотока (Vendd), индекс пульсации (IP) и индекс резистентности (IR). Качество эрекции оценивали по шкале Юнема: ER0 – отсутствие эрекции, ER1 – незначительная тумесценция, ER2 – неполная тумесценция, ER3 – полная тумесценция, ER4 – полуригидная эрекция, ER5 – полноценная эрекция. Концентрацию Т определяли в сыворотке крови иммуноферментным методом наборами фирмы СП «Белорис» (Белоруссия). Контрольную группу составили 20 здоровых мужчин в возрасте от 23 до 45 лет (в среднем 32,6±1,3 года).
Результаты исследования. Обострения ХП до 1 раза в год были у 92 (57,5%), 2-3 раза – у 32 (20%) больных. Все больные в той или иной степени предъявляли жалобы на боли тянущего, ноющего характера в низу живота, пояснично-крестцовой области, дискомфорт в промежности, дизурию, ЭД, психо-эмоциональные и вегето-сосудистые нарушения.
Допплерометрические исследования показали, что у больных в фазу релаксации Vmax в кавернозных артериях снижена в 1,5, Vendd и IP повышены в 1,3 и 1,2 раза соответственно по сравнению с нормой, у больных в фазу тумесценции Vmax и IP снижены в 1,3 и 1,4 раза соответственно, Vendd и IP повышены в 1,1 и 1,2 раза соответственно по сравнению с нормой (табл. 1), что свидетельствует об артерио-венозной недостаточности, снижении эластических свойств артериальных сосудов, неадекватном расслаблении стенок артериол и гипоксическом состоянии кавернозных тел полового члена [2,3].
Таблица 1. Допплерометрические показатели гемодинамики в кавернозных артериях в фазу релаксации и тумесценции у больных хроническим простатитом и у здоровых мужчин
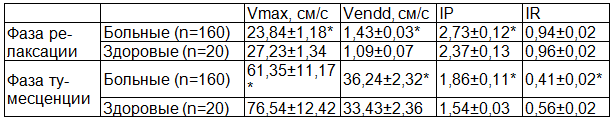
Примечание: здесь и далее * - р<0,05 по сравнению с контрольной группой.
Допплерометрические исследования в фазу релаксации показали, что у больных Vmax в дорсальных артериях снижена в 1,1, IR – в 1,1, Vendd -повышена в 4,6, IP – в 1,2 раза по сравнению с нормой, в фазу эрекции Vmax повышена в 1,1, Vendd – в 2,7, IP – в 1,2, IR – cнижен в 1,2 раза по сравнению с нормой (табл. 2). Повышение Vendd и IR в фазу релаксации и эрекции в дорсальных артериях свидетельствуют о гипоксическом состоянии кавернозных тел полового члена, неадекватном и рассогласованном расслаблении стенок артерии [2,3].
Таблица 2. Допплерометрия дорсальных артерий полового члена в фазу релаксации и эрекции у больных хроническим простатитом и у здоровых мужчин
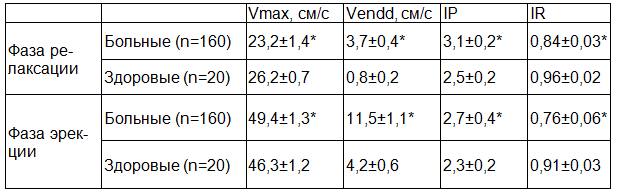
Для функциональной оценки пенильной гемодинамики мы ввели понятие «коэффициент систолической скорости кровотока (КVmax)», «коэффициент диастолической скорости кровотока (КVendd)» и «индекс систоло-диастоличекого коэффициента (ИСДК)». КVmax высчитывается делением показателя Vmax в стадии тумесценции на показатель Vmax в стадии релаксации, КVendd – делением показателя Vendd в стадии тумесценции на показатель Vendd в стадии релаксации, ИСДК – делением КVmax на КVendd. У больных КVmax в кавернозных артериях снижен в 1,1 раза (2,57±0,03) по сравнению с нормой (2,81±0,04, р<0,05), КVendd – снижен в 1,2 раза (25,3±0,3) по сравнению с нормой (30,7±0,4, р<0,05), ИСДК – повышен в 1,1 раза (0,1±0,002) по сравнению с нормой (0,092±0,002, р<0,05). Мы выявили высокую корреляцию между возрастом больных и нарушением гемодинамики в кавернозных артериях как в стадии релаксации (r=0,84, p<0,05), так и в стадии тумесценции (r=0,86, р<0,05), между длительностью ХП и гемодинамикой в кавернозных артериях как в стадии релаксации (r=0,83, p<0,05), так и в стадии тумесценции (r=0,85, p<0,05).
У больных 26-30 лет происходят компенсаторные изменения: KVmax и KVendd снижаются до 2,59±0,02 и 25,6±0,3 соответственно для регуляции венозного оттока за счет снижения IP, однако, в связи с этим происходит гиперкомпенсация пенильной гемодинамики (ИСДК составляет 0,1±0,002), которая по прошествии времени приводит к «срыву» компенсации. В группе больных от 35 до 45 лет КVmax снижается (от 2,57 до 2,51), также снижается КVendd (от 24,54 до 23,78), ИСДК находится в состоянии напряжения, в связи с чем пенильная гемодинамика в стадии тумесценции находится в состоянии рассогласованности и десинхронизации. Мы считаем, что снижение IP и Vendd при нормативных данных Vmax и IR в стадии релаксации может являться «пусковым» фактором развития венозной недостаточности, снижение IP при нормативных данных Vmax, Vendd и IR в стадии тумесценции - «пусковым» фактором развития артериальной недостаточности пенильной гемодинамики. Полученные результаты показали, что снижение KVmax ниже 2,5 является фактором развития артериальной недостаточности, а повышение KVendd до 24,5 – фактором развития венозной недостаточности пенильной гемодинамики.
У больных диаметр кавернозной артерии в стадии релаксации составляет 0,81±0,02 см, что на 5,8% меньше по сравнению со здоровыми (0,86±0,03 см, р<0,05), в стадии тумесценции – на 2,5% меньше (1,18±0,03 см) по сравнению со здоровыми (1,21±0,03 см, р<0,05). Мы ввели понятие «индекс эластичности артериальной стенки» (ИЭАС), который высчитывается от деления диаметра кавернозной артерии в стадии тумесценции на диаметр кавернозной артерии в стадии релаксации. У больных ИЭАС на 3,4% больше (1,46±0,02) по сравнению со здоровыми (1,41±0,02, р<0,05), что показывает снижение эластотонических свойств кавернозных артерий. Выявлена высокая корреляция между возрастом обследуемых и диаметром кавернозной артерии как в стадии релаксации (r=0,83, р<0,05), так и в стадии тумесценции (r=0,81, р<0,05), между длительностью ХП и диаметром кавернозной артерии как в стадии релаксации (r=0,82, р<0,05), так и в стадии тумесценции (r=0,83, р<0,05).
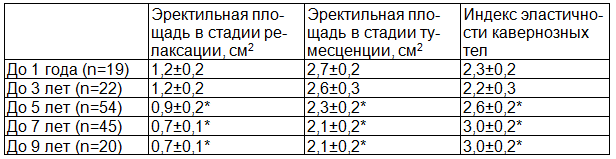
У больных эректильная площадь в стадии релаксации была в 1,3 раза меньше (0,9±0,3 см2) по сравнению с нормой (1,2±0,3 см2, р<0,05), в стадии тумесценции (ER3) – в 1,2 раза меньше (2,3±0,2 см2) по сравнению с нормой (2,7±0,3 см2, р<0,05). Мы ввели понятие «индекс эластичности кавернозных тел» (ИЭКТ), который высчитывается от деления площади кавернозных тел в стадии релаксации к площади кавернозных тел в стадии тумесценции. У больных ИЭКТ на 11,5% меньше (2,6±0,2) по сравнению с нормой (2,3±0,2, р<0,05), что показывает снижение эластических свойств кавернозных тел. Выявлена высокая корреляция между возрастом обследуемых и эректильной площадью в стадии релаксации (r=0,84, p<0,05)и в стадии тумесценции (r=0,81, р<0,05), между длительностью ХП и эректильной площадью в стадии релаксации (r=0,85, р<0,05) и в стадии тумесценции (r=0,86, p<0,05) (табл. 3).
Таблица 3. Зависимость площади поперечного сечения кавернозных тел в стадии релаксации и тумесценции, индекса эластичности кавернозных тел от длительности хронического простатита
Существующие концепции венокорпоральной ЭД, связанной с патологическим венозным дренажом (ПВД), причиной которого является нарушение замыкательной функции белочной оболочки и с формированием несостоятельных перфорантных вен предполагают, что именно белочная оболочка является основным гемодинамическим барьером, создающим пассивный венозный блок. Основной механизм этого ограничения венозного оттока заключается в перекрытии в толще белочной оболочки перфорантных вен путём смещения слоев белочной оболочки друг относительно друга [10,15].
В β-режиме линейным датчиком 14 МГц в средней трети кавернозных тел полового члена определяли толщину белочной оболочки в стадии релаксации и полной ригидности. У больных белочная оболочка в стадии релаксации (ER0) была в 1,2 раза толще (1,2±0,2 мм) по сравнению с нормой (1,0±0,2 мм, р<0,05), в стадии полной ригидности (ЕР5) – в 1,4 раза толще (0,7±0,1 мм) по сравнению с нормой (0,5±0,1 мм, р<0,05), что показывает несостоятельность белочной оболочки [15]. Мы ввели понятие «индекс эластичности белочной оболочки» (ИЭБО), который высчитывается от деления толщины белочной оболочки в стадии релаксации на толщину белочной оболочки в стадии полной ригидности. У больных ИЭБО в 1,2 раза меньше (1,71±0,03) по сравнению с нормой (2,0±0,02, р<0,05), что показывает снижение эластических свойств белочной оболочки. Выявлена высокая корреляция между возрастом обследуемых и толщиной белочной оболочки как в стадии релаксации (r=0,81, р<0,05), так и в стадии полной ригидности (r=0,83, р<0,05), между возрастом больных и ИЭБО (r=0,85, р<0,05), между длительностью ХП и ИЭБО (r=0,86, р<0,05), между длительностью ХП и толщиной белочной оболочки как в стадии релаксации (r=0,82, р<0,05), так и в стадии полной ригидности (r=0,83, р<0,05).
У больных в возрасте 22-25 лет толщина белочной оболочки как в стадии релаксации, так и в стадии полной ригидности, ИЭБО не отличаются от нормы. В возрасте 26-30 лет у больных толщина белочной оболочки в стадии релаксации и ИЭБО достоверно повышены (р<0,05) по сравнению с нормой, толщина белочной оболочки в стадии полной ригидности не отличается от нормы (р>0,05), что, по-видимому, на фоне «суперкомпенсации» ИЭБО происходит формирование венокорпоральной ЭД. Боли, парестезии, распирание в половом члене в прелиминарном и фрикционном периодах у больных при длительности ХП до 3 лет мы связываем с «суперкомпенсацией» ИЭБО, слабость эрекции, неудерживание, исчезновение эрекции в прелиминарном и фрикционном периодах у больных при длительности ХП от 5 до 9 лет – с низким ИЭБО (ПВД). Мы считаем, что предложенный нами ИЭБО может являться диагностическим алгоритмом ПВД.
При изучении гемодинамических изменений в артериях полового члена в процессе индуцированной эрекции, получены данные, позволяющие расширить представление о механизме эрекции. В фазу релаксации гладкомышечные синусы кавернозной ткани находятся в состоянии тонического сокращения, обеспечивая высокое сопротивление артериальному притоку. В фазу начальной тумесценции (ER1) при индуцированной эрекции происходит расслабление гладкомышечной составляющей кавернозных синусов и артериальных сосудов полового члена, что приводит к снижению IR (табл. 4). В период тумесценции происходит нарастание линейной скорости кровотока по дорсальным и глубоким артериям полового члена (максимально – почти вдвое выше исходной величины). IP и IR постепенно снижаются, причём IP – в 1,6, IR – в 1,5 раза по сравнению с исходными показателями.
На допплерограмме одновременно с нарастанием линейной скорости кровотока отмечается постепенное уменьшение реверсивной фазы и появление диастолической составляющей. Кровоток приобретает характер магистрального гиперергического. Другими словами, в момент развития эрекции движение крови по артериям полового члена становится постоянным и строго направленным как в фазу систолы сердца, так и в фазу диастолы, что обусловлено релаксацией кавернозных тел и активным «присасыванием» крови. На допплерограмме кривая приобретает типичный вид, когда нисходящее её колено даже в фазу диастолы не опускается до изолинии. Описанная картина изменений кровотока в период тумесценции свойственна и для глубоких, и для дорсальных артерий полового члена.
По достижении пика эрекции линейная скорость кровотока по дорсальным артериям полового члена вновь снижается до исходного уровня или незначительно превышает его; по глубоким артериям полового члена – становится существенно ниже исходного значения, одновременно увеличивается IP. На дорсальных артериях полового члена IP по достижении пика эрекции также увеличивается, но остаётся ниже показателя, регистрируемого в состоянии покоя. Допплеровская кривая приобретает свой изначальный вид, но с умеренно сниженной амплитудой. В период детумесценции происходит постепенное возвращение показателей допплерограммы к исходным уровням. Кровоток по дорсальным артериям восстанавливается значительно быстрее (через 15-20 мин), чем по глубоким (через 60-80 мин).
Таким образом, участие в эрекции не только глубоких, но и дорсальных артерий полового члена подтверждается синхронным изменением кровотока по этим сосудам после фармакотеста с ВАСС. Можно предположить, что только благодаря более развитой сети артериовенозных анастомозов, гемодинамические изменения в процессе эрекции в системе дорсальных артерий менее выражены, чем в системе глубоких артерий.
У больных в фазе покоя (ER0) Vmax снижена на 12,4%, IR – на 2%, IP повышена на 15,2%, в фазе незначительной тумесценции (ER1) Vmax снижена на 10,8%, IR – на 13%, IP – на 4%, в фазе неполной тумесценции (ER2) Vmax снижена на 8,7%, IR - на 11%, IP – на 4%, в фазу полной тумесценции (ER3) Vmax снижена на 19,8%, IR – на 26,8%, IP повышен на 72%, в фазу полуригидной эрекции (ER4) Vmax снижена на 19,6%, IR - на 6,4%, IP - на 3,5%, в фазу полной ригидности (ER5) Vmax снижена на 16,7%, IR - на 6,5%, IP - на 3,8% по сравнению с нормативными данными, что показывает достоверное снижение гемодинамики в 1,2-1,3 раза в кавернозных артериях полового члена при циклических изменениях индуцированной эрекции.
Таблица 4. Динамические изменения допплерометрических показателей в кавернозных артериях полового члена при циклических изменениях эрекции у больных хроническим простатитом и у здоровых мужчин
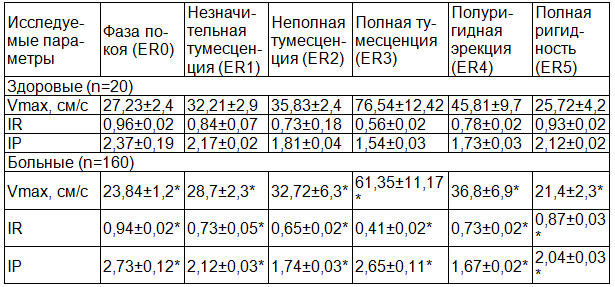
Примечание: * - р<0,05 по сравнению со здоровыми.
Для объективизации исследования в качестве критерия оценка артериальной составляющей пенильного кровотока определяли коэффициент IR (отношение IR в стадии тумесценции к его значению в состоянии релаксации), который у здоровых составил 0,66±0,02 и у больных – 0,60±0,01 (р<0,05); коэффициент IP у здоровых составил 0,65±0,02 у больных – 0,70±0,01 (р<0,05). Мы ввели термин «коэффициент артериальной эректильной функции» (отношение коэффициента IR к коэффициенту IP), показывающие степень устойчивости эрекции в период имиссии и в течение фрикционного периода: так, у здоровых коэффициент артериальной эректильной функции составляет 1,0±0,01, у больных – 0,85±0,02 (р<0,05), из чего следует, что у больных ХП имеется неустойчивость эрекции как в прелиминарный, так и фрикционный периоды.
Допплерометрические исследования показали, что у 98 (61,3%) больных глубокая дорсальная вена в фазу эрекции не спадалась, и кровоток по ней определялся в течение всего периода исследования, т.е. проба Вальсальвы при натуживании была положительной, что свидетельствовало о возможной окклюзии клапана или несостоятельности глубоких вен полового члена и вен таза, признаках венокорпоральной дисфункции. У больных выявлено увеличение диаметра глубокой дорсальной вены, увеличение скорости кровотока в ней в фазу тумесценции (ER3) в 1,3 раза (2,2±0,2 см/с) по сравнению с нормой (1,7±0,2 см/с, р<0,05), увеличение скорости кровотока в фазу ригидной эрекции (ER5) в 1,3 раза (2,1±0,3 см/с) по сравнению с нормой (1,6±0,2 см/с, p<0,05) и изменение кровотока на противоположный в результате возникновения ПВД. У остальных 62 (38,7%) больных проба Вальсальвы была отрицательной, т.е. глубокая дорсальная вена спадалась, и кровоток в ней не определялся в течение всего исследования, что характеризовало состоятельность вены, отсутствие ретроградного кровотока.
Артериальная недостаточность кавернозных тел, выявленная у 35 (21,9%) больных, проявлялась триадой: ослабление спонтанных и адекватных эрекций – у 35 (100%), удлинение времени сексуальной стимуляции для достижения эрекции – у 32 (91,4%), усиление эрекции после пенетрации во влагалище – у 30 (85,7%) больных. Симптом ожидания неудачи выявлен у 12 (34,3%) больных, который усиливает артериальную недостаточность путем повышения симпатического тонуса и последующей констрикции артерий [8].
У больных с венозной ЭД, выявленной у 57 (35,6%), были характерны: невозможность «удержать» эрекцию во время полового акта – у 57 (100%), детумесценция до эякуляции – у 39 (68,4%), улучшение эрекции в ортостатических позах – у 35 (61,4%), платообразный, стертый оргазм – у 22 (38,6%), уменьшение продолжительности и интенсивности спонтанных и адекватных эрекций – у 42 (73,7%) больных. Платообразный, стёртый оргазм можно объяснить не только органическими изменениями семявыносящего бугорка при ХП, но и его венозным полнокровием [10]. Причины венозной ЭД могут быть как врожденные, так и приобретенные. К врожденным причинам относят генетически детерминированные особенности строения венозной системы полового члена в сочетании с заболеванием вен другой локализации [13]. Отправной точкой для развития приобретенной венозной ЭД является ишемия кавернозной ткани, приводящая к функциональным изменениям – эндотелиальной дисфункции, и в последующем – к морфологической стадии склероза кавернозных тел [9,10].
Артериовенозная (смешанная) ЭД выявлена у 41 (25,6%) больного и характеризуется триадой сексологической семиотики: ослабление эрекций во время фрикций – у 32 (78%), снижение спонтанных и адекватных эрекций – у 31 (75,6%), детумесценция до эякуляции – у 29 (70,7%).
При психогенной ЭД, которая выявлена у 27 (16,9%) больных, ответ на интракавернозное введение каверджекта соответствует нормативным данным. Мы согласны с мнением ряда исследователей, что изменения гемодинамики у больных с первичной психогенной ЭД вызваны высоким симпатическим тонусом сосудов полового члена [1,8,10]. С нашей точки зрения, это можно объяснить дисфункцией симпатоадреналовой системы с высоким уровнем катехоламинов, который приводит к активации α2-адренорецепторов пенильных сосудов и гладкомышечных элементов кавернозных тел, что вызывает вазоконстрикцию артерий в стадии релаксации, но при насильственном дилатирующем эффекте фармакотеста его действие нивелируется [6].
Критерии ультразвуковой допплерометрии пенильной гемодинамики позволили выделить у 133 (83,1%) больных ХП с ЭД сосудистые нарушения: у 35 (21,9%) – артериальную, у 57 (35,6%) – венозную, у 41 (25,6%) - артериовенозную (смешанную) недостаточность пенильной гемодинамики и у 27 (16,9%) – психогенные формы ЭД. По-видимому, у 83,1% больных ХП сосудистый фактор является «пусковым механизмом», после чего происходит титуляризация на самом высшем иерархическом церебро-кортикальном уровне.
У больных концентрация Т в крови снижена в 1,2 раза (11,36±1,52 нмоль/л) по сравнению с нормой (13,58±1,29 нмоль/л, р<0,05).
Обсуждение полученных результатов. Эрекция – сосудистый феномен, выраженность которого зависит от баланса между притоком артериальной и оттоком венозной крови от полового члена [2,4]. Парасимпатическая иннервация, сопровождаемая уменьшением симпатической стимуляции, приводит к расслаблению гладкой мускулатуры артерий полового члена и кавернозной ткани. Это приводит к увеличению артериального кровотока и накоплению крови в синусоидальной ткани. Возникшее увеличение кавернозных синусов и пенильное давление уравновешиваются с помощью стенок белочной оболочки, что приводит к компрессии эфферентных подоболочечных вен и уменьшению венозного оттока (веноокклюзионный механизм) [8,15].
Доказано, что Т влияет на все механизмы эрекции обеспечивает синтез оксида азота (NO) в эндотелии и в нервных окончаниях, влияет на NO-независимые пути вазодилатации в половом члене, регулирует активность фосфодиэстеразы 5 типа, влияет на структуры гладкомышечных клеток, кавернозного нерва, эндотелия и соединительной ткани полового члена [12,13]. С помощью ультразвуковой допплерографии было установлено, что у мужчин с андрогенодефицитом заместительная андрогенотерапия улучшает кровообращение кавернозных артерий [3,7]. Снижение уровня Т в крови ведет к ухудшению фиброэластических свойств полового члена, утолщению белочной оболочки вследствие усиленного фиброзирования (повышение содержания коллагеновых волокон и снижение эластических), накопления жировых клеток, гипоплазии гладкомышечных клеток [4,5,14]. Подобные изменения белочной оболочки выражаются в несостоятельности веноокклюзионного механизма эрекции [14].
Понижение уровня Т вызывает гипоплазию гладких миоцитов стенок артерий полового члена, что приводит к уменьшению эластичности эндотелия и, как следствие, к снижению скорости кровотока с дальнейшим развитием артериальной ишемии и венозного стаза. Сниженный артериальный приток крови может быть как причиной, так и следствием эндотелиальной дисфункции, что приводит к гистологическим и функциональным повреждениям сосудистой стенки [5]. Гипоандрогения вызывает повреждение эндотелия в виде воспалительных изменений и образования бляшек [4,8,15].
Кроме того, тестостеронзависимо снижается синтез NO – главного нейромедиатора эрекции, который вырабатывается нервами гладкой мускулатуры полового члена и эндотелием [1,2,9]. Снижение кровоснабжения органов-мишеней приводит к замедлению процессов окислительного фосфорилирования в митохондриях, особенно стероид-продуцирующих клеток Лейдига, вызывая в них ацидоз, а впоследствии – дистрофию и снижение продукции Т. В условиях гипоксии происходит дистрофия миелинового нервного волокна и замедление проведения нервного импульса, а значит – угнетение рефлекторно-сосудистого акта. При УЗИ эти изменения проявляются утолщением и повышением эхогенности белочной оболочки, увеличением соотношения интима-медиа кавернозной артерии, снижением ИВЯ, снижением IR в сосудах полового члена [8,14]. Выявлена прямая связь: при повышении уровня Т увеличивается площадь кавернозных тел, интракавернозное давление и улучшается эластичность эндотелия [7].
Corona G. et al. [4] указывают, что гипотрофия гладких миоцитов с признаками мышечной дегенерации и увеличение количества адипоцитов (приводящее к формированию между кавернозными телами и белочной оболочкой своеобразной «подушки»), развитие фиброза белочной оболочки приводят к нарушению мышечной дилатации (пассивной окклюзии), что, в свою очередь, приводит к развитию венооклюзионной ЭД. Таким образом, веноокклюзионная ЭД – симптом дисфункции кавернозных тел, а не первичное поражение вен.
В ряде работ [8,14] показано, что причиной нарушения венозной окклюзии являются фиброз и замещение тканей трабекул жировыми клетками, что препятствует нормальному механизму эрекции за счет снижения эластичности кавернозной ткани. При длительном отсутствии эрекций (ночных или коитальных) происходит замещение мышцы пещеристых тел рубцовой тканью. Трабекулярный фиброз со снижением количества эластичных и увеличением коллагеновых волокон препятствует ригидной эрекции [15]. Ультраструктурные изменения, возникающие в кавернозных телах, сходны с таковыми в стенках самых мелких пенильных артерий [6]. Ишемия способствует повышению количества активных форм кислорода, снижению продукции гладкомышечными клетками индуцируемой синтазы NO и запускает механизм экспрессии трансформирующего фактора роста β1, который индуцирует синтез и способствует аккумуляции коллагена в межуточном веществе кавернозных синусов и стимулирует рост фибробластов. Локальный фиброз кавернозной ткани приводит к нарушению эластичности вен пассивного запирательного механизма и формированию артериовенозных фистул [10]. Повреждения, вызванные фиброзом, приводят к снижению индукции NO [6].
Развитие венооклюзионной ЭД обусловлено несостоятельностью пассивного механизма эрекции из-за структурно-органических изменений белочной оболочки и подоболочечного пространства, выявляемой при УЗИ полового члена при фармакологическиой тумесценции в виде ПВД. Ухудшение сократительной активности бульбокавернозных и исхиокавернозных мышц при дефиците Т приводит к нарушению блокирования круарных и глубоких пенильных вен в ригидной стадии эрекции и как следствие – к ПВД. У мужчин с ПВД было обнаружено ослабление гладкой мускулатуры [10]. Исследования последних лет показали, что в сосудах и гладких мышцах эндотелия находятся рецепторы Т, снижение концентрации которого может приводить к гемодинамическим нарушениям в органах-мишенях [7].
Заключение. При допплерометрии артериальная недостаточность кавернозных тел выявлена у 21,9%, венозная - у 35,6%, артериовенозная - у 25,6%, психогенная ЭД – у 16,9% больных.
У больных диаметр кавернозной артерии в стадии релаксации уменьшен до 0,81±0,02 мм по сравнению со здоровыми (0,86±0,03 мм, р<0,05), в стадии тумесценции – до 1,18±0,03 мм по сравнению со здоровыми (1,21±0,03 мм, р<0,05), ЭП в стадии релаксации снижена до 0,9±0,3 см2 по сравнению с нормой (1,2±0,3 см2, р<0,05), в стадии тумесценции – до 2,3±0,2 см2 по сравнению с нормой (2,7±0,3 см2, р<0,05), белочная оболочка в стадии релаксации утолщена до 1,2±0,2 мм по сравнению с нормой (1,0±0,2 мм, р<0,05), в стадии полной ригидности - до 0,7±0,1 мм по сравнению с нормой (0,5±0,1 мм, р<0,05), что показывает снижение эластотонических свойств кавернозных артерий и кавернозных тел, несостоятельность белочной оболочки с развитием ПВД.
У 61,3% больных выявлены увеличение скорости кровотока в глубокой дорсальной вене в фазу тумесценции до 2,2±0,2 см/с по сравнению с нормой (1,7±0,2 см/с, р<0,05), увеличение скорости кровотока в фазу ригидной эрекции до 2,1±0,3 см/с по сравнению с нормой (1,6±0,2 см/с, p<0,05), что указывает на развитие ретроградного кровотока и ПВД.
У больных концентрация Т в крови снижена до 11,36±1,52 нмоль/л по сравнению с нормой (13,58±1,29 нмоль/л, р<0,05). Ряд исследователей [7,9,11,15] указывают, что снижение уровня Т в крови ведет к снижению гемодинамики в кавернозных телах, ухудшению фиброэластических свойств полового члена, утолщению белочной оболочки вследствие усиленного фиброзирования, накопления жировых клеток, гипоплазии гладкомышечных клеток.
