Актуальность. Как известно, вегетативная нервная система одной из первых реагирует на любое стрессовое воздействие [1,2]. Ведущей защитной антистрессовой системой организма является симпато-адреналовая система, медиаторы которой – биогенные амины – выступают в роли своеобразных патофизиологических посредников между эндогенными и экзогенными стрессогенными факторами и органно-тканевым метаболизмом [3,4]. В последние годы активно развивается междисциплинарная метаболическая концепция патогенеза урологических заболеваний, в частности, такого распространенного заболевания, как абактериальный хронический простатит [5,7,10,12,14]. Существующие сложности его современного лечения во многом связаны с неясностью до сих пор многих механизмов патогенеза этой формы заболевания [5,7]. Изучение обмена биогенных аминов как медиаторов первой линии системной реакции на любое стрессовое воздействие могло бы привнести существенный вклад в новое понимание патогенеза абактериального хронического простатита, тем более, что в литературе ранее уже описаны так называемые «стресс-простатиты», однако, их механизмы до сих пор неясны [13]. Исследование обмена биогенных аминов в ткани предстательной железы у больных в клинической практике по понятным причинам невозможно. Вот почему экспериментальные модели на лабораторных животных могут предоставить уникальные данные о начальных нарушениях обмена биогенных аминов в ткани предстательной железы, патогенетическую роль которых при экстраполяции на когорту больных еще предстоит оценить как исследователям-патофизиологам, так и врачам-клиницистам.
Цель исследования: изучить влияние острого стресса на обмен биогенных аминов в ткани предстательной железы и уровень общего тестостерона в крови у животных и провести клинические параллели с больными абактериальным хроническим простатитом категории IIIA (ХП-IIIA) и категории IIIB (ХП-IIIB) (Классификация NIDDK/NIH) [15] в клинической практике.
Материал и методы исследования. Экспериментальная часть исследования выполнена на 100 белых беспородных крысах – самцах весом 180-200 г. Поскольку клиницист имеет дело с весьма неоднородной популяцией людей, то большой интерес представляют именно беспородные животные, имеющие более широкую норму реакции, чем линейные особи. Это позволяет с большой точностью экстраполировать результаты эксперимента на человеческий коллектив. С лабораторными животными работали в соответствии с действующими «Правилами проведения работ с использованием экспериментальных животных» [6]. Все животные находились в одинаковых условиях обитания и кормления и были разделены на две группы: одной группе белых крыс выполнялась нефрэктомия – экспериментальная модель острого стресса (70 крыс), вторая группа животных явилась контрольной (30 крыс). В обеих группах до операции и на 7, 16 и 30 сутки после нее в ткани простаты определяли уровни биогенных аминов (адреналин, норадреналин, дофамин, гистамин, серотонин, 11-оксикетостероиды (11-ОКС)), а в крови - уровень общего тестостерона.
Расчет показателей биогенных аминов в ткани простаты производился в мкг/мл и мкг/г, а уровень тестостерона в крови измерялся в нг/мл (радиоиммунный метод). Клиническая часть исследования выполнена на 250 больных абактериальным хроническим простатитом, диагноз которого установлен на основании критериев NIDDK/NIH [15] и EAU [9]. Средний возраст больных 43,7±4,5лет, у всех определяли характер кожного дермографизма при штриховой пробе на предплечье (маркер функционального состояния вегетативной нервной системы), протеолитическую активность плазмы крови (по накоплению тирозина (количественное определение с реактивом Фолина при 30-минутной инкубации сыворотки крови с белками донорской плазмы), показатели выражались в у.е.) и уровень общего тестостерона в крови (радиоимунным методом) (нижний референт значений принимали за 3,46 нг/мл) (Рекомендации ISSAM) [11]. Всем больным с окружностью талии ≥ 94 см выставлен диагноз «Ожирение» (Критерии IDF) [8]. Группу клинического контроля составили 30 здоровых мужчин в возрасте 30-50 лет. Статистический анализ данных исследования проводился с использованием набора статистических программ Statistica Window v.6.0. Статистически значимым для всех показателей считался критерий достоверности p<0,05. Корреляционный анализ проведен с использованием r-критерия Пирсона для непрерывных величин.
Результаты и их обсуждение. Результаты эксперимента показали, что в предстательной железе стрессированных животных к 7 дню эксперимента уровень адреналина падал в 3,2 раза, затем несколько повышался к 16 дню (+60% к 7 дню, но -48% к контролю) и выражено возрастал на 65% к окончанию эксперимента (p<0,05).
Концентрация норадреналина в ткани предстательной железы на 7 день повышалась в 1,8 раза, а затем до конца эксперимента стабилизировалась на повышенном уровне +20% от интактного контроля (p<0,05). Уровень 11-ОКС на 7 и 16 сутки эксперимента недостоверно повышался по сравнению с интактным контролем (p>0,05). Уровень дофамина в простате на 7 день резко увеличивался в 3,2 раза, затем резко снижался к 16-му дню (-81% к 7 дню и -43% к контролю) и нормализовался к 30 дню. В предстательной железе дефицит дофамина в целом оказался не столь выраженным и длительным, как дисбаланс катехоламинов. Динамика обмена гистамина в ткани предстательной железы характеризовалась так называемыми патофизиологическими «качелями»: его уровень к 7 дню достоверно падал на 31%, затем к 16 дню поднимался в 2 раза и оставался достоверно высоким (+69% по отношению к контролю) к окончанию эксперимента (p<0,05).
Аналогичным образом был нарушен обмен серотонина в простате у стрессированных животных: его уровень на 7 день повышался на 31%, затем к 16 дню резко увеличивался в 3,2 раза и оставался достоверно более высоким (+132%) до конца эксперимента (p<0,05).
На фоне острого стресса выявлено достоверное снижение уровня общего тестостерона в крови у животных уже на 7 день эксперимента (-32% по сравнению с контрольной группой) (p<0,05). К 16 дню эксперимента у испытуемых животных отмечалось дальнейшее прогрессирующее снижение уровня общего тестостерона по отношению к исходному уровню на - 38 % (p<0,05). К концу эксперимента уровень эндогенного тестостерона в крови оставался достоверно ниже исходных показателей (-23%) (p<0,05).
Прогрессирующее снижение уровня общего тестостерона в крови животных в ходе всего эксперимента положительно коррелировало с высокими уровнями гистамина (n=70; r=+0,34, p<0,05) и серотонина (n=70; r=+0,42; p<0,05) в ткани предстательной железы, что свидетельствовало о наличии связи между уровнем андрогенной насыщенности и состоянием микроциркуляторного русла предстательной железы, так как гистамин и серотонин являются патофизиологическим маркерами нарушений микроциркуляции.
Проведенное экспериментальное исследование продемонстрировало существенную патофизиологическую роль медиаторов симпато-адреналовой системы в патогенезе нарушений органного кровотока в предстательной железе, которые оказались более выраженными на уровне ее микроциркуляторного русла. Более того, острый стресс обладал выраженным ингибирующим эффектом на стероидогенез, особенно выраженным в течение первых 16 суток эксперимента.
Нарушения стероидогенеза можно было трактовать как острый стресс-индуцированный функциональный андрогенный дефицит. Вполне очевидно, что инициируемый острым стрессом андрогенный дефицит может быть дополнительным сосудистым фактором риска развития сначала функциональных, а затем и органических нарушений метаболизма предстательной железы, о чем свидетельствовали полученные экспериментальные данные (рис. 1.).
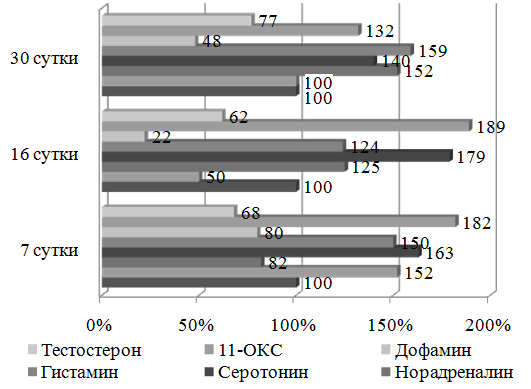
Рис. 1. Динамика биогенных аминов в ткани предстательной железы и тестостерона в крови у крыс при экспериментальном стрессе.
Клинические исследования у больных абактериальным хроническим простатитом категории III показали, что признаки повышения тонуса симпатического отдела вегетативной нервной системы имели место в целом у 62,9% этих больных, однако, указанный феномен чаще наблюдался у больных ХП-IIIB по сравнению с больными ХП-IIIA (68,6% против 57,3%, p<0,05). При исследовании протеолитической активности плазмы крови у больных абактериальным хроническим простатитом получены данные, которые свидетельствовали о существенном повышении активности системы перекисного окисления липидов у больных ХП-IIIB в сравнении с больными ХП-IIIA (p<0,05). При этом у всех больных абактериальным хроническим простатитом независимо от его категории отмечалось достоверное повышение протеолитической активности плазмы крови в отношении группы контроля (p<0,05). У больных ХП-IIIA наблюдалось умеренное повышение протеолитической активности плазмы крови, а частота абсолютно высоких уровней показателя протеолитической активности плазмы крови составила 40,0% . Для больных ХП-IIIB было характерно существенное повышение протеолитической активности плазмы крови, которое достоверно отличалось как от показателей первой группы, так и от группы контроля (p<0,05). При этом высокие абсолютные показатели протеолитической активности плазмы крови наблюдались у 65,0% больных ХП-IIIB (p<0,05). Результаты исследований позволили предположить, что клиническое течение ХП-IIIB происходило в условиях более выраженной активации системы перекисного окисления липидов крови, которая носила преимущественно системный характер (системный оксидативный стресс). Корреляционный анализ продемонстрировал более высокие показатели протеолитической активности плазмы крови у больных ХП-IIIB с более выраженным ожирением (n=20; r=+0,108; p<0,05).
Частота андрогенного дефицита у больных абактериальным хроническим простатитом в целом зависела от возраста больных, что отражало общебиологические тенденции возрастного дефицита тестостерона. Однако, скорость возрастного снижения уровня общего тестостерона крови была более быстрой у больных ХП-IIIB (p<0,05). Между выраженностью ожирения (окружность талии) и уровнем общего тестостерона в крови у них была выявлена отрицательная корреляционная связь (n=250; r=-0,322; p<0,05), что подчеркивало теснейшие патогенетические связи между ожирением и андрогенным дефицитом у мужчин.
Заключение. Нарушения обмена биогенных аминов в ткани предстательной железы под воздействием острого стресса вызывали существенные гемодинамические и трофические нарушения в органе, реализуемые через сосудистые реакции вазоконстрикторного типа и посредством нарушений микроциркуляции. Индуцированный стрессом острый функциональный дефицит тестостерона мог быть отражением патофизиологических негативных эффектов указанных медиаторных нарушений преимущественно сосудосуживающего характера на паренхиму яичек лабораторных животных, так и, возможно, самостоятельным фактором дальнейшего метаболического дисбаланса в ткани предстательной железы, усугубляя индуцированные медиаторной «бурей» механизмы клеточного простатического повреждения.
Проведенные параллели между экспериментальными и клиническими данными показали, что практически все патофизиологические реакции, выявленные у лабораторных животных в крови и ткани предстательной железы, имели место и у больных абактериальным хроническим простатитом в виде соответствующих клинических и лабораторных знаков.
На основании проведенного исследования можно сделать вывод, что стресс может быть пусковым механизмом простатического клеточного повреждения, а его медиаторами являются системные гормональные нарушения и дисбаланс биогенных аминов, ведущие, прежде всего, к функциональной перегрузке простатического кровоснабжения и нарушению органного метаболизма. Стресс-индуцированные гормонально-медиаторные нарушения являются одним из начальных (доклинических) этапов патогенеза заболеваний предстательной железы у человека. Для уточнения полученных клинико-экспериментальных данных необходимы дальнейшие углубленные исследования.
