Хронический простатит (ХП) занимает одно из первых мест в структуре урологической патологии [1,7], вызывая нарушения репродуктивной, сексуальной функции, психо-эмоциональной и вегето-сосудистой сферы. Учитывая отсутствие при ХП явных микробиологических причин [1,8,15] для возникновения заболевания, взгляды исследователей были направлены на поиск иных механизмов патогенеза воспаления предстательной железы (ПЖ). Среди главных патогенетических механизмов развития ХП отмечают иммунологические нарушения [1,3,6,8], которые по данным ряда исследователей [6,8] отмечаются у 70-75% больных.
При ХП происходят изменения местного и системного иммунитета, как клеточного, так и гуморального звеньев, факторов неспецифической защиты [6,7]. Однако, имеется недостаточная изученность иммунных изменений у больных ХП с помощью высокочувствительных лабораторных методов исследования.
Цель исследования: с помощью высокочувствительных лабораторных методов исследования изучить клинико-иммунологическое состояние у больных ХП.
Материалы и методы. Под нашим наблюдением находилось 160 больных ХП в возрасте от 22 до 45 лет (средний возраст 34,5±2,5 лет), имеющих жалобы на ЭД от 6 мес. до 7 лет (в среднем 3,9±0,8 года). Для диагностики ХП использовали систему диагностических признаков, разработанную с учётом рекомендаций Международной согласительной конференции по улучшению диагностики и лечения простата и алгоритма обследования пациентов с ХП. Специальными методами исследования у больных выявлен хронический абактериальный простатит (по классификации NIH категория III А, III В и IV).
Исследованию подвергались сыворотка крови, лимфоциты периферической крови и секрет ПЖ. Выделение лимфоцитов из крови проводили на градиенте плотности фиколл-верографина, их фенотип определяли методом иммуноферментного анализа с помощью моноклональных антител (ООО «Сорбент», Москва) к структурам СД3 (Т-лимфоциты), СД4 (Т-хелперы), СД8 (Т-супрессоры, цитотоксические клетки), СД19 (В-лимфоциты).
Содержание иммуноглобулинов (Ig) А, М, G производили с помощью стандартных наборов фирмы «Abbot» методом нефелометрии на приборе фирмы «Abbot TDX-analyzer» (США). Концентрацию циркулирующих иммунных комплексов (ЦИК) определяли по методу Anh-Tuan N., Novac E.
Фагоцитарную активность нейтрофилов периферической крови оценивали по проценту фагоцитоза (ПФ), фагоцитарному числу (ФЧ) и индексу активности фагоцитоза (ИАФ) [2]. Функциональную активность нейтрофилов определяли по реакции восстановления нитросинего тетразолия (НСТ-спонтанный (сп.), НСТ-индуцированный (инд.), индексу стимуляции нейтрофилов (ИСН) [13], токсинов средней молекулярной массы («средние молекулы» - СМ) [2]. Содержание s IgA в секрете ПЖ определяли методом радиальной иммунодиффузии, используя диагностический набор ООО НПЦ «Медицинская иммунология» (Москва).
Количественная оценка уровней фактора некроза опухоли α (ФНОα), интерлейкинов 1β (ИЛ-1β), ИЛ-6 и ИЛ-4 в сыворотке крови и секрете ПЖ проводилась с помощью набора реагентов Pro-Con (ООО «Протеиновый контур», Санкт-Петербург) методом твердофазного иммуноферментного анализа.
Контрольную группу составили 20 здоровых мужчин в возрасте от 22 до 45 лет (в среднем 33,4±1,3 года). Статистическая обработка полученных результатов проведена на компьютере типа IBM PC/AT с использованием пакета программного обеспечения статистического анализа «Stat-graph». Уровень надежности составил не менее 95%.
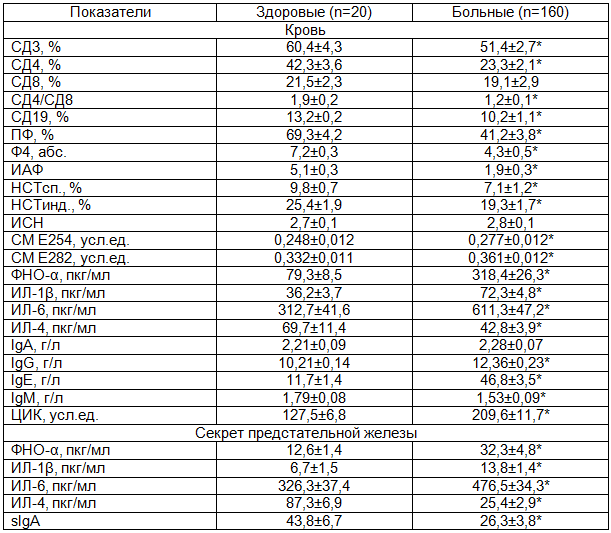
Результаты исследования и обсуждение. Наличие снижения количества СД3 и СД4-клеток, СД4/СД8 у больных ХП (табл. 1) свидетельствуют об относительном истощении возможностей иммунной системы или неспособности последней к выработке адекватного ответа на антигенный раздражитель [12], что поддерживает вялотекущий воспалительный процесс в ПЖ. Снижение СД4/СД8 (1,2±0,1) по сравнению со здоровыми (1,9±0,2, р<0,05) указывает на несостоятельность цитотоксической составляющей иммунного ответа при ХП.
Известно, что Т-хелперы выполняют хелперно-регуляторную функцию во взаимодействии иммунокомпетентных клеток, направленную на развитие эффекторной фазы иммунного ответа. Недостаточность хелперной функции Т-лимфоцитов приводит к «неотвечаемости» организма на антигенную стимуляцию, что способствует персистенции в организме человека большого количества микроорганизмов, их токсинов [9,10,12]. От функционального состояния Т-супрессоров зависит развитие аутоиммунных, иммунодефицитных, аллергических заболеваний, гиперчувствительности замедленного типа. При дисбалансе соотношений Т-хелперов и Т-супрессоров создается благоприятный фон для развития аутоиммунных и аллергических заболеваний, иммунодефицитных состояний [12,14,15].
Иммуноглобулины в организме выполняют защитные функции, начиная от формирования иммунокомплексов, процессов опсонизации и заканчивая участием в формировании антигенпредставляющего комплекса при развитии первичного или вторичного иммунного ответа. Некоторые из них с небольшой молекулярной массой, в частности, sIgA, способны проникать через эндотелий капилляров в интерстициальное пространство, в области кожных покровов и слизистых оболочек, играя там существенную роль в их барьерной функции [9,12].
Содержание IgG было повышено, что свидетельствует о наличии хронического воспалительного процесса [8,9,12]. По мере длительности ХП возрастает концентрация IgG в крови, что имеет высокую корреляцию (r=0,87, р<0,05). Очевидно, это связано с тем, что IgG продуцируются на более поздних этапах заболевания.
У больных выявлена выраженная антигенная стимуляция, о чем свидетельствует обнаруженное повышение показателей содержания IgE, IgG, ЦИК. ЦИК образуются в организме при взаимодействии с микробными и другими антигенами и основная роль в их элиминации принадлежит полинуклеарам и тканевым макрофагам. Увеличение концентрации ЦИК у больных ХП указывает на снижение супрессивного влияния Т-лимфоцитов на «запретные» клоны В-лимфоцитов и активизацию аутоиммунного компонента, который поддерживает состояние хронического воспаления [14,15]. Избыточное количество ЦИК, накапливающееся в крови и превышающее «емкость» фагоцитарной системы, способно вызвать изменения стенок сосудов ПЖ, приводить к нарушению микроциркуляции. Эти данные соответствуют представлениям об участии иммунных механизмов в патогенезе ХП [1,14,15].
У пациентов отмечено снижение фагоцитарной активности нейтрофилов и их кислородзависимой активности, о чем свидетельствует снижение ПД, ФЧ, ИАФ и НСТинд. Нейтрофилы осуществляют первую линию защиты от антигенов различной природы благодаря их основной функции - фагоцитарной. Наряду с этим нейтрофилы участвуют в регуляции активности базофилов и тучных клеток, секретируя в очаг воспаления вещества, вовлекающие данные клетки в воспалительную реакцию. В то же время нейтрофилы относятся к клеткам-эффекторам поздней фазы воспаления, и от их функциональной активности во многом зависит течение и исход воспалительного процесса. Следовательно, функциональный потенциал нейтрофилов и пути его реализации имеют большое значение в развитии воспалительных заболеваний [9,10,12].
Таблица 1. Показатели системного и местного иммунитета у больных хроническим простатитом и у здоровых мужчин
Примечание: * - p<0,05 по сравнению со здоровыми.
Спонтанный НСТ-тест с интактными нейтрофильными гранулоцитами отражает степень функционального раздражения фагоцитарных клеток (ФК) in vivo, являясь косвенным показателем состояния гомеостаза. По данным теста была отмечена значительная декомпенсация функции ФК. Аналогичные результаты получены при анализе НСТ-стимулированного теста, который характеризует потенциальную активность нейтрофилов и рассматривается как биохимический критерий их готовности к завершению фагоцитоза, снижение этих показателей позволяет диагностировать блокаду выработки кислородзависимых бактерицидных факторов.
В условиях ХП у пациентов выявлена супрессия как фагоцитарной, так и кислородзависимой активности нейтрофилов периферической крови, что, вероятно, объясняется местным и системным хроническим воспалительным процессом, имеющим место у данной категории пациентов. С одной стороны, макрофагальная система больных ХП не реагирует на основное заболевание, с другой стороны, макрофаги не способны отвечать адекватной фагоцитарной активностью на внешний раздражитель. Вероятно, низкая активность фагоцитов приводит к увеличению содержания в крови ЦИК.
Информационная «связь» между клетками иммунной системы осуществляется различными способами: за счет всевозможных рецепторов и их ассоциаций, а также за счет выделяемых клетками особых белков – цитокинов, которые являются эндогенными полипептидными медиаторами межклеточного взаимодействия, регулирующими эмбриональное развитие, некоторые нормальные физиологические функции организма, защитные реакции при внедрении патогенов и развитии опухолей, а также при формировании аллергических, аутоиммунных и иных иммунопатологических реакций, процессов репаративной регенерации [4,12].
У больных как на гуморальном, так и на локальном уровнях наблюдалось повышение концентрации провоспалительных (ФНОα, ИЛ-1β, ИЛ-6) и снижение противовоспалительного (ИЛ-4) цитокинов. В повышенных концентрациях ФНОα активирует проапоптотические рецепторопосредованные сигнальные каскады, т.е. останавливает процессы клеточного деления и вызывает физиологическую гибель клеток [4]. Повышение провоспалительных цитокинов у больных ХП, по всей видимости, было недостаточным для развития полноценного воспалительного процесса, что показывает неполноценность и несоответствие иммунного ответа чужеродному агенту, которое способствует развитию вялотекущего воспалительного процесса в ПЖ [8,9].
Уровень СМ в крови был повышен, что указывает на синдром эндогенной интоксикации (СЭИ), который проявлялся у больных общей слабостью, снижением веса, нарушением сна и аппетита. Под СЭИ подразумевают симптомокомплекс клинических проявлений болезни, сочетающийся с нарушением макро- и микроциркуляции крови, обменных процессов, кислотно-основного равновесия, структурными и ультраструктурными изменениями в клетках органов и тканей. ХП, являясь деструктивно-воспалительным заболеванием, способствует накоплению токсинов СМ, которые вызывают нарушение микроциркуляции крови, инактивацию многих ферментов, эритропоэза, денатурацию белка, иммунодепрессивное состояние, угнетение функции ретикуло-эндотелиальной системы.
При анализе состояния иммунного статуса выявлено, что у 113 (70,6%) больных ХП снижен гуморальный, у 117 (73,1%) – местный иммунитет.
В настоящее время общепризнано существование двух основных типов защитной реакции организма человека: врожденного и адаптивного иммунитета [9,12]. Первой линией борьбы с инфекционным агентом служит неспецифический врожденный иммунитет [10], активация которого происходит уже через считанные минуты после попадания патогенных микробов [4]. Фактором, инициирующим реакции врожденного иммунитета, является первичное распознавание клетками миеломоноцитарного ростка «патоген-ассоциированных молекулярных образов» различных инфекционных агентов. Результатом данной активации является развитие последовательных этапов воспалительной реакции, направленных на нейтрализацию или ограничение патогена, с последующим восстановлением поврежденного участка ткани [5]. При этом естественными стимуляторами врожденного иммунитета являются фрагменты пептидогликанов клеточной стенки бактерий, образующиеся в процессе фагоцитоза [12].
Одним из ключевых событий в развитии воспалительной реакции является синтез провоспалительных цитокинов [4], стимулирующих большинство дальнейших событий и обеспечивающих активацию различных типов клеток, участвующих в регуляции и поддержании воспаления, включая все типы лейкоцитов, Т- и В-лимфоциты, натуральных киллеров, эндотелиальные клетки, фибробласты [9]. При этом для адекватного течения воспалительной реакции необходима закономерная смена направленности цитокинового профиля с про- на противовоспалительный.
Уже в период альтерации усиленный синтез провоспалительных цитокинов обеспечивает активацию Т- и В-лимфоцитов, натуральных киллеров, способствуя формированию «напряженного» состояния иммунной системы. Вероятно, вследствие гипоэргического ответа лимфоцитов и фагоцитирующих клеток, а также вследствие функциональной недостаточности последних у больных ХП развивался цитокиновый дисбаланс с детерминацией провоспалительной направленности, что, в конечном итоге, способствовало развитию неполноценного, несоответствующего силе антигенного раздражителя, вялотекущего воспалительного процесса [9,10,12].
У больных ХП наблюдается параллельное угнетение продукции лимфоцитов и их функциональной активности и дисфункция клеток моноцитарно-макрофагальной системы. Причиной последнего, вероятно, является как цитокиновый дисбаланс вследствие количественных и качественных изменений лимфоцитарного состава крови [11,12], так и пониженная синтезирующая и кислородпродуцирующая активность фагоцитирующих лейкоцитов (гипоэргическая реакция в ответ на антигенный раздражитель).
При оценке параметров цитокинового статуса у больных ХП можно прийти к выводу, что у данной категории больных развивается иммунное воспаление, сопровождающееся повышением содержания провоспалительных цитокинов (ФНОα, ИЛ-1β, ИЛ-6), снижением противовоспалительного ИЛ-4 и уровня sIgA, следствием чего является снижение барьерных свойств слизистой с замедлением процессов репаративной регенерации в ткани ПЖ.
Полученные данные показывают, что у больных ХП наблюдается торможение обоих форм иммунного ответа и угнетение системы иммунитета в целом, что формирует вторичный иммунодефицит [1,3].
