По данным ряда исследователей [1,3,6], хронический простатит (ХП) в 28-37% случаев вызывает бесплодие. Нарушения сперматогенеза у больных ХП могут быть причиной мужской инфертильности и аномалий у новорожденных [4,6]. Для прогнозирования оплодотворяющей способности сперматозоидов проводится анализ их морфологических признаков с использованием строгих критериев нормы, предложенных T.Kruger и соавт. [5]. Однако морфологические и биохимические особенности эякулята у больных ХП изучены недостаточно.
Цель исследования – изучить морфологические и биохимические показатели эякулята у больных ХП.
Материалы и методы. Обследовано 90 больных ХП в возрасте от 22 до 45 лет (в среднем 33,8±1,4 года) с длительностью ХП от 1 до 11 лет (в среднем 4,7±1,2 года), с длительностью бесплодия от 2 до 5 лет (в среднем 3,8±0,7 лет).
Всем пациентам проводилось обследование наружных половых органов, пальцевое исследование предстательной железы (ПЖ) и семенных пузырьков (СП), трансректальное ультразвуковое исследование (ТРУЗИ) ПЖ, ультразвуковое исследование яичек и их придатков. Изучали индекс образования сперматозоидов (ИОС), который рассчитывали путём деления количества спермы в объёме эякулята (концентрацию сперматозоидов в 1 мл умножают на объём эякулята) на объём яичек, концентрации антиспермальных антител (АСАТ) в сыворотке крови, лактатдегидрогеназы-Х (ЛДГ-Х), кислой фосфатазы (КФ), фруктозы, лимонной кислоты в эякуляте. Исследование эякулята и критерии его классификации осуществляли в соответствии с рекомендациями ВОЗ [7]. Строение сперматозоидов оценивали по классификации T.F.Kruger и соавт. [5].
Контрольную группу составили 100 здоровых мужчин (не имеющих хронических соматических заболеваний) в возрасте от 23 до 45 лет (в среднем 33,2±1,3 года) с сохранными фертильной (имеющих не менее 2 здоровых детей) и сексуальной функциями (проводящих вагинальные половые акты не менее 2-3 раз в неделю при 70-100% оргастичности у жены).
Статистическую обработку материала выполняли с использованием стандартных пакетов программ прикладного статистического анализа (Statgraphics v.7.0, Statistica for Windows v.5.).
Результаты и обсуждение. Установлено, что ни один из пациентов не подвергался действию гипертермии, промышленных ядов, ионизирующего излучения, не принимал наркотических и гормональных препаратов, не злоупотреблял никотином и алкоголем.
У больных выявлены высокий индекс (2,3±0,3) заболеваний, передающихся половым путём (ЗППП), которые в 56% случаев носили сочетанный характер (хламидиоз+микоплазмоз и т. д.), высокий (6,4±1,3) промискуитетный индекс (количество сексуальных партнёров), высокий инфекционный индекс (3,2±0,3).
При осмотре полового члена, крайней плоти пороков развития выявлено не было. У 57 (63,3%) больных отмечено снижение выраженности складчатости мошонки, у 47 (52,2 %) - снижение тонуса яичек и их чувствительности к пальпации. Размеры яичек у больных в среднем составляли 4,38 х 3,21 х 2,47 см, что не отличалось от контрольной группы (4,43 х 3,24 х 2,51 см, р<0,05). Придатки яичек, семенные канатики не имели признаков какой-либо патологии. Результаты пальцевого ректального исследования ПЖ имели корреляцию с данными, полученными при ТРУЗИ ПЖ (r=0,93, p<0,05). Специальными методами исследования у больных установлен ХП, исключены ЗППП. У всех больных концентрация простатоспецифического антигена (ПСА) в крови в среднем составила 2,6±0,7 нг/мл (норма - 3,2±0,3 нг/мл)/
Запах, цвет и рН эякулята у всех больных соответствовали норме. У 46 (51,1%) больных выявлено снижение объема эякулята, что подтверждает данные литературы о снижении объема эякулята при поражении СП [1,3,4]. Снижение объёма эякулята имело прямую корреляцию с повышением вязкости эякулята (r=0,93, p<0,05), со снижением концентрации сперматозоидов в 1 мл (r=0,71, p<0,01), с процентом сперматозоидов с прямолинейно-поступательным движением (r=0,79, p<0,01) при одновременном возрастании процента сперматозоидов с непрогрессивным движением (r=0,83, p<0,01) и дискинезией (r=0,85, p<0,02). Снижение объёма эякулята может быть вызвано ХП и частичной обструкцией семявыбрасывающего протока (ЧОСП) [3].
У 56 (62,2%) больных отмечено увеличение вязкости эякулята, что обусловлено либо снижением объема эякулята, либо высоким содержанием в нём слизи [1,2]. По данным исследователей [4,6], вязкость эякулята при олигоастенозооспермии (ОАЗС) была значительно выше, чем при нормозооспермии. Повышение вязкости эякулята у человека снижает оплодотворяющую способность спермы [3,4]. Это объясняется с одной стороны тем, что повышенная вязкость эякулята может мешать движению сперматозоидов в слизи [3], а с другой – в разной степени сочетаться с остальными видами нарушений оплодотворяющей способности спермы [4,6]. Снижение выработки ПСА приводит к плохому разжижению спермы [4], что доказано в нашей работе. У 10 (11,1%) больных отмечено снижение вязкости эякулята, что связано с нарушениями ферментативной, генеративной и эндокринной функции тестикул [1].
У 57 (63,3 %) больных выявлена олигозооспермия (ОЗС) 1-й, у 24 (26,7 %) – ОЗС 2-й, у 9 (10%) - ОЗС 3-й степени (ст.). Определялась высокая корреляция между степенью ОЗС от длительностью ХП: чем больше длительность ХП, тем в большей степени выражена ОЗС (r= 0,93, р<0,05). Выявлена корреляция между количеством спермиев в 1 мл эякулята и степенью их подвижности у больных (r=0,97, р<0,05). Так, у пациентов с ОЗС 1-й ст. астенозооспермия (АЗС) обнаружена в 12%, при ОЗС 2-й ст. - в 82 %, при ОЗС 3-й ст. - в 93% случаев. Наиболее выраженное увеличение вязкости эякулята отмечается при значительной ОЗС: от 0,1 до 5 млн/мл сперматозоидов.
Наиболее чувствительным параметром фертильности при повышенной вязкости эякулята является подвижность сперматозоидов [3]. Полученные нами данные свидетельствуют о том, что это первый показатель, который ухудшается при нарушенном разжижении спермы. При этом доля подвижных сперматозоидов категории [a + b] уменьшается, а доля категории [c] и процент сперматозоидов с дискинетическими движениями увеличиваются. АЗС 1-й ст. отмечена у 58 (64,4%), АЗС 2-й ст. - у 21 (23,3 %), АЗС 3-й ст. - у 11 (12,2%) пациентов. Наибольший процент изолированной АЗС выявлен у больных в возрасте 22-30 лет и этот показатель уменьшается с возрастом, что имеет высокую корреляцию (r=0,84, p<0,05). Изолированная АЗС определяется, очевидно, в фазе манифестации ХП. В дальнейшем происходят более глубокие дегенеративные и иммунологические изменения в тестикулах, приводящие к появлению ОЗС [1]. Перенесённые ЗППП и их осложнения оказывают негативное влияние на фертильность у мужчин [4] и вызывают снижение общего количества сперматозоидов [6].
У 42 (46,7 %) больных выявлена ТЗС 1-й ст., у 20 (22,2 %) - ТЗС 2-й ст. и у 2 (2,2 %) - ТЗС 3-й ст. Выявлена высокая корреляция между степенью ТЗС и количеством содержания клеток сперматогенеза в эякуляте (r=0,91, р<0,05). Преобладание больных с ОЗС, АЗС и ТЗС подтверждало данные литературы о повреждении сперматогенеза у больных с длительным течением ХП [3,4,6]. Ни в одном случае ТЗС не протекала самостоятельно, а находилась либо с АЗС или ОЗС. По всей видимости, тератоидные формы сперматозоидов подавляют прямолинейно-активную подвижность сперматозоидов, что имеет высокую корреляцию (r=0,91, р<0,05). ОАТЗС может быть вызвана ЧОСП или частичной блокадой сперматогенеза [3].
У больных ИОС был 1,93±0,06 при среднестатистическом объёме яичек 17,4±0,2 см3 , концентрации сперматозоидов в 1 мл 24,3±0,4 млн., объёме эякулята 2,8±0,3 мл3 по сравнению с контрольной группой, у которой ИОС был 3,54±0,12 при среднестатистическом объёме яичек 17,8±0,3 см3, концентрации сперматозоидов в 1 мл 36,2±0,3 млн., объёме эякулята 3,5±0,2 мл3. Таким образом, у здоровых мужчин 1 мл объёма тестикул продуцирует 3,54 млн. сперматозоидов, у больных – 1,93 млн., т. е. в 1,8 раза меньше по сравнению со здоровыми, что указывает на функциональную блокаду процесса спермиогенеза у больных ХП. Выявлена высокая корреляция между снижением ИОС и повышенной концентрацией АСАТ в крови (r=0,83, p<0,05), увеличением длительности ХП и снижением ИОС (r=0,76, p<0,05), снижением количества лецитиновых зёрен и снижением ИОС (r=0,74, p<0,05).
Основными свойствами эякулята являются: количество сперматозоидов во всём эякуляте, процент подвижных сперматозоидов и процент морфологически нормальных сперматозоидов [3]. Исходя из вышесказанного, мы ввели понятие «индекс пенетрации сперматозоидов» (ИПС), который характеризует оплодотворяющую способность эякулята. ИПС вычисляется при умножении объёма эякулята, количества сперматозоидов в 1 мл3 эякулята, процента активно подвижных сперматозоидов, процента морфологически нормальных сперматозоидов, делённое на количество сперматозоидов во всём эякуляте. Так, у больных ИПС снижен в 2 раза (24,1±1,7) по сравнению со здоровыми (47,4±2,8, р<0,05), что показывает снижение оплодотворяющей способности эякулята у больных ХП.
Наши исследования показали, что у 84,4% больных патологические состояния эякулята носили сочетанный характер: ОАТЗС 1 ст. выявлена у 44 (48,9%), ОАТЗС 2 ст. – у 19 (21,1%), ОАТЗС 3 ст. – у 2 (2,2%), ОАЗС 1 ст. – у 7 (7,8%), ОАЗС 2 ст. – у 2 (2,2%), ОАЗС 3 ст. – у 2 (2,2%), АТЗС 1 ст. – у 7 (7,8%), АТЗС 2 ст. – у 4 (4,4%), АТЗС 3 ст. – у 3 (3,3%). Следовательно, инфертильность наступает в тех случаях, когда имеется биологическая несостоятельность нескольких сперматологических показателей эякулята, характеризующих нормативные данные спермограммы.
У 64 (71,1%) больных выявлено повышение степени агглютинации сперматозоидов (САС), что имело высокую корреляцию между САС и длительностью ХП (r=0,97, р<0,05), между САС и концентрацией антиспермальных антител (АСАТ) в крови (r=0,73, p<0,05). Концентрация АСАТ в крови была увеличена в 1,3 раза (71,36±8,62 ммоль/мл) по сравнению с нормой (54,27±6,41ммоль/мл, р<0,05). Выявлена прямая корреляция между наличием АСАТ в крови и снижением подвижности сперматозоидов (r=0,76, p<0,05) и обратная между наличием АСАТ и снижением концентрации сперматозоидов (r=-0,64, p<0,05), т. к. АСАТ способны влиять на спермиогенез [4,6]. АСАТ могут нарушать оплодотворяющую способность сперматозоидов на различных уровнях, включая снижение продолжительности их жизни, подвижности и способности к пенетрации цервикальной слизи, а также нарушение взаимодействия сперматозоида и яйцеклетки [4,6]. Присутствие АСАТ сочетается с избыточным образованием свободных радикалов кислорода, что может дополнительно ухудшать качество спермы из-за окисления мембраны сперматозоидов, белков аксонемы и ДНК [4]. Ряд исследователей [2,3,4] считают, что выработку АСАТ вызывает ЧОСП вследствие ХП.
Резистентность сперматозоидов (РС) отражает степень функциональной зрелости сперматозоидов [2]. У 77 (85,6%) больных выявлена сниженная РС (6738,57±149,63) по сравнению с нормой (12756,83±168,47, р<0,05). Отмечена высокая корреляция между показателями РС и длительностью ХП: чем длительнее ХП, тем значительнее снижены показатели РС (r=0,94, р<0,05). При ОЗС различных степеней наблюдалось снижение РС (r=0,97, р<0,05).
Дыхательная способность сперматозоидов (ДСС) отражает степень полноценности сперматозоидов [2]. У 75 (83,3%) больных ДСС была снижена (94,7±12,2 мин) по сравнению с нормой (63,4±11,6 мин, р<0,05). Степень выраженности ДСС коррелировала с длительностью ХП: чем длительное течение ХП, тем более низкими были показатели ДСС (r=0,92, р<0,05). Отмечена высокая корреляция между ДСС и концентрацией фруктозы в эякуляте, ДСС и лимонной кислоты в эякуляте: чем ниже были концентрации фруктозы и лимонной кислоты в эякуляте у больных, тем более низкие степени были ДСС (r =0,94, р<0,05 и r=0,96, p<0,05 соответственно).
Количество лейкоцитов в эякуляте у больных было в пределах нормы. Количество лецитиновых зерен у 65 (73,3%) было сниженным (менее 20 млн/мл), что свидетельствовало о снижении функциональной активности ПЖ и коррелировало с длительностью ХП (r=0,93, р<0,05). У 66 (73,3%) больных феномен кристаллизации секрета ПЖ был снижен, что косвенно свидетельствовало о наличии гипоандрогении у больных ХП [1].
У больных ХП выявлено достоверное уменьшение содержания морфологически нормальных сперматозоидов по сравнению с контрольной группой (р<0,002, табл. 1). Отмечено значительное увеличение относительного содержания сперматозоидов с патологическими изменениями хвоста (р<0,005). Процентное содержание морфологически незрелых сперматозоидов (p<0,0001), сперматозоидов с аномалией срединного тела (р=0,025), сперматозоидов с изменёнными размерами головки (р=0,022) и сперматозоидов с лёгкой формой патологии головки (р<0,0001) у больных ХП было ниже, чем в контрольной группе. По данным ряда исследователей [4,3], в 80% случаев успешное оплодотворение происходит при содержании в образце спермы более 14% нормальных форм сперматозоидов. Плохой прогноз оплодотворения (<7,6%) наблюдается при содержании нормальных форм менее 5%. В сперматозоидах с серьёзными морфологическими нарушениями обнаружена более высокая частота возникновения хромосомных аномалий [6].
Таблица 1. Морфологические формы сперматозоидов (в %) у больных хроническим простатитом, оцененные с помощью методики строгой морфологии (М±m)
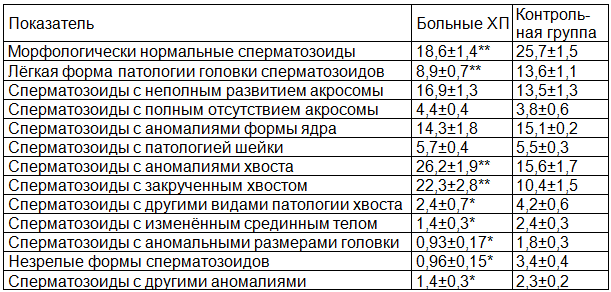
Примечание: * - р<0,05, ** - р<0,01 по сравнению с контрольной группой.
У больных снижен фруктолиз в эякуляте (2,67±0,21 ммоль/л) по сравнению с нормой (3,53±0,24 ммоль/л, р<0,05). У больных выявлено снижение концентрации фруктозы в эякуляте (12,74±1,17 ммоль/л) по сравнению с нормой (15,37±1,29 ммоль/л, p<0,05). Отмечена высокая корреляция между снижением концентрации фруктозы в эякуляте и длительностью ХП (r=0,96, р<0,05), между снижением концентрации фруктозы в эякуляте и снижением фруктолиза (r=0,94, р<0,05). ОЗС, снижение фруктозы в эякуляте со снижением его объёма свидетельствуют о ЧОСП [3].
У больных выявлено снижение (18,34±1,27 ммоль/мл) концентрации лимонной кислоты в эякуляте по сравнению с нормой (23,42±1,83 ммоль/мл,p<0,05). Выявлена высокая корреляция между концентрацией лимонной кислоты в эякуляте и длительностью ХП: чем длительное течение ХП, тем более снижена концентрация лимонной кислоты в эякуляте (r=0,95, р<0,05). Снижение концентрации фруктозы и лимонной кислоты в эякуляте косвенно свидетельствует о наличии дегенеративных изменений в придаточных половых железах и гипоандрогении у больных ХП с инфертильностью [1].
ЛДГ-Х у больных повышена в 1,3 раза (0,76±0,09 ммоль/мл) по сравнению со здоровыми (0,57±0,06 ммоль/мл, р<0,05). Отношение активности ЛДГ-Х к концентрации сперматозоидов составляет индекс функции герминативного эпителия (ИФГЭ). У больных ИФГЭ повышен в 2 раза (3,12±0,13) по сравнению со здоровыми (1,57±0,09, р<0,05), что свидетельствует о функциональной блокаже процесса спермиогенеза. Повышение концентрации ЛДГ-Х было отмечено у больных, имеющих локальные изменения в шейке и хвосте сперматозоидов (r=79, p<0,05). Активность ЛДГ-Х не коррелирует с процентом подвижности сперматозоидов, ДСС, РС.
Концентрация КФ в эякуляте у больных снижена в 1,3 раза (9,34±1,17 мкмоль/мл) по сравнению со здоровыми (12,29±1,23 мкмоль/мл, р<0,05). Концентрации ЛДГ-Х и КФ в эякуляте имеют прямую обратную зависимость: при повышенных концентрациях ЛДГ-Х прямо пропорционально снижается концентрация КФ (r=-0,81, p<0,05).
Биохимический анализ эякулята показывает, что у больных ХП по сравнению со здоровыми мужчинами отмечается снижение содержания фруктозы, лимонной кислоты, КФ при повышенном содержании ЛДГ-Х. Увеличение активности ЛДГ-Х свидетельствует об усилении анаэробного обмена в придаточных половых железах [1]. ЛДГ-Х - фермент, входящий в состав гликолитической цепи, участвует в обратном катализе превращения молочной кислоты в пировиноградную. Повышение активности ЛДГ-Х, по видимому, является следствием гипоксии тканей придаточных половых желез и возможных деструктивных изменений [1], связанных с повреждением гистогематического барьера и тканей придаточных половых желез, сопровождающегося выходом внутриклеточных ферментов из поврежденных клеток непосредственно в эякулят. Пониженная продукция фруктозы и КФ являются следствием гипоандрогенемии и дегенеративных изменений в придаточных половых железах у больных ХП.
Заключение. У 84,4% больных патологические состояния эякулята носили сочетанный характер. ХП влияет на строение сперматозоидов, которое выражается в увеличении числа сперматозоидов с патологией хвоста и уменьшении числа морфологически нормальных сперматозоидов. Концентрации АСАТ в крови и ЛДГ-Х в эякуляте были повышены в 1,3 и 1,3 раза соответственно по сравнению со здоровыми. У больных фруктолиз, концентрации фруктозы, лимонной кислоты и КФ в эякуляте снижены в 1,3, 1,2, 1,3 и 1,3 раза соответственно по сравнению со здоровыми. У больных ИОС и ИПС были снижены в 1,8 и 2 раза соответственно, ИФГЭ повышен в 2 раза по сравнению со здоровыми, что свидетельствует о функциональной блокаде спермиогенеза и снижении оплодотворяющей способности эякулята у больных ХП.
