Введение. В результате хронического специфического воспаления (туберкулез, бильгарциоз), ретроперитонеального фиброза, ятрогенных повреждений, новообразований или радиационного поражения верхних мочевых путей могут образовываться протяженные дефекты мочеточника(ов), которые невозможно восстановить с помощью собственных тканей мочевого тракта. В таких случаях показана частичная или полная замена пораженного органа. Из всех предложенных методов, включающих использование синтетических материалов, свободных аутологичных тканей или различных трансплантатов на сосудистой ножке наиболее широкое признание получила интестинальная пластика мочеточника [1,2].
Впервые замещение мочеточника сегментом тонкой кишки в эксперименте выполнили G. D’Urso и A. de Fabii в 1900 г., а в клинике R. Nissen в 1940 г. по поводу мочеточниково-кожной фистулы, образовавшейся после уретеролитотомии [3].
Данные контрольного обследования больного через 6 лет убедили автора в оправданности этой операции. Впоследствии K. Ultiszch произвел одновременную замену тазовых отделов обоих мочеточников кишкой по поводу двусторонних мочеточниковых свищей, развившихся после резекции сигмовидной кишки. В СССР кишечная пластика мочеточника впервые выполнена в эксперименте М.М. Заевлошиным и В.М. Гиньковским в 1938 г. [4].
После операций на 9 собаках авторы пришли к выводу, что изолированная петля тонкой кишки является хорошим материалом для замещения мочеточника. В клиническую практику данное оперативное вмешательство в нашей стране внедрил А.П.Фрумкин в 1954 г. [5]. В настоящее время для кишечной пластики мочеточника наиболее часто используется изолированный участок подвздошной кишки. Хирургическая анатомия данного отдела кишки, мобильность ее брыжейки позволяет использовать сегмент необходимой длины для частичного или полного замещения одного или обоих мочеточников.
За последние пятьдесят лет илеоуретеропластика получила более широкое признание. В эксперименте, а затем в клинике было доказано, что при кишечном замещении мочеточника не наблюдается существенных нарушений водно-электролитного баланса. Накопление определенного опыта со временем позволило выполнять операцию больным с единственной почкой. Д.В. Кан сообщил о результатах энтероуретеропластики у 28 пациентов, среди которых у 8 была единственная почка [7]. Несмотря на большое количество осложнений и высокую летальность, Д.В. Кан считал, что данная операция нередко остается последним шансом для больного сохранить функционирующую почку и избавиться от постоянного нефростомического дренажа.
Любое хирургическое вмешательство независимо от объема, сложности и длительности операции, может привести к серьезным послеоперационным осложнениям, вплоть до летального исхода. Реконструкция мочевыводящих путей с использованием сегментов кишки относится к разряду масштабных, травматичных и продолжительных операций, при выполнении которых риск осложнений весьма высок. Вместе с тем за последние 20 лет в отечественной литературе работ, посвященной данной проблеме практически не было опубликовано. Частично восполняет этот пробел статья О.Б. Лорана, в которой автор сообщает о результатах 15 кишечных пластик у пациенток с постлучевыми сужениями мочеточников [8].
Несмотря на совершенствование медицинской и хирургической техники, очевидные успехи в терапии и фармакологии, полностью исключить развитие послеоперационных осложнений невозможно, но попытаться снизить их частоту вполне реально. Поэтому основной задачей хирурга является выяснение причин наиболее часто встречаемых осложнений, их своевременная диагностика и устранение. Знание видов и сроков развития осложнений, характерных для того или иного метода реконструкции верхних мочевых путей, дает возможность осуществлять адекватный динамический контроль над течением послеоперационного периода и проводить эффективные профилактические мероприятия.
Материал и методы. С 2001 по 2012 г. нами 50 пациентам выполнена кишечная пластика мочеточников. В 47 (94,0%) случаях использовался изолированный сегмент подвздошной, а в 3 (6,0%) – сигмовидной кишки. Следует отметить, что помимо пациентов, которым произведена данная операция, включенных в эту работу, в 16 случаев для замещения протяженных сужений мочеточников нами был использован червеобразный отросток, в том числе 3 левосторонних аппендикоуретеропластик.
Среди пациентов, которым выполнена кишечная пластика мочеточников, мужчин было 13 и женщин 37. Возраст больных колебался от 18 до 69 лет и в среднем составил 47,2±11,5 года. Причины, приведшие у них к обширным повреждениям мочеточников, представлены в табл. 1.
Таблица 1. Причины дефектов мочеточников у больных, перенесших илеоуретеропластику
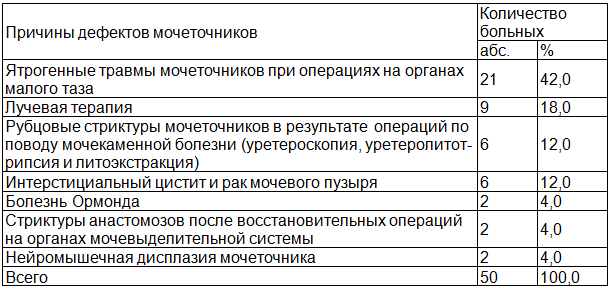
Как следует из табл. 1, подавляющее большинство пациентов были ранее оперированы на органах малого таза по поводу онкологических заболеваний, прежде всего, женских половых органов. Следующими по значимости причинами сужений мочеточников явились: лучевая терапия по поводу новообразований органов малого таза, эндоурологические операции (уретероскопия) у больных с мочекаменной болезнью, рак мочевого пузыря и интерстициальный цистит.
Одностороннее замещение мочеточника произведено 33 (66,0%) и двусторонняя пластика 17 (34,0%) пациентам. Сведения о больных и выполненных им операциях приведены в табл. 2.
Таблица 2. Виды кишечных пластик, выполненных по поводу обширных поражений мочеточников

В подавляющем большинстве случаев для реконструкции мочевых путей использовалась изолированная петля подвздошной кишки (94%,0), которая являясь универсальным пластическим материалом, позволяет заместить не только любой дефект мочеточников с обеих сторон, но и осуществить одновременно реконструкцию мочевого пузыря. В одном случае левосторонняя илеоуретеропластика произведена в сочетании с замещением протяженного дефекта противоположного мочеточника червеобразным отростком.
Результаты и их обсуждение. Послеоперационное ведение больных мало отличался от тактики лечения пациентов общехирургического профиля. Комплексная оценка основывалась на данных клинических, лабораторных, рентгенологических, радиоизотопных, ультразвуковых, уродинамических, инструментальных и эндоскопических исследований.
Принято различать ранние и поздние послеоперационные осложнения. Под ранними мы понимали те, которые развивались в промежутке времени, в течение которого больной находился в стационаре после операции. Обычно этот срок не превышал 1 месяца.
Послеоперационные осложнения развились у 7 (14,0%) пациентов. Сведения о них представлены в табл. 3.
Таблица 3. Характер ранних и поздних послеоперационных осложнений после кишечной пластики мочеточников и способах их коррекции
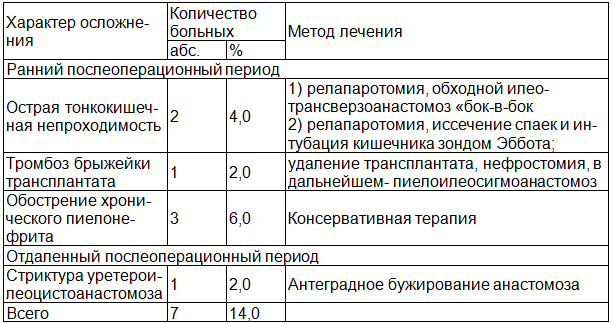
В раннем послеоперационном периоде осложнения имели место у 6 (12,0%) больных. Наиболее грозными из них явились спаечная кишечная непроходимость и тромбоз брыжейки трансплантата. Острая тонкокишечная непроходимость имела место у 2 пациентов: после U – образного замещения протяженных дефектов обоих мочеточников и после правосторонней илеоуретеропластики. В первом случае выполнена релапаротомия, обходной илео-трансверзоанастомоз «бок-в-бок». Во втором - релапаротомия, рассечение спаек, санация и дренирование брюшной полости, интубация кишечника зондом Эббота. Пациенту с тромбозом брыжейки трансплантата в результате перекрута его при попытке изоперистальтического расположения петли справа после двусторонней илеоуретеропластики произведено его удаление, почка дренирована нефростомой. В дальнейшем выполнена сигмоуретеропластика.
В отдаленном послеоперационном периоде в одном случае (2,0%) образовалась стриктура уретероилеоцистоанастомоза спустя 2,5 месяца после операции. Проходимость мочевыводящих путей восстановлена путем антеградного бужирования стриктуры. Таким образом, осложнения, потребовавшие оперативного лечения, развились у 3 (6,0%) больных. Результаты повторных операций были успешными, летальных исходов не было.
Изучая функциональное состояние почек и верхних мочевых путей в отдаленном послеоперационном периоде нам удалось повторно обследовать 47 пациентов. Срок наблюдения составил от 3 месяцев до 11 лет (в среднем - 6,3±0,8 лет). Согласно литературным данным, наиболее частое функциональное нарушение после кишечной пластики мочеточников – пузырно-кишечный и пузырно-лоханочный рефлюкс [9]. Среди оперированных нами больных, активный пузырно-лоханочный рефлюкс имелся у 2 (4,2%) пациентов, страдающих нейрогенными расстройствами мочевого пузыря. Однако он не проявлялся клинически и не сопровождался гидроуретеронефрозом и рецидивирующей инфекцией мочевыводящих путей, так как больные прибегали к периодической самокатетеризации. Таким образом, ухудшения функционального состояния почек на стороне операции у всех обследованных нами пациентов не обнаружено.
Отдаленные результаты оперативного лечения – тот материал, в котором оперирующие урологи находят ответы на имеющиеся у них вопросы. Поэтому такие публикации пользуются неизменным успехом. Сравнивая полученные нами результаты с данными литературы, хотим отметить, что цифры, приводимые разными авторами, зачастую сильно разнятся. Так, F J Verduyct и соавт. в 2002 г. собрали сведения о 18 из 22 оперированных за 20 лет больных, которым была выполнена одно - или двусторонняя кишечная пластика мочеточников [10]. Осложнения возникли у 9 (50,0%) больных. Три пациента были оперированы в ранние сроки после операции: одному выполнена нефрэктомия по поводу кровотечения, двоим – лапаротомия в связи с тонкокишечной непроходимостью. В отдаленном периоде 6 пациентов потребовали оперативного вмешательств: двое перенесли нефрэктомию, трое – лоханочно-подвздошный реанастомоз, один - нефролитотрипсию. Шесть пациентов страдали от рецидивирующего пиелонефрита и двое получали консервативное лечение по поводу ацидоза. В отдаленном периоде функция почки на стороне операции была сохранена у 15 пациентов (83,3%). В целом авторы положительно отзываются о кишечной пластике мочеточников, но, как и многие другие, считают ее показанной лишь для больных, у которых не существует другого выбора.
В другой работе S.A. Armatys et al., оценивая отдаленные результаты илеоуретеропластики у 91 пациента, также сообщают о высокой частоте осложнений. Так в раннем послеоперационном периоде они возникли в 43,0%, а в отдаленном в 23,0% случаев. Однако авторы объясняют столь высокие показатели тем, что 74 (81,3%) больных ранее были неоднократно оперированы или получали лучевую терапию. Особенно часто осложнения развивались у пациентов с забрюшинным постлучевым фиброзом [11].
По данным Chung B.I. et al., серьезные осложнения произошли лишь у 6 из 52 больных (11,5%), включая стенозы проксимального и дистального анастомозов, расхождения раны и усугубление хронической почечной недостаточности [12].
Таким образом, представленные различными клиниками данные о частоте послеоперационных осложнений и отдаленных функциональных результатах кишечной пластики мочеточников неоднозначны и являются предметом дискуссий в мировой литературе. Основываясь на полученных нами результатах, мы считаем, что реконструкция мочеточников при помощи изолированного сегмента тонкой или толстой кишки, несмотря на продолжительность и сложность хирургического вмешательства, является относительно безопасной операцией, способной восстановить свободный отток мочи из почек и избавить пациента от мочевых свищей. Соблюдение показаний и противопоказаний при подборе больных для подобной операции является важнейшим условием достижения хорошего функционального результата. Вторым, не менее важным, условием является наличие в клинике урологов, имеющих опыт абдоминальной хирургии, и адекватного анестезиологического обеспечения.
Заключение. Кишечная пластика при обширном поражении мочеточника является операцией выбора, так как она позволяет восстановить отток мочи из почки, улучшить ее функцию, купировать явления хронического пиелонефрита и избавить больных от постоянных почечных и мочеточниковых свищей. Использование изолированного сегмента кишки позволяет заместить дефекты одного или обоих мочеточников любой локализации и протяженности. Существенную роль в малой популярности этого метода лечения играют опасения урологов в отношении угрозы хирургических осложнений в виде несостоятельности межкишечного анастомоза, некроза изолированного кишечного сегмента, спаечной кишечной непроходимости, перитонита. Наиболее грозные из них развиваются, как правило, в раннем послеоперационном периоде. Данная операция должна выполняться в крупных урологических клиниках, имеющих большой опыт подобных вмешательств.
