Введение. Уротелиальный рак, рак мочевого пузыря, лоханки и мочеточника является актуальной проблемой современной онкоурологии, что обусловлено высокой заболеваемостью, тяжестью течения, высокой степенью инвалидизации и тенденции к росту распространенности [1,2].
Эффективность лечения уротелиального рака зависит от ранней диагностики, адекватности хирургического лечения, своевременной диагностики рецидивов.
Идеальный метод лабораторной диагностики должен иметь высокую диагностическую точность, высокую воспроизводимость, прогностическую ценность, быть недорогим, простым в исполнении, подходить для раннего выявления опухоли [3,4].
Для диагностики уротелиального рака используется комплекс лабораторных исследований: исследование онкологических маркеров, цитологическое исследование мочи [5,6].
В ряде случаев у больных отмечается наличие сопутствующего хронического воспаления уротелия за счет наличия мочекаменной болезни. Для осуществления дифференциальной диагностики необходимо определить лабораторные изменения, которые могут быть характерными при наличии уротелиального рака [7,8].
Цель исследования. Определить особенности цитологического исследования мочи при коралловидном нефролитиазе.
Материалы и методы. В качестве модели хронического воспаления были взяты пациенты с мочекаменной болезнью при наличии коралловидных конкрементов (N-30). Медиана возраста составила 52 (18-65) года.
У всех пациентов были коралловидные конкременты: конкременты правой почку – у 12 больных, конкременты левой почки у 12, двухсторонний нефролитиаз был в 8 случаях. Ни у кого из пациентов не было онкологических заболеваний в анамнезе.
Всем пациентам было выполнено цитологическое исследование мочи, общий анализ мочи и посев мочи, компьютерная томография (КТ) брюшной полости с контрастированием, ультразвуковое исследование (УЗИ) брюшной полости и забрюшинного пространства перед операцией.
Всем пациентам проводилось перкутанная нефролитолапаксия, методика, которой включает цистоскопию и пиелокаликоскопию. Признаки наличия опухоли были критерием исключения.
Цитологический анализ осадка мочи проводили в препаратах, окрашенных по Романовскому-Гимзе в автоматическом режиме на аппарате эмкостейкер–авто (АФОМК8-Г-01). Затем окрашенные препараты анализировали на светооптическом микроскопе с регистрацией изображения цифровой фотокамерой Leica DFC 320, в соответствии с международными стандартами.
Посев мочи был положительный в 10 случаях; титр возбудителя варьировал 104-107. Высеянные возбудители – e.coli; e.faecium, proteus mirabilis, psevdomonas aureginosa, serratia marcescens, kl. рneumoniae.
Медиана среднего количества эритроцитов в мл мочи составляла 35 (8-3000), лейкоцитов 998,3 (12 - 17581), клеток уротелия 3 (1-30) соответственно.
Результаты и обсуждение. Анализ цитологических препаратов показал, что в осадке мочи исследуемой группы больных обращает внимание постоянное присутствие дисморфных, нередко увеличенных размеров, эритроциты.
В большинстве случаев эритроциты имеют характер так называемых «выщелоченных» клеток. Во всех препаратах присутствуют лейкоциты, с преобладанием лизированных нейтрофилов.
Значительно присутствие пикноморфных клеток, т.н. «сморщенных» нейтрофилов, которые необходимо дифференцировать от клеток лимфоидного ряда.
Переходный эпителий (уротелий) реагирует на патологические изменения в органе (нефролитиаз) дистрофическими нарушениями. Главным образом это отёк и вакуолизация цитоплазмы клеток.
Изменяются и тинкториальные свойства эпителиоцитов. Появляется гиперхромия цитоплазмы, сочетающаяся с нарушением ядерно-цитоплазматических отношений. Происходит увеличение размеров ядер, однако кариолемма сохраняет ровные, округлые очертания. Достаточно часто встречаются 2-х и 3-х ядерные клетки, что косвенно свидетельствует о пролиферативных изменениях в уротелии (рис. 1).
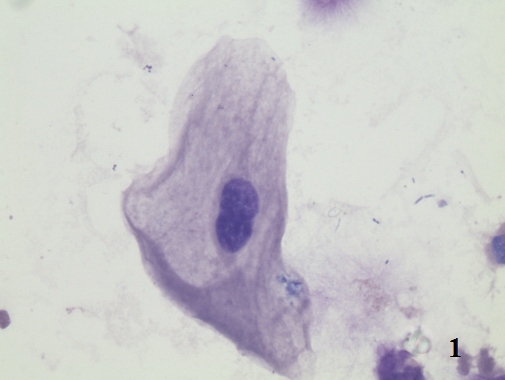
Рис. 1. Цитологический препарат окрашен по Романовскому-Гимзе. Увеличение ок. 10х, об. 100х. Двухядерный эпителиоцит в осадке мочи
Проводя сопоставление результатов цитологического исследования с параллельными клинико-лабораторными методами, возникла необходимость определения присутствия в препаратах атипических эпителиоцитов с признаками дисплазии.
Морфологически процесс дисплазии аналогичен процессу гиперплазии с последующим нарушением дифференцировки и атипией клеток. Это, прежде всего, выражается в «аномальных» изменениях ядер, ядерно-цитоплазматических отношений и изменении тинкториальных свойств клеток. Всё это происходит без признаков дистрофических нарушений и воспаления.
Следует различать дисплазию, как первичную атипическую гиперплазию и дисплазию, как результат регенераторных процессов [9]. В смысле атипической первичной гиперплазии, дисплазия является «предстадией» рака. В нашем исследовании у ряда больных нефролитиазом определялись типичные признаки дисплазии (рис. 2,3).
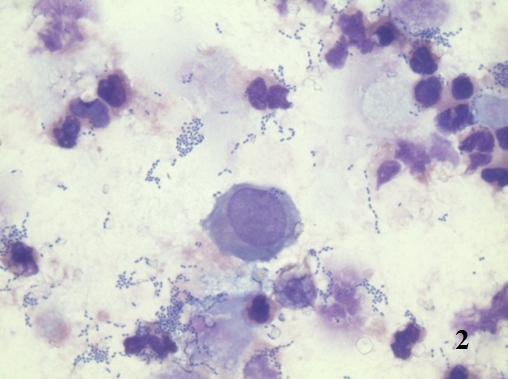
Рис. 2. Цитологический препарат окрашен по Романовскому-Гиммзе. Увеличение ок. 10х, об. 100х. Эпителиоцит с явлениями вакуолярной дистрофии цитоплазмы и пикнозом ядра по типу апоптоза
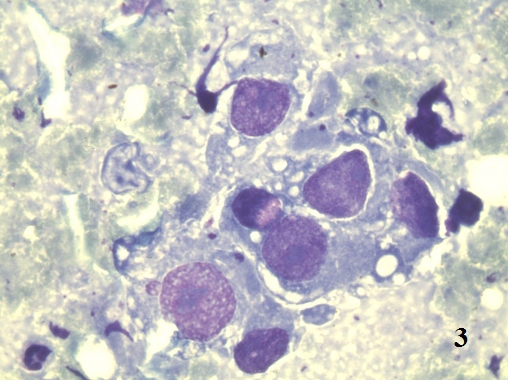
Рис. 3. Цитологический препарат окрашен по Романовскому-Гимзе. Увеличение ок. 10х, об. 100х. Изменение ядерно-цитоплазматического соотношения
В осадке мочи, исследуемой группы больных мы наблюдали небольшие комплексы из клеток переходного эпителия с признаками зрелой метаплазии. Это свидетельствует о компенсаторно-приспособительных изменениях эпителия, через так называемую гистологическую аккомодацию ткани органа.
В настоящее время большинством исследователей принято считать, что плоскоклеточная метаплазия не относится к предраковым состояниям. В цитологических препаратах мы также постоянно обнаруживали элементы солей, чаще всего оксалаты кальция.
Также постоянно и присутствие микрофлоры с преобладанием мелких, кокковых элементов. Часто обнаруживали элементы гриба. Обычно в виде псевдомицелия и бластоспор гриба рода Кандида.
Заключение. Проведённое цитологическое исследование позволяет сделать заключение, что при данном виде нефролитиаза формируется хроническое воспаление, которое сопровождается дистрофическими, десквамативными и метапластическими изменениями уротелия.
В ряде случаев формируются признаки дисплазии уротелия, которую следует рассматривать в комплексе с компенсаторно-приспособительными и воспалительными изменениями уротелия.
