Введение. Пороки развития органов мочевой системы по количеству и разнообразию занимают первое место среди пороков всех органов и систем [1]. Результаты патологоанатомических исследований различных авторов свидетельствуют о том, что около 10% людей рождаются с пороками развития органов мочевой системы [1]. Кроме того, по данным ряда авторов [1] за последнее десятилетие наметились тенденции к росту патологии органов, относящихся к мочевой системе. Это связано как с улучшением диагностики, внедрением современных скрининговых методов исследования, накоплением и обобщением клинических материалов по данной проблеме, так и с достоверно большей чувствительностью метанефрогенной ткани по сравнению с другими к воздействию неблагоприятных факторов внешней среды [1].
В длинном перечне пороков развития мочевой системы лидерство по-прежнему удерживают аномалии обструктивного характера [1,6]. Обструктивная уропатия - комплекс структурных и функциональных изменений мочевыводящих путей из-за нарушения оттока мочи вследствие обструкции [2]. Каждый год примерно 2 из 1000 человек в США госпитализируются по поводу обструктивной уропатии. Этот синдром одинаково распространен среди мужчин и женщин. В детском возрасте возникает в основном на фоне различных аномалий мочевых путей. В целом обструктивная уропатия является причиной 4% всех случаев терминальной хронической почечной недостаточности.
Врожденные обструктивные уропатии составляют 41 % среди всех причин, приведших к формированию хронической почечной недостаточности (ХПН) в детском возрасте в России [3]. Успехи в изучении естественного течения и последствий урологических пороков развития, а также прогресс и усовершенствование медицинских навыков и хирургической техники привели к необходимости новых подходов лечебной тактики [4]. В современной практике урологическая часть проблемы обструктивных уропатий заключается в контроле над результатами проведенного вмешательства по восстановлению тока мочи.
Цель исследования: экспериментальное моделирование меатостеноза оперативным путем для мониторинга морфофункциональных изменений в тканях почек, мочевого пузыря, мочеточников и уретры кроликов.
Материалы и методы. В экспериментальных исследованиях известны способы моделирования стриктуры уретры, проводящийся путем воздействия термического фактора на определенный участок уретры. Однако, экспериментальное моделирование непосредственно меатостеноза, ни кем не проводилось.
Характеристика экспериментальных групп. Исследование выполнено на 17 половозрелых самцах кроликов одного возраста весом 2700±400 г на протяжении одного месяца. Всем подопытным животным был произведен меатостеноз.
Соответственно поставленной цели для выполнения экспериментального исследования подопытные особи были разделены на три группы:
- 1 группа (n=5) - кролики данной группы были выведены из эксперимента на 10 сутки
- 2 группа (n=5) - кролики данной группы были выведены из эксперимента на 20 сутки
- 3 группа (n=5) - кролики данной группы были выведены из эксперимента на 30 сутки
Контрольная группа интактных животных (n=2).
Все подопытные особи содержались в одинаковых условиях вивария, в отдельных клетках, хорошо вентилированных комнатах при температуре до 220С и кормились стандартной пищей. Моделирование меатостеноза во всех трех группах проводилась путем термического воздействия на наружное отверстие мочеиспускательного канала, для предотвращения полного блока мочевого пузыря у кроликов был поставлен катетер, который был подшит к головке полового члена. Все катетеры самостоятельно вышли на 3-5 сутки с момента начала исследования.
Эксперимент проводился следующим образом: производилась постановка внутривенного катетера в околоушную вену, которая визуализировалась при проведении диафаноскопии, после чего вводился пропофол, разведенный по следующей схеме: 1 мл действующего вещества на 5 мл физиологического раствора, единовременно вводилось 2 мл, после чего кролик обездвиживался без угнетения функций дыхательного центра, в этот момент производилась постановка мочевого стента, который шовным материалом фиксировался к головке полового члена по условному циферблату на 12, 3 и 9 часах с использованием нити SafilQuick 5/0.
Далее производилось введение кетамина, разведенного по следующей схеме: 1 мл действующего вещества на 10 мл физиологического раствора, единовременно вводился 1 мл, после чего наружное отверстие мочеиспускательного канала прижигалось прямым зажимом бранши, который предварительно был нагрет до 100 градусов, после чего кролику проводилась инъекция цефтриаксона 100 мкг для предотвращения нагноительных процессов в месте манипуляции и для удлинения анальгетического эффекта кроликам вводилось 0,5 мл кетонала.
Клиническое наблюдение за животными производилось каждый день. В течение первых 3 дней кроликам проводилась антибиотикотерапия и анальгезия указанными выше способами, у всех кроликов на 3-5 сутки отмечалось самостоятельное отхождение мочевого стента.
На 10, 20 и 30 сутки кролики выводились из эксперимента путем введения препарата пропафол в указанном выше разведении, но в дозировке 5 мл, после чего происходило угнетение функций дыхательного центра, расслабление гладкой мускулатуры, кролик безболезненно выходил из эксперимента. Посмертно у кроликов был взят материал для гистологического исследования.
За время эксперимента 2 кролика погибли самостоятельно: гибель первого животного отмечалась на 3 сутки, гибель второго - на 20 сутки. У всех исследуемых кроликов были взяты ткани для исследования: участок уретры с меатостенозом, мочевого пузыря, мочеточников, а также почек с пиелоуретральным сегментом.
Извлеченный гистологический материал фиксировался в 10% нейтральном забуференном формалине (с использованием фосфатно-солевого буфера pH 7,4), с последующей проводкой и заливкой в парафин. Далее изготовлялись срезы мочевого пузыря, почки и мочеточника. Срезы, толщиной 5 мкм, изготовлялись на санном микротоме МС-2. Приготовленные срезы наклеивали на предметные стекла и окрашивали по общепринятым методикам гистологической окраски: геметоксилином-эозином и гематоксилином Вейгерта (по Ван-Гизону) [5]. Анализ гистологического материала проводился на микроскопе Olympus BХ 51 при увеличении 10, 40 и 100.
Результаты. При макроскопическом анализе, во время вскрытия кроликов во II и III группах, почки имели нормальной размер и окраску, с четко различимыми корковым и мозговым веществом, почечная лоханка и устье мочеточника расширены, сосуды полнокровные. Мочевой пузырь подопытных животных перерастянут, заполнен мочой темного цвета. При проведении пункции мочевого пузыря, одномоментно выводилось от 15 до 30 мл концентрированной мочи (рис. 1, 2). У кроликов III группы также отмечалось расширение либо мочеточников в месте их перехода в мочевой пузырь, либо расширение в области шейки мочевого пузыря (инфравезикальная обструкция).
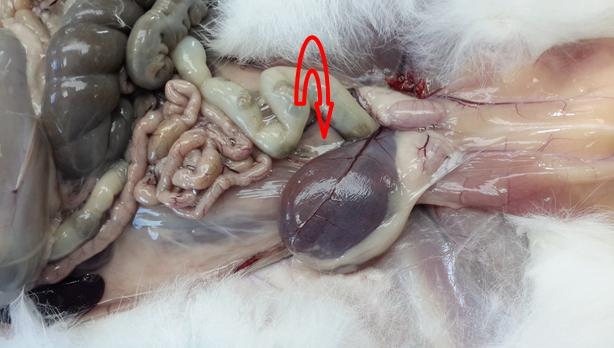
Рис. 1. Подопытный кролик с меатостенозом на 20 сутки. Растянутый мочевой пузырь (указан стрелкой). Макрофото.
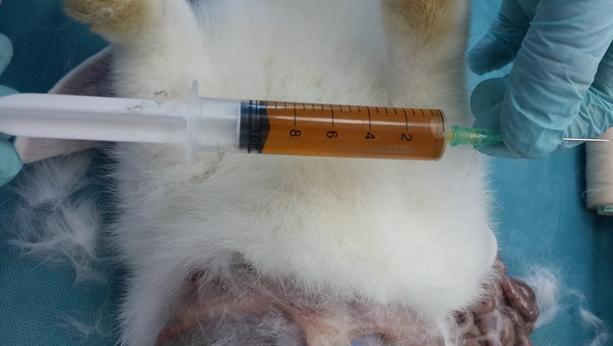
Рис. 2. Содержимое мочевого пузыря подопытного кролика на 30 день эксперимента.
У кролика, погибшего на 20 сутки, отмечался перерастянутый мочевой пузырь, расширение мочеточников и наличие прозрачного транссудата в брюшной полости, что, стоит рассматривать, как явления почечной недостаточности, а также, возможно и как результат увеличения проницаемости сосудов, вследствие нарушения гемодинамики. У кролика, погибшего на 3 сутки, макроскопически не определялось расширение мочеточников и явления перерастянутости мочевого пузыря, мочевой стент сохранен.
По результатам гистологических исследований во всех препаратах отмечается наличие трофических изменений, характеризующихся нарушением гемодинамики в тканях, с образованием множественных тромбов венул и артериол (рис. 3).
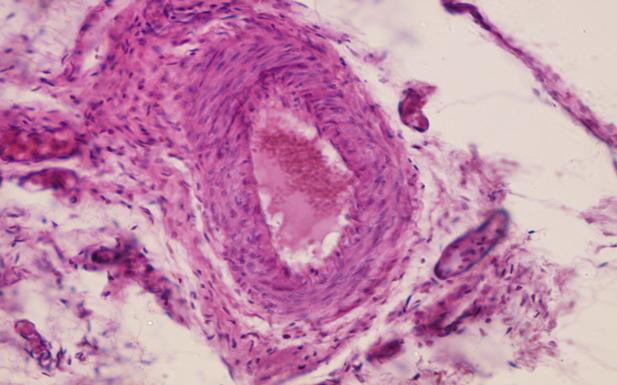
Рис. 3. Препарат мочевого пузыря кролика с меатостенозом на 30 сутки. Артериола мочевого пузыря кролика, образование обтурирующего тромба в просвете артериолы. Окр. гематоксилин-эозин. Ув. х 400.
У кроликов, выведенных на 20 и 30 сутки также имеется уплощение эпителия мочевого пузыря, у некоторых даже с явлениями начинающейся дистрофии. Гистологический анализ ткани почек указывает на развитие гемодинамических нарушений, характеризующихся выраженным полнокровием сосудов почечной паренхимы с образованием множественных тромбов. Также отмечается белковая дистрофия эпителия извитых канальцев, вероятно, как следствие нарушения трофики органа. В ряде случаев отмечается развитие воспалительной пролиферации на месте спавшихся почечных клубочков с миграцией лейкоцитов в тубулярные отделы паренхимы почки (рис. 4-6).
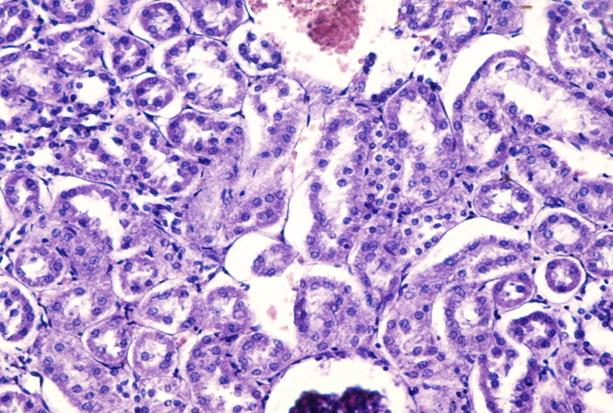
Рис. 4. Препарат почечной паренхимы кролика с меатостенозом на 30 сутки. Полнокровие сосудов. Белковая дистрофия эпителия канальцев. В просвете канальцев десквамированный эпителий. Внизу рисунка спавшийся почечный клубочек. Окр. гематоксилин-эозин. Ув. х 400.
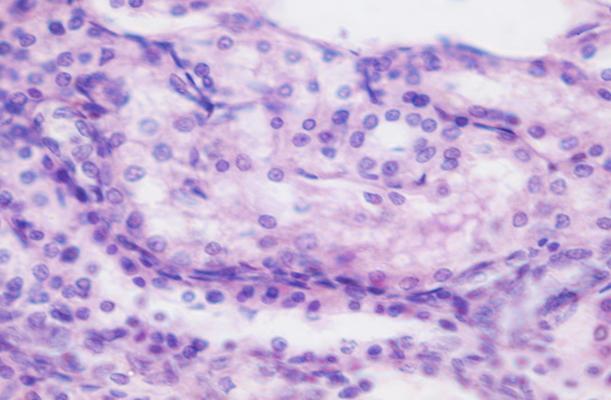
Рис. 5. Препарат почечной паренхимы кролика с меатостенозом на 30 сутки. Зернистая дистрофия эпителия извитых канальцев. Окр. гематоксилин-эозин. Ув. х 1000.
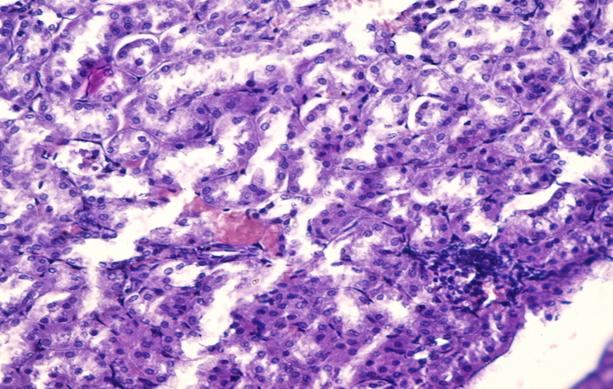
Рис. 6. Препарат почечной паренхимы кролика с меатостенозом на 30 сутки. Полнокровие сосудов, участок воспалительной пролиферации. Окр. гематоксилин-эозин. Ув. х 400.
Просвет мочеточников расширен, отмечается выраженное набухание уротелия. Гистологический анализ ткани мочевого пузыря в исследуемой группе также выявил выраженные гемодинамические нарушения, выражающиеся в полнокровии сосудов с образованием тромбов. В тоже время отмечается уплощение переходного уротелия мочевого пузыря, с развитием процесса дистрофии эпителиоцитов (вероятно, как результат пролонгированной перерастянутости и нарушения гемодинамики и трофики ткани) (рис. 7, 8).
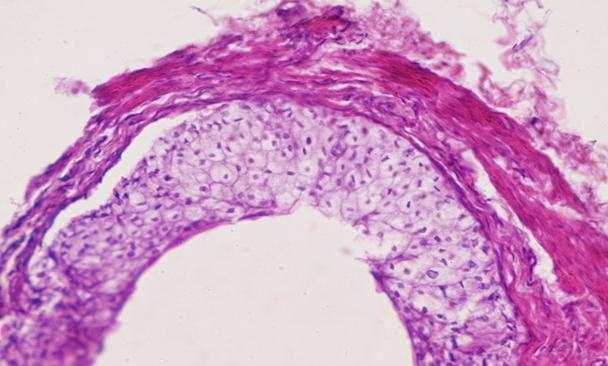
Рис. 7. Препарат мочеточника кролика с меатостенозом на 30 сутки. Набухание уротелия. Отмечается полнокровие сосудов, замедление кровотока, начало образования тромба. Окр. гематоксилин-эозин. Ув. х 400.
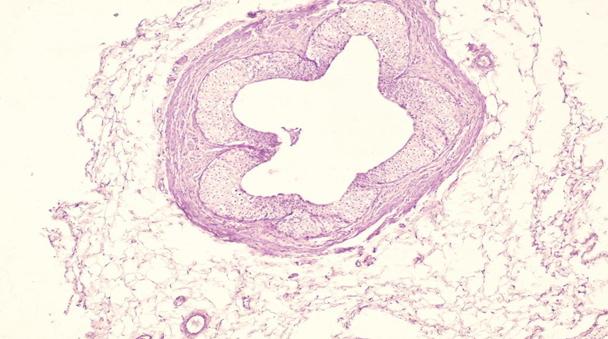
Рис. 8. Препарат мочеточника кролика с меатостенозом на 30 сутки. Набухание уротелия, расширение просвета мочеточника. Окр. гематоксилин-эозин. Ув. х 400.
Каких-либо нарушений уротелия уретры не отмечается, за исключением полнокровия прилежащих сосудов с развитием в некоторых из них тромбов (рис. 9).
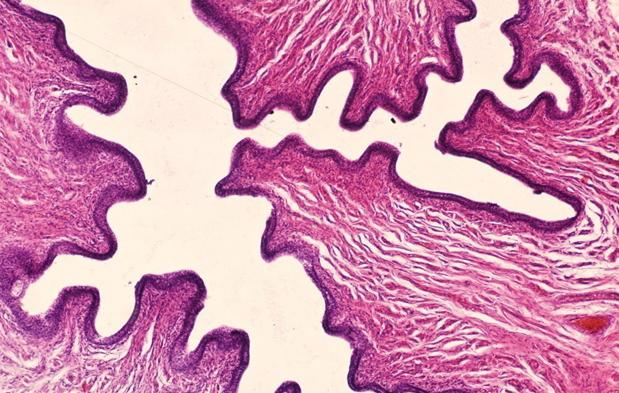
Рис. 9. Препарат уретры кролика с меатостенозом на 30 сутки. Видимой патологии уротелия не обнаружено. Сосуды полнокровные с развитием тромбоза. Окр. Гематоксилин-эозин. Ув. х 400.
После возникновения меатостеноза уже на 10 сутки начинают формироваться трофические изменения в тканях уретры, мочевого пузыря, мочеточников и почек. На 20 и 30 сутки патологический процесс характеризуется выраженными гемодинамическими нарушениями дисциркуляторного русла, наряду с этим отмечаются явления дистрофии эпителия извитых канальцев, уплощение уротелия мочеточников и уплощение уротелия мочевого пузыря (рис. 10).
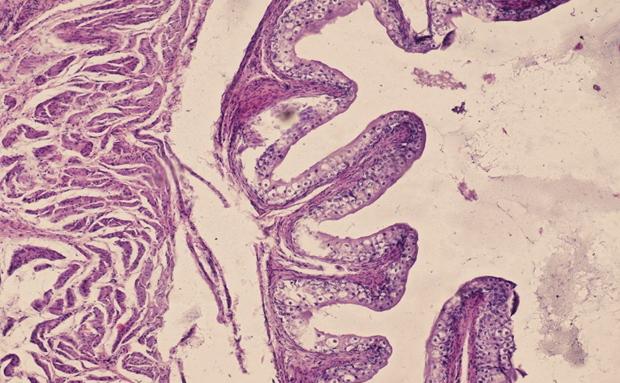
Рис. 10. Препарат мочевого пузыря кролика с меатостенозом на 20 сутки. Уплощение уротелия, развитие белковой дистрофии эпителиоцитов. Окр. гематоксилин-эозин. Ув. х 400.
В ходе работы удалось показать, что от начала уроблока и до момента выведения подопытного животного из эксперимента, проградиентно усиливается степень повреждения органов и тканей мочевой системы, и идет снижение их компенсаторных возможностей.
Обсуждение. Таким образом, результаты проведенного экспериментального исследования свидетельствуют о том, что выраженность обструктивного синдрома в совокупности с временным фактором при меатостенозе имеют основополагающее значение для морфофункционального статуса мочевыводящих путей. Поэтому меатостеноз является тяжёлым заболеванием, во многих случаях с поздним диагнозом, что приводит к стойкой дисфункции мочевого пузыря, нефросклерозу, формированию хронической почечной недостаточности уже в раннем возрасте.
