Введение. По заключению трансатлантического консенсуса 2007 г., частота хронической критической ишемии нижних конечностей (ХКИНК) составляет 500-1000 пациентов на 1 млн. населения в год. В течение первого года с момента установления этого диагноза 25% больных нуждаются в высокой ампутации [9].
Несмотря на огромный многолетний опыт хирургов и кажущуюся простоту операции, при ампутации нижних конечностей сохраняется значительная частота послеоперационных осложнений и высокая летальность. По данным различных авторов, частота послеоперационных раневых осложнений при высокой ампутации по поводу ХКИНК колеблется в пределах от 5,5 до 60%. Летальность в течение 1 месяца после больших ампутаций составляет 9,2-12,4%. Необходимость в реампутации возникает у 7% пациентов [5, 9]. При этом стремление снизить число ранних послеоперационных осложнений зачастую приводит к выбору более высокого уровня ампутации, что отрицательно сказывается на функциональном результате, усугубляя инвалидизацию пациентов и резко увеличивая затраты на их реабилитацию [1].
Для объективизации выбора уровня ампутации в настоящее время, помимо определения уровня окклюзии магистрального артериального русла, предложены такие инструментальные методы, как транскутанное определение парциального напряжения кислорода в тканях, радиоизотопная сцинтиграфия, термография, импедансометрия, лазерная доплеровская флоуметрия и даже гистологическое исследование мягких тканей на различных уровнях [2]. Однако, ни один из предложенных методов не нашел широкого применения из-за низкой информативности, либо высокой стоимости и длительности исследования. Таким образом, на сегодняшний день вопрос о выборе уровня ампутации, как правило, решается на основании определения уровня окклюзии магистральных артерий и распространенности ишемических и воспалительных изменений мягких тканей, а также субъективных интраоперационных критериев оценки жизнеспособности тканей [1, 5, 6, 12].
Вместе с тем, на кафедре хирургии ФППО в 1 Московском государственном медицинском университете им. И.М. Сеченова проводится работа по изучению информативности экспресс-оценки активности лактатдегидрогеназы мышечной ткани по реакции с нитросиним тетразолием для определения ее жизнеспособности в условиях хронической ишемии. Методика получила условное название Интраоперационное Гистохимическое Исследование (ИГХИ). В результате первого этапа работы была доказана корреляция результатов теста с частотой и характером ранних послеоперационных осложнений [3].
Целью данного этапа исследования являлось изучение возможности использования ИГХИ в качестве объективного метода определения уровня ампутации и способа формирования культи у пациентов с хронической критической ишемией нижних конечностей.
Материалы и методы исследования. Нами проанализированы результаты лечения 103 пациентов, перенесших ампутацию нижних конечностей на уровне бедра и голени по поводу ХКИНК. Пациенты, скончавшиеся в течение первых 14 суток после операции, в анализ включены не были.
Средний возраст пациентов составил 70,15±6,91 лет.
Количество пациентов мужского пола составило 64,08% (66 человек) и женского – 35,92% (37 человек).
10 (9,70%) пациентов были переведены из различных ангиохирургических стационаров после неудачных попыток сосудистой реконструкции целенаправленно для выполнения ампутации конечности.
У большинства пациентов по данным ультразвуковой доплерографии, рентгеноконтрастной ангиографии и мультиспиральной компьютерной томографии (МСКТ) имелось мультифокальное поражение артерий нижних конечностей с преимущественным поражением артерий аорто-подвздошного и бедренно-подколенного сегментов, что исключало выполнение ангиохирургической реконструкции.
Трофические язвы или гангрена стопы и голени отмечались у 93,2% пациентов.
Таким образом, все пациенты соответствовали критериям хронической критической ишемии нижних конечностей и у них отсутствовали возможности для ангиохирургической коррекции магистрального кровотока.
Непосредственными показаниями к ампутации являлись;
- Некупируемый болевой синдром.
- Распространенные некротические изменения дистальных отделов конечности.
- Интоксикация, обусловленная ишемией тканей и вторичной инфекцией на фоне невозможности выполнения сосудистой реконструкции и неэффективности консервативной терапии.
Таким образом, можно констатировать, что сочетание выраженного мультифокального атеросклеротического поражения артерий нижних конечностей с распространенными некротическими изменениями тканей дистальных отделов конечности определило необходимость выполнения ампутации конечности как единственно возможного метода лечения.
При наличии абсолютных показаний к ампутации определяли наиболее дистальный возможный уровень ампутации. При этом учитывали распространенность некротического процесса и уровень окклюзии магистральных артерий по данным доплерографии, дуплексного сканирования, МСКТ или рентгенконтрастной ангиографии.
Ампутации выполняли 10 разных хирургов – штатных сотрудников клиники по сходной методике. При этом окончательное решение об уровне ампутации и способе формирования культи оперирующий хирург принимал после интраоперационной оценки жизнеспособности тканей на первично выбранном уровне.
К числу традиционных критериев, используемых во время операции для определения жизнеспособности мышечной ткани, мы отнесли следующие:
- Кровоточивость мышцы на разрезе.
- Сократимость при раздражении коагулятором.
- Отек мышцы.
Учет данных критериев проводили согласно субъективному мнению оперирующего хирурга. Признаки были формализованы по двоичной шкале и фиксировались в тематической карте пациента. Такие традиционные визуальные признаки, как мозаичность кровенаполнения, «глинистый вид» мышцы на разрезе, атрофию тканей, мы не оценивали из-за трудности их формализации.
Одновременно всем пациентам выполнялось интраоперационное макроскопическое полуколичественное экспресс-исследование активности ЛДГ мышечной ткани по реакции с нитросиним тетразолием (ИГХИ).
Методика исследования. Бесцветные, водо-растворимые тетразолиевые соединения при акцептировании ионов водорода превращаются в формазаны - нерастворимые в воде темные пигменты. В нашей методике активность лактатдегидрогеназы мышечной ткани выявляется с помощью реакции восстановления нитросинего тетразолия, которая хорошо зарекомендовала себя в практике патологоанатомов для определения донекротических стадий инфаркта миокарда [4, 7]. Реакции с использованием нитросинего тетразолия протекают быстро (2-10 мин), и дают яркое и четкое контрастирование зон пониженной активности фермента, в связи с этим очень удобны для проведения макропробы, не отходя от операционного стола. Имеются сведения об использовании данной методики для оценки поражения мышц при электротравме [6], а также экспериментальные данные, свидетельствующие об информативности пробы с нитросиним тетразолием при ишемии [10, 11].
При ампутации на уровне бедра мы исследовали наружную широкую и полумембранозную мышцы, при операции ниже коленного сустава - икроножную, камбаловидную и переднюю берцовую мышцы. После изготовления подходящего биоптата с поперечным срезом мышечных волокон, его инкубировали в смеси растворов 0,02% нитросинего тетразолия и 1М раствора лактата при температуре 43°С. На данном этапе строго соблюдали температурный режим. Необходимую для проведения реакции кислотность (рН=7.2-7.4) достигали использованием фосфатного буфера. Соответственно учитывалось время, за которое проявлялась первая и вторая стадии реакции.
Начальные изменения начинали происходить на 1-2 минуте в виде окрашивания отдельных волокон, затем, от 3 до 10 минут, в зависимости от активности процессов окислительного фосфорилирования в мышечной ткани, происходило тотальное прокрашивание биоптата. Ход реакции фиксировали на фотографиях.
Предыдущие исследования позволили установить «пороговое» значение скорости образования пигмента в биоптате мышцы, являющееся предиктором развития послеоперационного некроза. Согласно полученным результатам, время тотального окрашивания фрагмента жизнеспособной мышцы составляет менее 5 минут. Более медленное образование формазанов свидетельствует о выраженном снижении метаболических процессов в мышечной ткани, что обусловливает нарушение процессов регенерации и приводит к развитию клинически значимого некроза мышц культи.
В настоящем исследовании была изучена информативность ИГХИ и произведено его сравнение с «традиционными» критериями интраоперационной оценки жизнеспособности мышечной ткани. Были рассчитаны показатели чувствительности, специфичности и общей точности указанных интраоперационных признаков. В качестве конечной точки было выбрано развитие клинически значимого некроза соответствующей мышцы культи в раннем (до 14 суток) послеоперационном периоде.
Чувствительность (Ч), то есть способность теста прогнозировать развитие послеоперационного некроза соответствующей мышцы на уровне ампутации
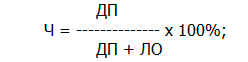
Специфичность (С), то есть способность теста прогнозировать неосложненное течение послеоперационного периода на выбранном уровне ампутации
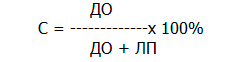
Кроме того, была определена общая точность (ОТ) изученных признаков для прогнозирования развития мионекроза в раннем послеоперационном периоде.
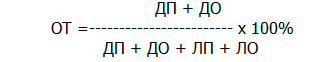
где ДП – число достоверно положительных результатов теста,
ДО – число достоверно отрицательных результатов
ЛП – число ложно положительных результатов
ЛО – число ложно отрицательных результатов
В послеоперационном периоде фиксировали частоту и характер ранних послеоперационных осложнений. При развитии мионекроза учитывали преимущественное поражение мышц передней или задней групп и соотносили эти данные с результатами интраоперационной экспресс-оценки жизнеспособности мышечной ткани.
Интраоперационное гистохимическое исследование активности лактатдегидрогеназы мышечной ткани применено нами в качестве объективного критерия жизнеспособности тканей для окончательного определения уровня ампутации конечности и способа формирования культи у 52 пациентов с гангреной нижних конечностей на фоне атеросклеротической окклюзии артерий аорто- подвздошно-бедренного и бедренно-подколенного сегментов. Эти пациенты составили основную группу. Контрольную группу составил 51 пациент, у которых оперирующие хирурги руководствовались только традиционными критериями оценки жизнеспособности мышц, не учитывая при принятии решения результаты ИГХИ.
Полученные результаты. Сравнительная характеристика информативности различных интраоперационных критериев жизнеспособности мышечной ткани на уровне ампутации представлена на диаграмме.
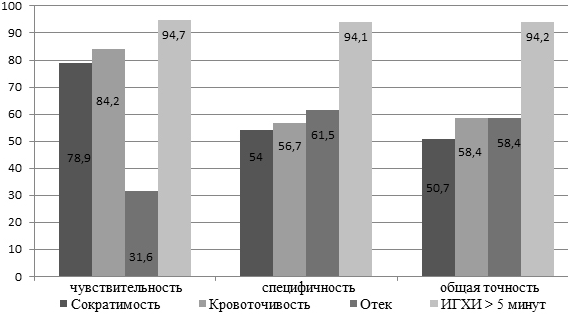
Рис. 1. Информативность различных интраоперационных критериев оценки жизнеспособности мышц на уровне ампутации.
Как следует из представленной диаграммы, в наших наблюдениях отмечена значительно более высокая общая точность ИГХИ по сравнению с субъективными критериями оценки жизнеспособности мышечной ткани как за счет более высокой чувствительности, так и вследствие значительно более высокой специфичности. Другими словами, если при пониженной кровоточивости и сократимости мышц в значительном числе наблюдений можно было рассчитывать на неосложненное течение послеоперационного периода, то замедление образования пигмента в биоптате мышцы свыше 5 минут с высокой степенью достоверности являлось предиктором клинически значимого мионекроза культи. В то же время, высокая скорость реакции свидетельствовала о достаточной активности процессов аэробного обмена в мышце и, следовательно, позволяла считать адекватным выбор уровня ампутации.
В основной группе в зависимости от полученных результатов, принимали решение о возможности выполнения ампутации на данном, наиболее дистальном, уровне, а также о возможности одномоментного формирования культи и способе хирургического закрытия раны. Нами были использованы следующие варианты хирургической тактики, которые представлены в табл. 1.
Таблица 1. Варианты хирургической тактики при высокой ампутации нижних конечностей в зависимости от результатов ИГХИ

Как видно из представленных данных, стандартная ампутация на предварительно выбранном уровне выполнена менее чем в половине наблюдений. В 6 наблюдениях на основании результатов интраоперационного исследования было принято решение о сохранении коленного сустава при проксимальной окклюзии артериального русла. В каждом четвертом наблюдении для атипичного формирования культи были использованы мышцы с более высокой скоростью реакции. При пограничном значении ИГХИ мы предпочитали отказаться от одномоментного формирования культи, выполнив гильотинную ампутацию с последующим наложением вторичных швов на рану.
Нами проведена оценка непосредственных результатов операции у пациентов, перенесших ампутацию нижних конечностей по поводу хронической критической ишемии. Первые осложнения – гематома и некроз кожи регистрировались на 2 - 4 сутки послеоперационного периода. Нагноение раны диагностировали, как правило, на 4 - 6 день. Самым поздним и, в то же время, самым тяжелым послеоперационным осложнением, проявляющимся на 7 – 14 день, был некроз мышц культи . Следует отметить, что при анализе частоты послеоперационных осложнений мы также учитывали такие осложнения, как небольшие участки краевого некроза кожи и частичное расхождение краев операционной раны, не влияющие на сроки госпитализации.
Общее число ранних послеоперационных осложнений составило в основной группе 9 наблюдений (17,3%). В контрольной группе местные осложнения раннего послеоперационного периода развились у 17 (33,3%) пациентов.
При сравнении частоты и характера ранних послеоперационных осложнений в двух группах пациентов, были получены следующие данные (рис. 2).
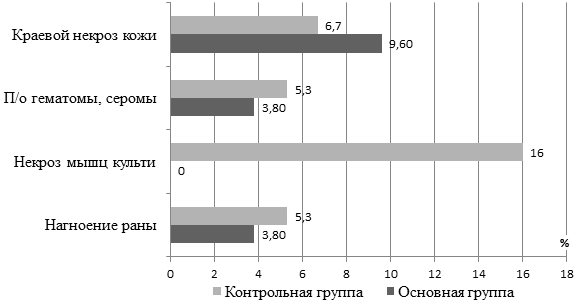
Рис. 2. Структура ранних послеоперационных осложнений высокой ампутации конечности при использовании различных интраоперационных критериев жизнеспособности тканей.
Как видно из представленной диаграммы, при ампутации, выполненной без учета данных ИГХИ, почти половину (8 из 17 случаев) от общего числа ранних послеоперационных осложнений составил мионекроз - наиболее тяжелый вид осложнений, в большинстве наблюдений приводящий к необходимости реампутации. Другими наиболее распространенными осложнениями были некроз кожи, гематома и нагноение раны.
При использовании ИГХИ для окончательного определения уровня ампутации и способа формирования культи общая частота ранних послеоперационных осложнений составила 17,3%, при этом мы не наблюдали ни одного случая некроза мышц культи. Существенного влияния на частоту других осложнений использование данного теста не оказало.
Обсуждение. Несмотря на многовековую историю вопроса, огромное количество выполняемых ампутаций, а также чрезвычайно высокую частоту послеоперационных осложнений и неудовлетворительные функциональные результаты, проблема объективизации выбора уровня ампутации остается непопулярным направлением в хирургической науке. На практике же вопрос об уровне ампутации у пациентов с хронической критической ишемией, как правило, сводится к дилемме «бедро или голень» и в большинстве случаев решается в пользу более «надежного» проксимального уровня вмешательства. Однако, и в этом случае во время операции возникают сомнения в адекватности выбранного уровня, возможности одномоментного закрытия раны и способе формирования культи.
Жизнеспособность тканей на уровне ампутации оценивается по визуальным признакам, отражающим состояние микроциркуляции (кровоточивость тканей и отек), сохранение функции (сократимость мышечных волокон при раздражении), а также дистрофические изменения тканей. Проведенное нами исследование показало, что эти признаки обладают невысокой чувствительностью и низкой специфичностью. На практике это приводило к тому, что, несмотря на видимые изменения мышц, хирурги в большинстве случаев выполняли стандартную ампутацию на предварительно выбранном уровне, заранее предполагая высокий риск послеоперационных осложнений.
Разработанный нами метод основан на оценке активности трансаминаз, в мышечной ткани и, таким образом, косвенно отражает ее репаративный потенциал. Условное название «ИГХИ» (Интраоперационное макроскопическое Гистохимическое Исследование) выбрано нами для того, чтобы подчеркнуть, что оценивается не кровоснабжение тканей и не морфологические изменения в них, а активность аэробного гликолиза и окислительного фосфорилирования. В нашем исследовании метод продемонстрировал высокую информативность при прогнозировании развития послеоперационного мионекроза культи. Это дало основания к использованию ИГХИ для дифференцированного подхода к способу формирования культи у пациентов с хронической критической ишемией. В результате нам удалось улучшить функциональный результат, выполнив ампутацию ниже коленного сустава у 6 (11,6%) пациентов с высокой окклюзией артериального русла и одновременно существенно снизить число ранних послеоперационных осложнений. Постепенное накопление опыта, отработка методики, строгий температурный режим позволили повысить информативность исследования и улучшить результаты лечения по сравнению с опубликованными ранее [9].
Выводы. На основании представленных данных можно сделать вывод, что интраоперационный гистохимический экспресс-метод определения активности лактатдегидрогеназы мышечной ткани на уровне ампутации у пациентов с хронической критической ишемией нижних конечностей (ИГХИ) является информативным методом оценки жизнеспособности тканей и может быть использован в качестве объективного критерия выбора оптимального уровня ампутации и способа формирования культи. Использование метода позволило выполнить ампутацию на уровне голени у 11,6% пациентов с окклюзией подвздошно-бедренного сегмента артериального русла и одновременно снизить число ранних послеоперационных осложнений с 33,3 до 17,3% за счет снижения числа случаев мионекроза культи.
Данный метод позволяет объективизировать дифференцированный подход к тканям в условиях хронической ишемии и в перспективе может найти применение в других областях хирургии.
