Введение. Острые нарушения мозгового кровообращения (ОНМК) остаются современной медико-социальной проблемой. В настоящее время каротидная эндартерэктомия (КЭАЭ) является самым эффективным способом предотвращения ишемического инсульта (ИИ) у больных определенных групп. Эффективность КЭАЭ в профилактике ИИ по сравнению с консервативным лечением доказана несколькими многоцентровыми рандоминизированными исследованиями: NASCET, ECST, ACAS [2,3,4,5]. В настоящее время в мировой ангиохирургической практике лечения атеросклероза сонных артерий (СА) лидирующее место завоевывают методики классической каротидной эндартерэктомии с пластикой заплатой и эверсионной КЭАЭ (ЭКЭАЭ) [8]. По данным некоторых исследователей ЭКЭАЭ является методом реконструкции СА, которая связана с меньшим риском развития рестенозов, окклюзий СА и ИИ послеоперационном периоде [6,7]. Сторонники ЭКЭАЭ указывают на ее преимущества: сохранение ангиоархитектоники СА, адекватная коррекция кровотока без использования инородного материала, снижение риска возникновения турбуленции кровотока, оптимальные условия гемодинамики [3]. В арсенале хирурга имеются несколько способов выполнения данного вида реконструкции: Kieny R., De Bakey М.E., Chevalie J. Способ De Bakey М.E. применим только при очень коротких бляшках ВСА и в настоящее время имеет только историческую ценность. Способ Chevalie J. имеет те же недостатки, что и предыдущий, но используется при лучшей визуализации области бифуркации. Этот способ более трудоемкий и увеличивает время пережатия СА. Недостатками способа Kieny R. является частая необходимость дополнительной эндартерэктомии из общей сонной артерии (ОСА), которая приводит к образованию «порога» и частичному отслоению интимы проксимальнее зоны эндартерэктомии, что является причиной турбуленции кровотока и адгезии тромбоцитов, увеличивает время пережатия СА. А без проведения эндартерэктомии из ОСА повышается риск развития тромбозов и окклюзий внутренней сонной артерии (ВСА) [1]. Основной задачей современной ангиохирургии является разработка способа реконструкции, задачей которого является дальнейшее улучшение результатов данной операции. В настоящее время нами предложен новый модифицированный способ ЭКЭАЭ [1].
Цель. Изучить результаты нового способа реконструкции сонных артерий и показать его безопастность.
Материалы и методы. Проведен ретроспективный анализ историй болезни 142 пациентов, которым была выполнена ЭКЭАЭ по поводу атеросклеторического поражения СА. Оперативные вмешательства выполнены в отделении сосудистой хирургии Городской клинической больницы №13 за период с 2009 по 2014 г. Все больные поступили в отделение в плановом порядке. Показаниями к КЭАЭ в нашем исследовании для симптомных пациентов служила степень стеноза ВСА более 60%, при наличии нестабильной бляшки – более 50%. В случае асимптомного поражения ВСА операцию выполняли при стенозе ВСА на 70% и более. Все больные были разделены на две группы. В первую группу вошли 60 пациентов, которым была выполнена ЭКЭАЭ по оригинальному способу [8].
Этот способ является дальнейшим совершенствованием ЭКЭАЭ. Данный способ выполняется следующим образом. Производится разрез кожи, подкожной клетчатки и m. platysma вдоль m. sternocleidomastoideus. Выделяется бифуркация ОСА, начальный отдел наружной сонной артерией (НСА) с a. thyroidea superior и ВСА. Затем осторожной пальпацией ВСА в области бифуркации устанавливается границы бляшки. Далее скальпелем отсекается ВСА от зоны бифуркации с широким захватом передней и боковых стенок ОСА в пределах неизмененной артерии с оставлением узкой полоски задней стенки ОСА около 3-5 мм в виде мостика (рис. 1).
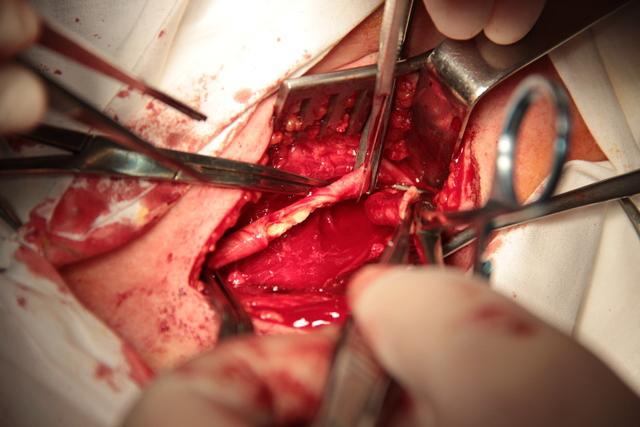
Рис 1. Отсечение a. carotis interna от a. carotis communis с широким захватом (интраоперационное фото).
Затем производится эверсия отсеченной ВСА с удалением бляшки (рис. 2). Таким образом, одновременно освобождается от бляшки и ВСА, и ОСА. При необходимости выполнения эндартерэктомии из НСА лопаточкой для эндартерэктомии отслаивается интимальную оболочку по середине «мостика» задней стенки ОСА. В некоторых случаях для увеличения возможности эверсии ВСА рассекается на 5-6 мм в краниальном направлении.
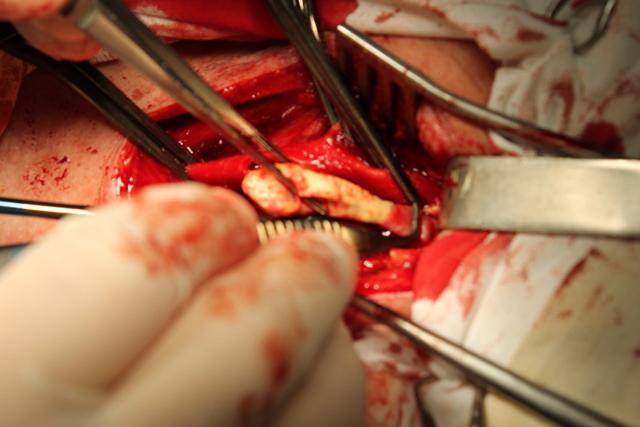
Рис. 2. Эверсия a. carotis interna с отделением бляшки длинной 4,5 см (интраоперационное фото).
После тщательной ревизии внутренней поверхности сосуда и удаления флотирующих остатков интимы и бляшки в дальнейшем начинается наложение анастомоза (рис. 3).
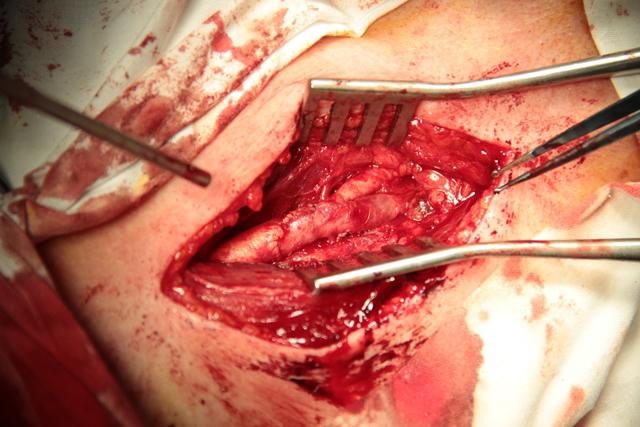
Рис. 3. Окончательный вид анастомоза между a. carotis interna и a. carotis communis.
Предлагаемый способ имеет ряд преимуществ:
- Возможность одномоментного удаления бляшки, переходящей на ОСА, без необходимости отдельной эндартерэктомии из ОСА,
- Отсутствует «порог», неминуемо возникающий при эндартерэктомии из ОСА. Если выполняется эндартерэктомия из задней стенки ОСА, «порог» нивелируется швами анастомоза вследствие близкого расположения рядов швов медиальной и латеральной губ анастомоза,
- Возможность эндартерэктомии при пролонгированной бляшках (>2,5 см, рис. 2),
- Формирование широкого анастомоза.
Во вторую группу вошли 82 пациента, которым была выполнена ЭКЭАЭ по способу Kieny R. В группу сравнения была выбран этот способ, так как он в настоящее время является самым распространенным способом реконструкции сонных артерий [1-4].
В предоперационном периоде всем пациентам проводилось стандартное обследование: лабораторное исследование крови и мочи, системы гемостаза, электрокардиографию, рентгенография грудной клетки, УЗДС брахиоцефальных артерий (БЦА), рентгенконтрастная ангиография (РКА) (рис. 4), мультиспиральная компьтерно-томографическая ангиография (МСКТ-ангиография) БЦА. Степень стеноза ВСА рассчитывали согласно рекомендациям NASCET.
Распределение пациентов по полу и возрасту представлено в табл. 1, 2.
Таблица 1. Распределение пациентов по полу
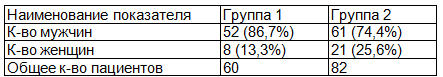
Таблица 2. Сравнительный анализ распределения пациентов по возрасту в исследуемых группах
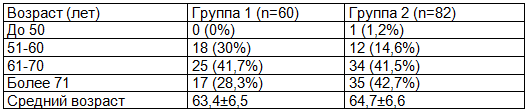
Проводилась оценка сопутствующей патологии, что представлено в табл. 3.
Таблица 3. Оценка сопутствующей патологии
Проводилась оценка неврологической симптоматики пациентов (по Покровскому А.В.), что представлено в табл. 4.
Таблица 4. Сравнительный анализ пациентов по неврологической симптоматике

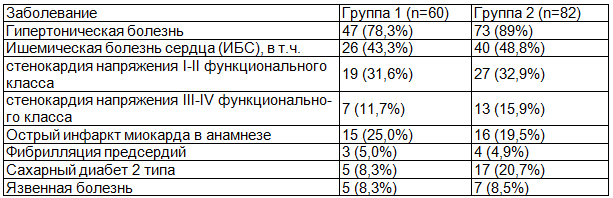
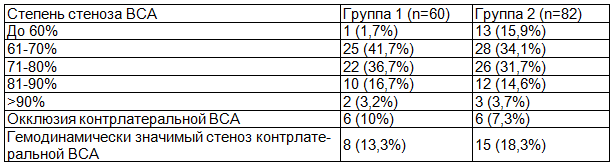
Распределение пациентов по степени стеноза ВСА, представлено в табл. 5.
Таблица 5. Распределение пациентов по степени стеноза внутренней сонной артерии
На операции во время пережатия СА с целью защиты головного мозга использовали управляемую артериальную гипертензию, системную гепаринизацию, внутривенное введение глиатилина или церебролизина, фармакологическую депрессию мозга фентанилом и тиопенталом. Уровень мозгового кровотока оценивали церебральной оксиметрией, ТКДГ (транскраниальной допплерографией) и ЭЭГ (электроэнцефалографией). Все пациенты в послеоперационном периоде в течение 24 часов находились на лечении в отделении реанимации и интенсивной терапии. При неосложненном течении послеоперационного периода пациенты переводились для дальнейшего лечения в отделение.
Результаты. Летальность в первой группе составило 1,7% (один пациент умер от геморрагического инсульта). Нелетальный ИИ на стороне операции был зафиксирован у одного пациента (1,7%). Инфаркт миокарда был зарегистрирован у одного пациента (1,7%). Преходящее нарушение мозгового кровообращения по типу ТИА с полным регрессом неврологической симптоматики в течение 24 часов от начала заболевания было зарегистрировано у одного (1,7%) пациента. Повреждение черепно-мозговых нервов (ЧМН) было зафиксировано у одного больного (1,7%). В данном случае произошло повреждение возвратного гортанного нерва (ветвь блуждающего нерва). Послеоперационные гематомы шеи были зафиксированы у трех пациентов (5%), что потребовало проведения повторного оперативного вмешательства. Протяженность эндартерэктомии в данной группе была 3-3,5 см. Койко-день в данной группе пациентов составил от 10 до 43 (в среднем 21,3±5,5).
Госпитальная летальность во второй группе составило 3,7 %- трое пациентов скончались от ИИ на стороне операции. Нелетальный ИИ на стороне операции развился у одного больного (1,2%). Преходящие нарушения мозгового кровообращения по типу ТИА зафиксированы у двоих пациентов (2,4%). Неврологическая симптоматика у них регрессировала в течение 24 часов от начала симптомов. Повреждение ЧМН было диагностировано у троих (3,7%) больных. В одном случае произошло повреждение возвратного гортанного нерва, в двух лицевого нерва. Послеоперационная гематома шеи была зафиксирована у одного пациента (1,2%), что потребовало проведение повторного оперативного вмешательства. Протяженность эндартерэктомии в данной группе была 1,5-2 см. Койко-день в данной группе составил от 9 до 44 (в среднем 20,8±7,4).
Обсуждение. Полученные результаты подвергались статистической обработке. Обработка полученных данных производилась на персональном компьютере на базе операционной системы Windows XP с использованием прикладных программ Statistica 6.0. Для сравнительного анализа клинических показателей в номинативной шкале измерения использовали многофункциональный непараметрический критерий Фишера.
Одним из самым важных моментов КЭАЭ служит адекватность и полнота эндартерэктомии. Основным преимуществом нашего способа является возможность одномоментного удаления бляшки, переходящей на ОСА, без отдельного проведения эндартерэктомии из ОСА. Ведь нерадикальная эндартерэктомия в послеоперационном периоде может явиться причиной эмболии и ОНМК [2]. Данный способ позволит провести радикальную эндартерэктомию. Также этот способ, возможно, применить при пролонгированных бляшках (> 2,5 см) (рис. 2), что является противопоказанием к другим способам ЭКЭАЭ [2, 3].
По данным некоторых авторов, в послеоперационном периоде одной из причин развития рестеноза является интимальная гиперплазия, которая развивается непосредственно в зоне линии швов и обусловлена реакцией на механическое повреждение и инородный материал [3, 8]. При предложенном нами способе происходит формирование широкого анастомоза, что предотвращает сужение просвета артерий и снижает риск развития окклюзий, тромбозов и рестенозов ВСА.
При новом способе ЭКЭАЭ происходит формирование луковицы ВСА физиологических размеров, тогда как в других способах реконструкции не всегда есть возможность сформировать луковицу прежних размеров (рис. 3). В отдаленном послеоперационном периоде это может стать причиной развития турбуленции кровотока и рестеноза ВСА.
Для оценки качества и эффективности выполнения КЭАЭ Покровский А.В. предлагает использовать суммарный показатель «инсульт + летальность от инсульта», и он в ближайшем послеоперационном периоде не должен превышать 5% [2,3]. Указанный показатель в первой группе составил 3,4%, а во второй группе был близок к «потолку» и составил 4,9% (p>0,05). Летальность в первой группе составила 1,7%, во второй 3,7% (p>0,05). ИИ реже встречался в первой группе - 1,7 % против 4,9% (p>0,05). В отношении преходящих нарушений мозгового кровообращения по типу ТИА: чаще они возникали во второй группе - 2,4% против 1,7% (p>0,05). Таким образом, говоря о результатах ЭКЭАЭ выполненных по оригинальному способу и Kieny R., с позиции статистической достоверности не влияет на непосредственные исходы операций. По результатам в ближайшем послеоперационном периоде эти способы сопоставимы между собой. Следовательно, предложенный нами способ реваскуляризации головного мозга имеет более широкие показания к его применению и является безопастным. Для полной оценки эффективности данного способа реконструкции необходимо изучение его отдаленных результатов. В данном направлении мы проводим наше исследование.
Выводы
- Эверсионная каротидная эндартерэктомия, выполненная по оригинальному способу, является безопасной и может быть предложена для широкого использования в сосудистой хирургии.
- Данный способ возможно применить при пролонгированных атеросклеротических бляшках длиной более 2,5 см.
