Введение. Варикозная болезнь нижних конечностей является полиэтиологическим заболеванием. В индустриально развитых странах ежегодные суммарные затраты на лечение варикозной болезни вен нижних конечностей составляют от 1% до 3% общего бюджета здравоохранения [1]. Медико-социальная значимость проблема обусловлена тем, что заболеванию подвержена работоспособная и социально активная возрастная группа населения. Заболевание сопровождается длительным рецидивирующим течением, которое приводит к снижению качества жизни и трудоспособности больных, высоким уровнем инвалидизации больных и значительными экономическими затратами [1,2]. Среди многочисленных производящих факторов заболевания следует отнести: застой венозной крови; патологический сброс венозной крови из глубокой системы вен в поверхностную (вертикальный и горизональный рефлюкс).
К особенностям строения венозной системы нижних конечностей является наличие венозных клапанов, а также наличие перфорантных вен (истинных и ложных).
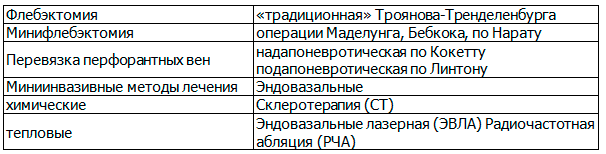
На протяжении столетия операция Троянова-Тренделенбурга была общепринятой методикой лечения, но за последнее время наибольшее распространение получили миниинвазивные эндовенозные методы тепловой и химической абляции [1,2], табл. 1.
Таблица 1. Хирургические методы лечения варикозной болезни
Основная часть. В общей структуре хирургических заболеваний варикозная болезнь составляет около 5%, среди заболеваний периферических сосудов - от 10 до 40%. В основе заболевания лежит анатомо-физиологические особенности строения венозной системы нижних конечностей: наличие двух венозных систем, поверхностной и глубокой. К системе глубоких вен относятся большеберцовые, малоберцовые, подколенные, бедренные и подвздошные вены. Поверхностная венозная система в подавляющем большинстве случаев состоит из большой и малой подкожных вен, в ряде случаев встречается добавочная передняя подкожная вена. Большая подкожная вена от внутренней лодыжки поднимается по передневнутренней поверхности бедра в расщеплении поверхностной фасции, конечный ее отдел прободает решетчатую фасцию и впадает в бедренную вену (сафенофеморальное соустье). Малая подкожная вена начинается кзади от наружной лодыжки и впадает чаще всего в подколенную вену (сафенопоплитеальное соустье). Устье малой подкожной вены может проецироваться выше или ниже подколенной ямки. Поверхностная и глубокая венозная системы связаны между собой перфорантными венами, число и вариантная анатомия которых могут быть различными. Наиболее часто встречаются перфоранты Коккета, Хантера и Додда [3,4]. Вены имеют клапаны, число которых различно и уменьшается по направлению к центру.
Наиболее частым проявлением хронической венозной недостаточности является несостоятельность клапанного аппарата большой подкожной вены (БПВ) и других поверхностных вен, которые осуществляют возврат венозной крови от нижних конечностей к сердцу, что приводит к расширению вен, застою венозной крови, вызывая такие симптомы и физические явления, как усталость, отечность, боль, постоянные кожные изменения, спонтанное кровотечение из варикозно расширенных вен и трофическое изъязвление нижних конечностей [5].
Цель исследования: сравнить результаты применеия РЧА, ЭВЛА, склеротерапии стволов со стандартной флебэктомией при ВБ в исследуемой и контрольной группах, проанализировать болевой синдром и эффективность миниинвазивных методов лечения, доказав преимущество РЧА и сопоставимость ее по эффективности с другими методами оперативного лечения.
Материалы и методы исследования. В исследовании приняли участие больные (n=120) разных возрастных групп (от 18 до 77 лет), обоих полов (70% женщин, 30% мужчин). Все больные были поделены на 2 группы пациентов. В первую группу вошли больные, которым лечение ВБ проводилось миниинвазивными эндовазальными методами (n=60), во вторую группу вошли больные, которым проведена традиционная флебэктомия (ФЭ) (n=60). В исследуемой группе больных, для лечение которых применялись миниинвазивные методы, производилась оценка болевого синдрома по визуально-аналоговой шкале, оценка качества жизни по опроснику CIVIQ2, симптомов и тяжести заболевания по опроснику VCSS.
Критерии отбора пациентов. Критерии включения: подтвержденная методом УЗИ клапанная несостоятельность БПВ/МПВ; подтвержденная методом УЗИ возможность проведения РЧА или ЭВЛА (см. критерии исключения); класс по CEAP выше С2; возможность и желание пациента участвовать в исследовании. Критерии исключения: ВБ без клапанной несостоятельности БПВ по данным УЗИ исследования; повышенная извитость БПВ выше области коленного сустава, что является неприемлемым для проведения РЧА ; диаметр БПВ менее 3 мм, и более 12 мм; острый ТГВ; больные с имплантированным кардиостимулятором/ дефибрилятором; больные с сопутствующей патологией артериального русла; период беременности и кормления грудью; тромбофилия в анамнезе, ассоциированная с высоким риском возникновения тромбоэмболий; злокачественные опухоли; наличие в анамнезе флебэктомии.
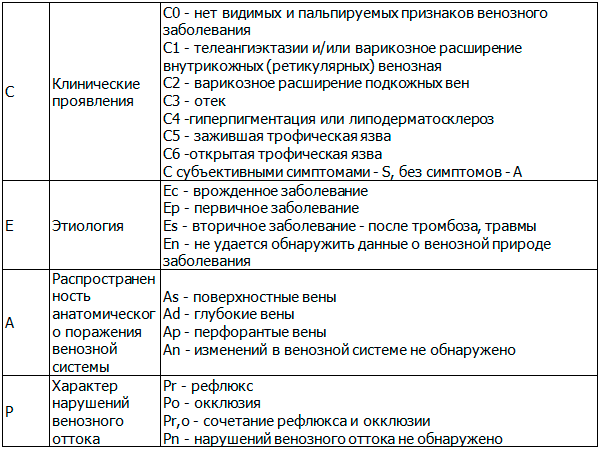
В основе диагностики варикозной болезни лежит классификация CEAP (табл. 2), разработанная в 1994 г. Используя С-компонент вышеуказанной классификации, определялась клиническая стадия заболевания.
Таблица 2. Классификации CEAP
Проводилась клиническая, функциональная, гемодинамическая диагностика и ультразвуковое исследование. В зависимости от анатомии и диаметра вены больному предлагались варианты лечения.
«Золотым стандартом» диагностики в настоящее время является проведение ультразвукового дуплексного сканирования вен (УЗДГ) [5,6]. Данный метод исследования является неинвазивным и позволяет точно определить локализацию перфорантных вен, выявить наличие вено-венозных рефлюксов в цветовом коде. Для определения недостаточности клапанов используют пробу Вальсальвы. Антероградный кровоток окрашивается синим, ретроградный - красным (рис. 1). Флебография показана больным с трофическими нарушениями.
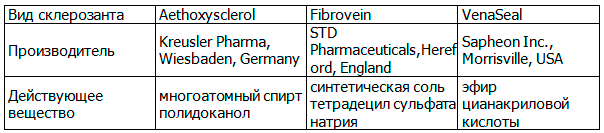
Склеротерапия представляет собой введение в просвет раздражающих химических веществ, которые вызывают воспаление эндотелия стенки вены с последующей облитерацией участка вены посредством фиброза [7] (табл. 3).
Таблица 3. Основные виды склерозантов
Склеротерапия является нетепловым методом абляции [8]. Большинство авторов негативно относятся к склерозирующей терапии как к самостоятельному методу лечения. Наилучшие результаты дает ее комбинация с флебэктомией [9]. К преимуществу склеротерапии относится отсутствие необходимости применения тумесцентной анестезии [5].
К тепловым методам абляции относятся ЭВЛА и РЧА, оба метода требуют применения тумесцентной анестезии.
Методика ЭВЛА заключается в нагревании венозной крови до 800 градусов Цельсия [2]. В отличие от РЧА, у лазерного световода нет механизма обратной связи для контроля постоянной температуры, успех лечения напрямую зависит от квалификации хирурга. Положение лазерного световода и радиочастотного катетера контролируется интраоперационно путем применения УЗДГ-исследования, которое осуществляется ассистентом, самим хирургом, владеющими методикой проведения УЗДГ, или приглашенным врачом ультразвуковой диагностики.
Метод радиочастотной абляции (РЧА) заключается в использовании электродного катетера, который проводит переменную радиочастотную волну, что приводит к венозному спазму, разрушению коллагеновых волокон и сужению просвета стенки вены [10]. Методика радиочастотной абляции исключает применение лишних разрезов, сопровождается постоянным ультразвуковым контролем, что позволяет избирательно блокировать патологический венозный рефлюкс, уменьшает и ликвидирует варикозно расширенные вены. Аппарат VNUS ClosureFast (рис. 2,(VNUS Medical Technologies, Сан-Хосе, Калифорния) работает, обеспечивая тепловую абляцию в 7-сантиметровых сегментах, в температурном режиме от 85 до 120 градусов Цельсия, в рамках определенного временного интервала [1].
Техника проведения радиочастотной абляции вен: под контролем ультразвука производят катетеризацию вены, после чего проводят тумесцентную анестезию вокруг варикозно расширенного сегмента вены. После контроля положения катетера датчиком УЗИ начинается процедура РЧА. Процесс полуавтоматизирован: врач нажимает кнопку на аппарате, кончик катетера длиной 7 см нагревается, вызывая разрушение эндотелия сосуда, после чего катетер подтягивается на 7 см и процедура повторяется. Цикл лечения составляет 20 секунд [10,11]. На прилежащий к сафенофеморальному соустью сегмент применяют два цикла, на остальные участки вены - один.
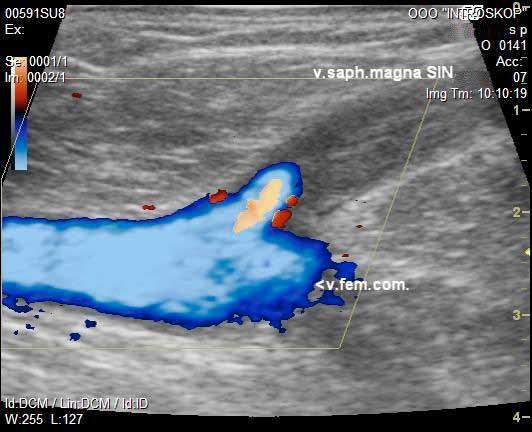
Рис. 1. УЗДГ вен нижних конечностей.

Рис. 2. Аппарат VNUS Closure Fast.
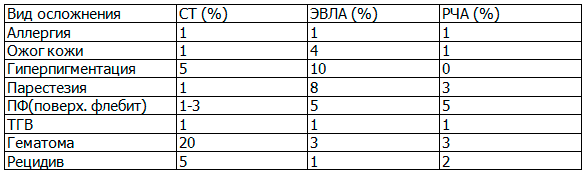
К основным осложнениям миниинвазивных эндовазальных методов лечения относятся: аллергические реакции, ожог кожи, гиперпигментация, парестезия, поверхностный тромбофлебит (ПФ), тромбоз глубоких вен (ТГВ), возникновение гематом, рецидив заболевания (табл. 3).
Таблица 4. Осложнения при применении миниинвазивных эндовазальных методов лечения ВБ
Результаты и обсуждение. Для успешного лечения варикозной болезни вен необходимо предварительное тщательное обследование больного, проведение УЗДГ обязательно на всех этапах диагностики и лечения. При невозможности проведения вышеуказанного исследования возможно проведения стандартной ультразвуковой допплерографии. В настоящее время роль флебографии снизилась, однако, ее рекомендовано проводить больным с трофическими изменениями. По результатам лечения, все интервенционные методики современного лечения варикозной болезни рентабельны и эффективны. Метод лечения ВБ путем применения РЧА является эффективным и сопоставим с ЭВЛА и СТ.
Выводы. Все миниинвазивные эндовазальные методы превосходят ФЭ по результатам лечения. Местная анестезия более предпочтительна для больных с ВБ, ее проведение при всех миниинвазивных эндовазальных методах обеспечивает раннюю активизацию больных после операции. Интраоперационный УЗДГ-контроль во время РЧА и ЭВЛА обеспечивает прецизионность вмешательства, что уменьшает риск осложнений. При наличии противопоказаний к миниинвазивным эндовазальным тепловым методам лечения, оптимальной терапией является склеротерапия, при невозможности проведения ни одного из миниинвазивных методов лечения, применяют традиционную флебэктомию.
