Введение. Аллергические заболевания кожи известны человеку более двух с половиной тысяч лет, однако в современном мире проблемы, связанные с диагностикой, терапией, профилактикой этой патологии, остаются весьма актуальными. Следует отметить, что в настоящее время в мире наблюдается неуклонный рост частоты и распространенности аллергодерматозов: атопического дерматита, контактного дерматита, экземы и крапивницы, от которых в ряде стран страдает до 25% населения. В современной структуре заболеваемости аллергодерматозы занимают третье место после сердечно-сосудистых и онкологических заболеваний [1,4]. За последние 30 лет в течение каждого десятилетия показатели заболеваемости аллергией во всем мире удваивались. Кроме того, повсеместно отмечается нарастание тяжести течения и торпидности аллергодерматозов к проводимой терапии, несмотря на явные успехи в области изучения их иммунопатогенеза и совершенствования фармакотерапии. Аллергические заболевания называют «болезнями современной цивилизации». Аллергодерматозы представляют собой и серьезную медико-социальную проблему, так как нередко лишают больных возможности заниматься профессиональной деятельностью, приводят к длительной нетрудоспособности и даже инвалидизации, что, естественно, сказывается на качестве жизни, существенно снижая его. Экзему кистей, например, называют в числе основных заболеваний, сопряженных с потерей дохода [2,3]. Неблагоприятная динамика роста этой группы заболеваний обусловлена рядом внутренних и внешних факторов. К внешним факторам прежде всего следует отнести загрязнение экологической среды, особенно в промышленно развитых странах, а также постоянный контакт в быту и на производстве с разнообразными химическими веществами (продукты бытовой химии, косметические средства, строительные материалы, металлы, синтетические материалы одежды и обуви). Подъему заболеваемости аллергодерматозами, несомненно, способствует употребление большого количества лекарств, в том числе витаминов и пищевых добавок, консервов и продуктов фаст-фуда, генно-модифицированных продуктов. По данным эпидемиологических исследований, рост аллергодерматозов напрямую можно связать с возрастанием численности людей, имеющих «аллергенные» профессии (строители, химики, пищевики, медики, парикмахеры). К внутренним факторам относят наследственность, как, например, при атопическом дерматите (АД), болезни желудочно–кишечного тракта (ЖКТ), эндокринопатии, очаги фокальной хронической инфекции, в том числе и располагающиеся на коже (микоз стоп, рожистое воспаление, пиодермии) [1,3]. Несмотря на определенные успехи в лечении атопических заболеваний, поиск новых лекарственных препаратов с противоаллергической и противовоспалительной активностью по-прежнему сохраняет свою актуальность. В настоящее время в качестве противоаллергических препаратов используют вещества с различной химической структурой и механизмом действия. В связи с тем, что при аллергии наряду со специфическими иммунологическими изменениями происходят существенные метаболические сдвиги (в частности, наблюдается активация реакций свободно-радикального окисления на фоне понижения активности антиоксидантных систем) перспективным является исследование эффектов препаратов с антиоксидантной активностью при аллергических поражениях. Наличие противоаллергической активности отмечено у антиоксидантов различной химической структуры, в том числе серу содержащих веществ, производных 3-оксипиридина, сукцинат содержащих соединений и других. Одной из перспективных групп для поиска новых лекарственных веществ с противоаллергической активностью являются производные тиодиазона.
Целью настоящего исследования явилась оценка противоаллергической активности новых производных тиодиазона при кожной анафилактической реакции у мышей.
Материалы и методы исследования. Изучение противоаллергической активности новых производных тиодиазона проводили на модели активной кожной анафилаксии у мышей [11]. Эксперименты выполнены на 40 белых неинбредных мышах обоего пола массой 20,2±0,4 г. Подопытных животных содержали в условиях вивария (с естественным режимом освещения; при температуре 22-24о; относительной влажности воздуха 40-50%) с использованием стандартной диеты (ГОСТ Р 50258-92). Исследования проводили в соответствии с правилами качественной лабораторной практики при проведении доклинических исследований в РФ [12], а также правилами и Международными рекомендациями Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях [9]. Перед постановкой эксперимента животные проходили карантин в течение 10-14 дней [14, 15]. Сенсибилизацию подопытных животных проводили трехкратным ежедневным подкожным введением 1 мкг овальбумина (Sigma, grade III) разведенного в 0,2 мл изотонического раствора натрия хлорида с равным количеством вазелинового масла. Постановку реакции активной кожной анафилаксии осуществляли на 21-е сутки латентного периода сенсибилизации. С этой целью подопытным животным в хвостовую вену вводили краситель синий Эванса (0,25 мл 1,6% раствора на 100 г веса), после чего внутрикожно – 0,05 мл овальбумина (антигена), что приводило к развитию местной аллергической реакции. Через 20 минут подопытным животным внутрибрюшинно вводили исследуемое вещество. После достижения эффекта исследуемого вещества повторно внутрикожно вводили антиген с другой стороны живота. Через 20 минут животных (под эфирным наркозом) забивали, отсепаровывали кожу и оценивали результаты реакции. Визуально кожная анафилаксия проявлялась окрашиванием участка кожи в синий цвет, что было связано с выходом красителя из кровеносного русла в очаг аллергического поражения. Выраженность реакции активной кожной анафилаксии оценивали по площади контрольных пятен (до введения исследуемого вещества) и опытных (после введения исследуемого вещества). Эффекты исследуемых соединений при кожной анафилактической реакции сравнивали с действием синтетического антиоксиданта – этилметилгидроксипиридина сукцината в дозе 100 мг/кг (мексидол; Фармасофт, Россия) и одного из самых активных препаратов для лечения анафилаксии глюкокортикостероида преднизолона в дозе 0,5 мг/кг (преднизолон; Nycomed, Австрия). Исследовали действие двух новых производных тиодиазона с лабораторными шифрами ЛХТ 3-10 и ЛХТ 10-10, синтезированных в ОАО «Всероссийский центр по изучению безопасности биологически активных веществ» (ВНЦ БАВ, Россия, Старая Купавна). Исследуемые соединения вводили внутрибрюшинно в терапевтической дозе равной 1/20 полулетальной дозы, (ЛД50) (50 мг/кг). Значение ЛД50 рассчитывали по данным токсикологических исследований. Оценку острой токсичности новых производных тиодиазона при их однократном внутрибрюшинном введении мышам проводили методом Прозоровского В.Б., Прозоровской М.П. [16]. В опытах по оценке острой токсичности использовали белых неинбредных мышей (n=20) обоего пола массой 20,2±0,4 г. Перед введением исследуемые вещества разводили в изотоническом растворе натрия хлорида. Вещества ЛХТ 3-10 и ЛХТ 10-10 испытывали в дозах по 7, 14, 28, 56, 112 мг на мышь (соответственно 350, 700, 1400, 2800, 5600 мг/кг). Логарифмы значений этих доз отличались на 0,3. Исследуемые соединения в указанных дозах вводили подопытным животным однократно внутрибрюшинно. Общая продолжительность наблюдения за животными составила 14 дней, причем в первый день после введения животные находились под непрерывным наблюдением. Регулярно фиксировали их общее состояние и поведение, состояние шерстного покрова, определяли массу тела. В каждой группе животных учитывали число смертельных исходов за весь срок наблюдения. Результаты исследования обработаны статистически с применением стандартного пакета программ Microsoft Office Excel 2003. Для ряда выборок вычисляли среднюю арифметическую и среднюю квадратическую ошибку. Определение нормальности распределения переменных проводили на основании гистограмм распределения, величины асимметрии и эксцессы. Для оценки достоверности различий выборок, имеющих нормальное распределение, применяли параметрический t-критерий Стьюдента. За достоверное принимали различие при уровне вероятности 95% и более (p <0,05).
Результаты и их обсуждение. Анализ результатов токсикологических исследований показал, что все исследованные новые производные тиодиазона при внутрибрюшинном введении подопытным мышам обладают низкой токсичностью. Было отмечено, что при введении подопытным мышам соединений ЛХТ3-10 и ЛХТ10-10 в дозах 350 мг/кг, 700 мг/кг, 1400 мг/кг и 2800 мг/кг все животные выжили, тогда как при введении этих соединений в дозах и 5600 мг/кг погибли все подопытные мыши (табл. 1).
Таблица 1. Результаты исследования острой токсичности производных тиодиазона под лабораторными шифрами ЛХТ 3-10 и ЛХТ 10-10
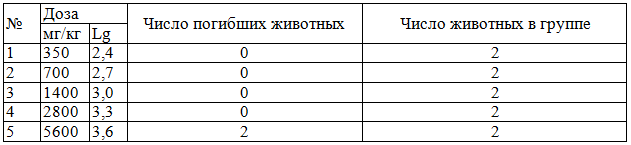
Значение ЛД50 исследованных соединений при внутрибрюшинном введении мышам составило 2500мг, что было определено на основании данных последовательности реакций в эксперименте (0, 0, 0, 2 из 2-х) по таблице средних эффективных доз и их ошибок при разных последовательностях реакций [16]. Ошибка, откладываемая в сторону больших доз, превышала ошибку, откладываемую в сторону меньших доз, так как при проведении токсикологических исследований дозы исследуемых веществ были расположены в логарифмической шкале (логарифмы используемых доз отличались на 0,3) и ошибки были исчислены в логарифмах, то при переходе к числовым значениям ошибок они оказывались разноликими. В дальнейших исследованиях производные тиодиазона использовали в дозе, равной 5% от ЛД50 (50 мг/кг). Анализ результатов экспериментов по оценке противоаллергической активности показал, что производные тиодиазона под лабораторными шифрами ЛХТ 3-10, ЛХТ 10-10 обладают способностью уменьшать выраженность реакции активной кожной анафилаксии у мышей (табл. 2).
Таблица 2. Влияние производных тиодиазона, этилметилгидроксипиридина сукцината и преднизолона на выраженность активной кожной анафилаксии у мышей
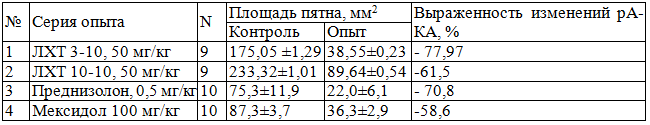
Примечание: * - различия с контролем достоверны (р < 0,05).
Было выявлено, что при внутрикожном введении овальбумина (антигена) у всех сенсибилизированных животных в месте инъекции развивался отёк кожи, связанный с развитием местной аллергической реакции. Размеры окрашенных участков кожи в контроле у всех подопытных мышей составили более 3 мм, что свидетельствовало о наличии высокого уровня сенсибилизации. Следует отметить, что глюкокортикостероид преднизолон (0,5 мг/кг) при внутрибрюшинном введении уменьшал выраженность реакции активной кожной анафилаксии у мышей в среднем в 1,7 раза (р<0,05) по сравнению с контролем. Антиоксидант из группы производных 3-оксипиридина мексидол (100 мг/кг) также угнетал эту местную анафилактическую реакцию, однако его активность в этом отношении была в среднем в 1,2 раза (р<0,05) слабее, чем у преднизолона. Обращает на себя внимание тот факт, что новые соединения, являющиеся производными тиодиазона, также обладали способностью уменьшать выраженность активной кожной анафилаксии у мышей. Было отмечено, что у подопытных животных при внутрибрюшинном введении соединений с лабораторными шифрами ЛХТ 3-10 (50 мг/кг) и ЛХТ 10-10 (50 мг/кг) площадь анафилактического отёка кожи была в среднем в 1,8 раза (р<0,05) меньше, чем в контроле. Приведенные данные показывают, что активность новых производных тиодиазона (ЛХТ 3-10 и ЛХТ 10-10 в дозе 5% от ЛД50) в этом отношении была сопоставима с активностью преднизолона (0,5 мг/кг) и была в среднем в 1,4 раза (р<0,05) выше, чем у мексидола (100 мг/кг). Таким образом, результаты экспериментального исследования показали, что среди производных тиодиазона имеются соединения, обладающие низкой токсичностью и антианафилактической активностью. Возможно, что антианафилактические свойства новых производных тиодиазона ЛХТ 3-10 и ЛХТ 10-10 связаны с антиоксидантными свойствами. Полученные результаты позволяют осуществлять поиск новых соединений с противоаллергической активностью среди производных тиодиазона.
Выводы:
1. Среди производных тиодиазона имеются соединения с противоаллергической активностью.
2. При внутрибрюшинном введении подопытным мышам в дозе 5% от LD50 (50 мг/кг) новые производные тиодиазона ЛХТ 3-10 и ЛХТ 10-10 уменьшали выраженность реакции активной кожной анафилаксии в среднем в 3,5 раза (р<0,05) по сравнению с контролем.
3. Антианафилактическая активность новых производных тиодиазона ЛХТ 3-10 (50 мг/кг) и ЛХТ 10-10 (50 мг/кг) была в среднем в 1,2 раза (р<0,05) выше, чем у мексидола (100 мг/кг) и сопоставима с эффектами преднизолона (0,5 мг/кг).
