У женщин в развитых странах мира рак молочной железы (РМЖ) стойко занимает первое место среди онкологической патологии [2,4]. Статистические сведения, свидетельствуют о неуклонном росте заболеваемости, инвалидизации и смертности от этого заболевания среди женщин различных возрастных групп [4]. Это обусловлено, прежде всего, поздней диагностикой в связи с несвоевременным обращением пациенток, а также отсутствием высокочувствительных методов выявления доклинических проявлений рака. Поэтому ранняя диагностика РМЖ остается одной из наиболее актуальных проблем современной онкологии и лучевой диагностики.
Отличительной особенностью молочной железы является сложность четкой дифференцировки физиологических и патологических изменений [1]. Серьезное влияние на выявляемость и риск возникновения РМЖ оказывает рентгенологическая плотность молочных желез, что связано с низкой чувствительностью и специфичностью маммографии у пациенток с преобладанием железистого компонента [5]. Рубцовые и воспалительные изменения в молочной железе так же значительно затрудняют диагностику. С одной стороны они могут симулировать наличие опухоли, с другой - опухолевый узел может быть пропущен на фоне рубцовой или воспалительной ткани.
К достаточно информативным методам диагностики заболеваний молочных желез относится магнитно-резонансная томография (МРТ). Но, при малых размерах опухоли (до 1,0 см), 10–20% протоковых карцином in situ не накапливают контрастное вещество или характер накопления контрастного препарата сходен с доброкачественными пролиферативными изменениями. Диафаноскопия, инфракрасная термография, радиоизотопная лимфосцинтиграфия, изотопная диагностика с помощью радиоактивного фосфора 32P, прямая цветная лимфография молочных желез не получили широкого применения из-за сравнительно низкой диагностической эффективности.
Общепринятый стандарт обследования пациенток с заболеваниями молочных желез включает в себя клинический осмотр, маммографию, ультразвуковое исследование и методики интервенционной радиологии для морфологической верификации патологических изменений. Но, следует помнить что и маммография, и ультразвуковое исследование молочных желез имеют ряд ограничений в виде гипо- и гипердиагностики.
Гиподиагностика после выполнения стандартной маммографии чаще встречается при рентгенологически плотном фоне (преобладание железистого компонента) молочной железы; также при неправильной интерпретации выявленного непальпируемого узлового образования.
Склерозирующий аденоз, очаги хронического воспаления, послеоперационные и постлучевые изменения могут привести к гипердиагностике при анализе маммограмм.
Внутрипротоковая локализация опухоли, избыточный жировой фон, диффузный фиброаденоматоз, воспалительные процессы могут быть причинами ультразвуковых ложноотрицательных заключений.
Ультразвуковая гипердиагностика чаще встречается у пациенток с инволютивными и послеоперационными изменениями в молочных железах.
Помимо трудностей своевременной диагностики непальпируемых образований молочных желез остается нерешенной проблема дифференциальной диагностики доброкачественных и злокачественных образований, имеющих сходную рентгенологическую или ультразвуковую картину. Таким образом, своевременная диагностика заболеваний молочных желез, в том числе и рака, является первостепенной задачей [3].
Одним из новых лучевых методов обследования молочных желез, позволяющий преодолевать ограничения, присущие маммографии (получения двумерного (2D) изображения трехмерного органа), является цифровой томосинтез [10]. Цифровой томосинтез воспроизводит трехмерную (3D) реконструкцию ткани молочной железы, которую затем можно рассматривать как ряд последовательных срезов с шагом в 1 мм, а так же помогает избежать эффекта наложения структур и, как следствие, появления теней, не существующих в действительности образований [9].
После первого опыта применения цифрового томосинтеза некоторые зарубежные авторы отмечают его диагностический потенциал: повышается чувствительность рентгенологического метода за счет дополнительной информации при многосрезовом режиме, что практически не удлиняет время исследования и существенно не увеличивает лучевую нагрузку на пациента. Анализ литературных данных подтвердил диагностический потенциал метода цифрового томосинтеза при выявлении и уточнении характера непальпируемых образований молочных желез. В большинстве изученных работ отражены лишь отдельные аспекты принципа работы и применения томосинтеза и потому новая технология требует изучения [6,7,8,].
Цель исследования: изучить и оценить дифференциально-диагностическую эффективность метода цифрового томосинтеза у пациенток с непальпируемыми образованиями молочных желез.
Материалы и методы. На дообследование методом цифрового томосинтеза было направлено 70 пациенток с непальпируемыми образованиями молочных желез, выявленными при ультразвуковом исследовании или по данным цифровой маммографии.
В 9 (12,9 %) случаях была диагностирована узловая форма фиброзно-кистозной мастопатии (УФКМ). Диагноз киста молочной железы был предварительно поставлен одной пациентке (1,4 %). Очаговый фиброз и фиброаденома (ФА) отмечались в 6 (8,6 %) и 8 (11,4 %) наблюдениях соответственно. С подозрением на рак молочной железы (РМЖ) на дообследование были направлены 46 пациенток (65,7 %).
Всем обследуемым после постановки предварительного диагноза было выполнено объемное исследование молочных желез на аппарате Selenia Dimensions (Hologic, USA) с применением метода цифрового томосинтеза.
Выявленные или подтвержденные методом цифрового томосинтеза непальпируемые узловые образования молочных желез были морфологически верифицированы. Для этого была выполнена прицельная биопсия патологических участков молочной железы под ультразвуковым или рентгеновским контролем (стереотаксическая или тонкоигольная аспирационная биопсии).
Результаты и их обсуждение. Данные обследования 70 пациенток, имеющих непальпируемые новообразования молочных желез, выявленные при ультразвуковом исследовании или стандартной маммографии, методом цифрового томосинтеза показали:
- узловая форма фиброзно-кистозной мастопатии отмечалась у 8 (11,4 %) пациенток;
- очаговый фиброз диагностирован в 11(15,8 %) наблюдениях;
- фиброаденома выявлена у 8 (11,4 %) обследуемых;
- киста молочной железы определялась в 5 (7,1 %) результатах исследования;
- рак молочной железы подтвержден у 23 (32,9 %) пациенток;
- отсутствие патологических изменений в молочных железах констатировано в 15 (21,4%) случаях.
Анализ полученных результатов показал, что за счет трехмерного изображения органа и отсутствия эффекта наложения структур цифровой томосинтез имеет ряд преимуществ:
- улучшение визуализации контуров непальпируемого узлового образования, что позволяет с большей точностью судить о характере и истинных размерах патологического очага;
- уменьшение количества ложноположительных результатов, отмечаемых при стандартной маммографии на 21,4 %;
- увеличение выявляемости непальпируемых образований у пациенток с диффузным фиброаденоматозом, в том числе и рака на 4,2 %;
- снижение числа подозрительных в отношении РМЖ непальпируемых узловых образований вдвое (50,0 %);
- выявление образований, не определяемых при стандартной маммографии вне зависимости от плотности молочной железы на 8,5 %.
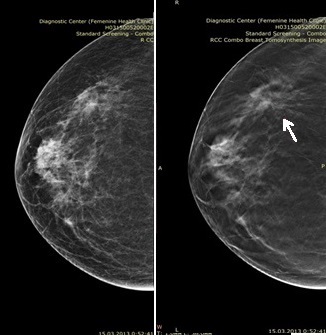
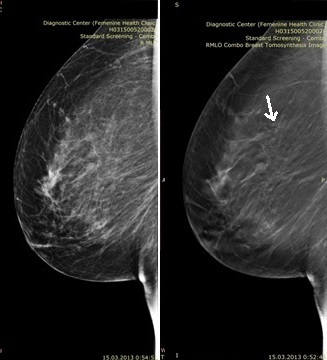
На представленных рисунках (рис.1 и рис.2) можно оценить преимущества цифрового томосинтеза над стандартной цифровой маммографией: на срезе томосинтеза отчетливо видно перестройку структуры ткани в верхне-наружном отделе молочной железы.
 |
 |
|
Рис. 1. Стандартная цифровая маммограмма (слева) в боковой проекции и томограмма (справа). |
Рис. 2. Стандартная цифровая маммограмма (слева) в боковой проекции и томограмма (справа). |
Выводы. Применение цифрового томосинтеза в значительной степени облегчает работу врача лучевой диагностики, снижает количество ложноположительных результатов, необоснованных инвазивных вмешательств и увеличивает количество правильно поставленных диагнозов.
