Актуальность проблемы внутрибольничной (госпитальной) инфекции (ВБИ) связана с постоянно возрастающим количеством заболеваний, вызванных внутрибольничными полирезистентными штаммами и высоким уровнем летальности [1]. Госпитальная инфекция мочевых путей (ИМП) занимает первое место среди всех видов ВБИ [2]. По данным Evan B. (2006) в 40% случаев в развитии ГИ вовлечен мочевой тракт. Это в свою очередь приводит к увеличивающимся экономическим потерям, связанным как с удлинением сроков лечения пациентов и продолжительности их пребывания в клинике, так и с использованием современных дорогостоящих антибактериальных препаратов (АП) для лечения ВБИ [4].
Для успешного проведения антибактериальной терапии (АТ) в урологической клинике необходим регулярный ММ, который заключается в определении этиологической структуры возбудителей ИМП и уровня резистентности наиболее значимых микробиологических культур к различным АП [5]. В связи с этим контроль за внутрибольничными штаммами в урологии и целенаправленное использование АП, с учетом антибиотикочувствительности ведущих патогенов, приобретает первостепенное значение.
Таким образом, учитывая распространенность и тяжесть данной патологии, целью настоящей работы явилось изучение роли условно патогенных и патогенных микроорганизмов в развитии ИМП у урологических больных, а также установление изменений и степени антибиотикорезистентности выделенных штаммов.
Материал и методы. Проведен ММ микрофлоры мочи у больных с наиболее часто встречающимися ургентными урологическими заболеваниями (мочекаменной болезнью, аденомой предстательной железы и пиелонефритом), которые находились на обследовании и лечении в отделении урологии Республиканского научного центра экстренной медицинской помощи Республики Узбекистан с мая 2001 по декабрь 2009 г.
На исследование от больных с вышеуказанными заболеваниями брали мочу (445 проб). Забор и транспортировку материала осуществляли по общепринятым схемам.
Выделение микроорганизмов проводили с использованием общепринятых питательных сред. Посев мочи производился по методу Голда калиброванной петлей на плотные питательные среды: Эндо, ЖСА, кровяной агар, среда Сабуро. Этиологически значимым считались микроорганизмы, обнаруживаемые в концентрации 104 микробных тел в 1 мл и выше. Идентификация выделенных микроорганизмов производилась общепринятыми методами на основании культуральных, морфологических, тинкториальных и биохимических свойств. Количество выросших микроорганизмов выражали в lg KOЕ/ml.
Диско-диффузионным методом определяли чувствительность выделенных микроорганизмов к антибиотикам (пенициллины, цефалоспорины 1,2,3 поколений, аминогликозиды, макролиды и фторхинолоны).
Полученные данные обрабатывались с помощью компьютерной программы Microsoft Excel 2003 и оценивались с использованием критериев NCCLS. В качестве контроля использовали международные штаммы Staphylococcus aureus ATCC 29213; Escherichia coli ATCC 25922 и Pseudomonas aeruginosa ATCC 27853.
Результаты. За этот период произведено бактериологическое исследование мочи у 445 больных. Из них у 42 (9,4%) больных посев мочи оказался стерильным. У 403 больных выделено и проанализировано 544 культур грамположительных и грамотрицательных микроорганизмов, из них 383 (70,4%) штаммов относились к грамотрицательным бактериям (ГОБ), 143 (26,3%) штаммов - грамположительным бактериям (ГПБ), 18 (3,3%) штаммов явились грибами рода Candida (рис. 1). Из них монокультур выделено в 284 случаях, ассоциации из 2-х видов микроорганизмов в 97, из 3-х видов - в 22 случаях.
Как видно из рисунка среди изолятов мочи урологических больных преобладали штаммы ГОБ, которые представлены 17 видами микроорганизмов, среди них наиболее часто встречались: Pseudomonas aeroginosa – 21,5%, Klebsiella pneumoniae – 18,6%, Escherichia coli – 12,5%, Staphylococcus epidemidis – 12,3%.
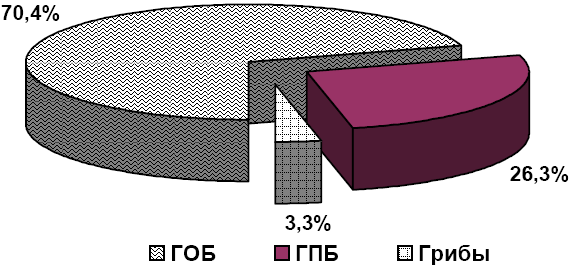
Рис. 1. Соотношение различных штаммов микроорганизмов.
На долю этих четырех видов пришлось 64,9% всей микрофлоры, менее чаще встречались Proteus mirabilis – 5,1%, НФГОБ -5,3%, Enterobacter aerogenes – 4,4%. Средний видовой состав микрофлоры мочи у урологических больных за обследованный период времени представлен в табл. 1.
Таблица 1. Микроорганизмы, выделенные из мочи больных с ИМП
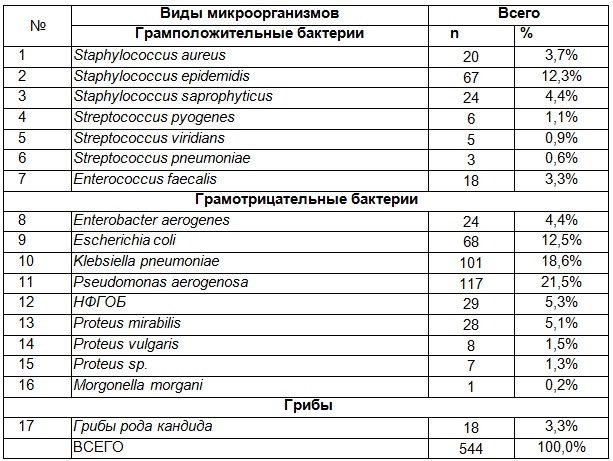
Сравнительный анализ динамики изменений микрофлоры мочи по годам выявил значительное снижение частоты ГПБ по сравнение ГОБ (рис. 2). Высеваемость Pseudomonas aeroginosa имеет волнообразный характер, и пик ее развития отмечен в 2008 г. - 32,7%. Staphylococcus epidemidis - встречалась чаще в первые 3 года (от 11,1 до 21,9%), в последующие 3 года частота ее резко снизилась (2,1-5,5%). Proteus mirabilis – имеет неуклонную тенденцию к снижению и последние три года не встречалась вообще. Klebsiella pneumoniae, наоборот, имеет неуклонную тенденцию к росту: от 6,5% в 2001 г. - до 34,6% в 2006 г. Исключение составил 2004 г. – 11,4%. Escherichia coli наиболее часто встречалась в первый год работы отделения - 18%, в последующие годы встречалась с частотой от 4,1% до 17,3% .
Рис.2. Динамика изменений микрофлоры мочи по годам.
Как было указано выше, ведущими патогенами ИМП являются представители ГОБ. Особо следует отметить тот факт, что большинство из них обладали множественной устойчивостью к применяемым антибактериальным препаратам. Это актуально в связи с тем, что наиболее чаще выделяемый патоген Ps.aeruginosa очень часто обладал полирезистентностью и вызывал серьезные затруднения при лечении инфекций, вызванных ею. В связи с этим следующим шагом нашей работы было определение чувствительности некоторых выделенных штаммов к АП (Табл. 2-3).
Таблица 2. Активность антибиотиков в отношении грамотрицательной госпитальной микрофлоры (n/% - от количества выделенных штаммов)
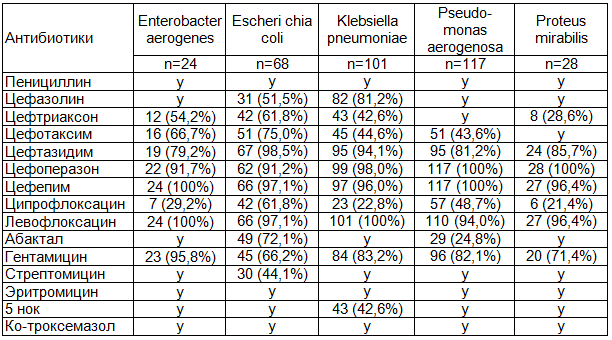
Таблица 3. Активность антибиотиков в отношении грамположительной госпитальной микрофлоры (n/% - от количества выделенных штаммов)
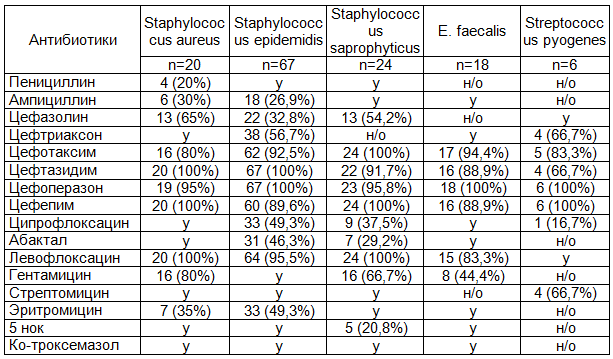
Примечание: n - число штаммов; н/о- чувствительность не определяли; у – устойчивы.
Полученные результаты уровня устойчивости к антибиотикам ведущих представителей грамотрицательной и грамположительной микрофлоры в ИМП показали следующее:
- чувствительность штаммов P. aeruginosa к антисинегнойным цефалоспоринам III и IV поколения оказалась высокой и составила 81,2% - 100% (цефтазидим, цефоперазон, цефепим), а фторхинолинам III поколения (левофлоксацин) - до 94%.
- К другим антибиотикам с антисинегнойным действием: цефалоспорины (цефтреаксон, цефотаксим), аминогликозиды (гетамицин), фторхинолоны (ципрофлоксацин, абактал) уровень устойчивых штаммов в популяции P.aeruginosa составлял от 17,9% до 75,4%.
- Среди штаммов Klebsiella spp., Proteus sp. и E. coli отсутствовали штаммы, резистентные к цефепиму, цефоперазону и левофлоксацину. К фторхинолонам и аминогликозидам уровень чувствительности этих штаммов снизился и составлял 21,4% - 83,2%.
- В популяциях грамположительных бактерий - S. aureus, S. epidermiditis и E. faecalis отсутствовали штаммы, резистентные к цефалоспоринам III и IV поколения.
- К другим антибиотикам: пенициллинам, макролидам, аминогликозидам, комбинированным препаратам (ко-тримоксазол) были устойчивы практически все микроорганизмы.
- К широко применяемому в урологической практике препарату 5-НОК оказались чувствительны лишь от 20,8 до 42,6% штаммов Staphylococcus epidemidis и Klebsiella pneumoniae.
- Все штаммы грибов рода Candida были чувствительны к флуканазолу.
Как видно из табл. 2, наиболее активным антибиотиком против P.aeruginosa и других грамотрицательных микроорганизмов является цефипим, цефоперазон, и цефтазидим относящийся к группе цефалоспоринов III и IV поколения: более 90% всех выделенных штаммов были чувствительны к этим антибиотикам. На втором месте по активности следует препарат "левофлоксацин", который превосходил по активности такой противосинегнойный препарат, как цефтазидим, цефоперазон и цефепим. К левофлоксацину были чувствительны 94% выделенных штаммов P.aeruginosa, в то время как к цефтазидиму были чувствительны 81,2% штаммов этого микроорганизма.
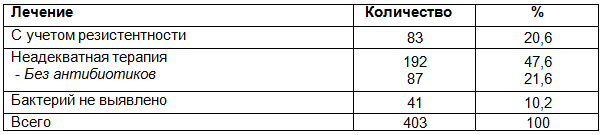
Также, проведен ретроспективный анализ адекватности проведенной антибиотикотерапии у анализируемой группы больных. При этом установлено, что адекватная антиобиотикотерапия была проведена лишь у 83 (20,6%) больных, у 192 (47,6%) больных выявленная микрофлора была устойчива к назначенным антибиотикам, а 87 (21,6%) больным антибиотикотерапия не проводилась вообще (табл. 4.).
Таблица 4. Адекватности проведенной антибиотикотерапии у больных с ИМП
Обсуждение. Из данных литературы 70-80 годов известно, что ведущими патогенами ИМП у урологических больных являлись ГОБ, среди которых преобладали кишечная палочка, клебсиеллы, энтеробактеры, псевдомонады [6]. В конце столетия причиной более 65% ИМП в урологии служили ГПБ: стафилококки, стрептококки, энтерококки. В настоящее время отмечается тенденция к возврату ГОБ на лидирующие позиции. Происходит это в основном за счет синегнойной палочки и других ГОБ [7].
За последние 30 лет значительные изменения претерпели подходы к лечению урологических больных с ИМП. Это выразилось в более раннем использовании в эмпирической АТ препаратов широкого спектра действия: цефалоспоринов III поколения, фторхинолонов, защищенных пенициллинов и других антибиотиков, что позволило снизить осложнения и летальность среди больных ИМП. С другой стороны, широкое и, как правило, бесконтрольное применение цефалоспоринов III поколения привело к появлению множественно устойчивых ГИ [8]. Развитие устойчивости связано с продукцией бактериями плазмидных β-лактамаз расширенного спектра (БЛРС), а также гиперпродукцией хромосомных β -лактамаз класса С, способных инактивировать цефалоспорины III поколения. На фоне лечения цефалоспоринами III поколения, при элиминации чувствительных к ним бактерий, происходит не только селекция полирезистентных ГИ на слизистых оболочках мочевыводящих путей, но и их вовлечение в инфекционный процесс, как локальный, так и генерализованный. В этом случае традиционные схемы АТ на основе цефалоспоринов III поколения даже в комбинациях с аминогликозидами или фторхинолонами оказываются клинически неэффективными [9]. В последнее время типичным стало острое течение ГИ у больных ИМП, когда клиническая ситуация определяет необходимость принять немедленное решение по назначению адекватной АТ. В этом случае выбор антибиотика первого ряда, как правило, осуществляется эмпирически [10]. В связи с тем, что идентификация патогена требует времени, целенаправленная АТ назначается отсрочено. При этом показания для эмпирического назначения антибиотиков и их выбор далеко не всегда оказываются достаточно обоснованными. Следовательно, несмотря на знание современных тенденций распространения резистентности к АП среди больных ИМП, проблема разработки рациональных алгоритмов лечения для каждого конкретного больного остается достаточно актуальной при отсутствии в нем локального ММ [11].
Полученные нами результаты подтверждают данные литературы о возрастающей роли P.aeruginosa и условно-патогенных энтеробактерий - Klebsiella pneumoniae в возникновении ИМП. Устойчивые к 5 и более антибиотикам, используемые для лечения ИМП, они чаще встречались среди клинических изолятов, выделенных от урологических больных.
А также проведенный нами мониторинг микрофлоры мочи у больных с ИМП еще раз подтверждает необходимость проведения локального мониторинга за возбудителями инфекции, так как ретроспективной анализ лечения больных показал неадекватность терапии у 70,4% больных. Ошибочно суждение об исключительности положительного эффекта при лечении урологических больных препаратом 5-НОК.
Полученные нами данные микробиологического мониторинга свидетельствуют о том, что сегодня нельзя слепо руководствоваться материалами, полученными в других даже однопрофильных клиниках, что в итоге приводит к неадекватности АТ. Необходимо проводить собственный мониторинг за госпитальными инфекциями, опираясь на результаты которого, врачи–клиницисты могут научно обосновать, разработать и использовать алгоритмы АТ урологических больных с ИМП.
Таким образом, на основании проведенных исследований можно сделать следующие выводы:
- В связи с повышением резистентности к АП основных возбудителей ГИ в урологии, необходимо проведение регулярного ММ мочи, а также изменять политику применения АП.
- Эмперическая АТ должно строиться на основе ММ за структурой микроорганизмов и антибиотикорезистентностью с учетом наличия факторов риска ИМП и сроков их развития, а также с обязательной коррекцией АТ по результатам бактериологического обследования мочи.
- Необходимо исключение из формуляра больных с ИМП - 5 НОК, пенициллина, ампициллина, стрептомицина и Ко-троксемазола, и при необходимости эмперически в АТ использовать цефалоспорины III – IV поколения, а также фторхинолины III поколения, учитывая высокую их активность против большинства выделенных уропатогенов.
