Введение. В последние годы наиболее актуальными проблемами здравоохранения во всем мире являются качество, эффективность и безопасность лекарственных средств (ЛС), что обусловлено присутствием на фармацевтическом рынке огромного количества торговых наименований препаратов и ростом числа воспроизведенных ЛС (генериков), проникновением в сферу гражданского оборота фальсифицированных лекарств. Качество препарата рассматривается как возможность его применения в клинической практике согласно установленным показаниям с достаточным уровнем его эффективности и безопасности. Контроль качества ЛС осуществляется на всем протяжении их жизненного цикла - как в периоды разработки, доклинических и клинических исследований, государственной регистрации, так и во время обращения на фармацевтическом рынке [1].
Доказательная база по эффективности и безопасности ЛС формируется в ходе клинических исследований (КИ), от качества проведения которых зависит валидность полученных результатов, что в свою очередь, в глобальном смысле, влияет на здоровье, благополучие и жизнь пациентов [2,3].
Оригинальные ЛС проходят все фазы КИ, прежде чем выйдут на фармацевический рынок. Применительно к генерикам, можно говорить о доклинических испытаниях, исследованиях биоэквивалентности и клинических исследованиях IV фазы.
Доклинические исследования проводятся в процессе разработки препарата и являются отправной точкой на пути формирования доказательной базы его эффективности и безопасности.
Согласно современным представлениям, соответствие воспроизведенного и оригинального препаратов основывается на фармацевтической, фармакокинетической (биоэквивалентности) и терапевтической эквивалентности.
Фармацевтически эквивалентные ЛС содержат одинаковые активные ингредиенты в одинаковой лекарственной форме, предназначены для одного способа введения и идентичны по силе действия или концентрации активных веществ.
Для оценки биоэквивалентности оригинального и генерического препаратов сопоставляются особенности их всасывания и распределения в организме человека. Биоэквивалентность ЛС считается основным критерием контроля качества генериков в странах Евросоюза (ЕС), США и России [4-6].
Основной целью клинических исследований IV фазы является получение более подробных данных о безопасности и эффективности различных дозировок и лекарственных форм (ЛФ) препаратов у пациентов при длительном применении, сопутствующей патологии и других особенностях течения заболевания.
По данным экспертов, ежегодно в мире проводится около 15 - 20 тыс. клинических исследований с участием миллионов пациентов и тысяч врачей-исследователей. Согласно данным Росздравнадзора, в России, начиная с 2004 г. по 2009 г., в КИ принимало участие более 329 тыс. пациентов, из них около 250 тыс. - в международных КИ инновационных препаратов [7].
Проведенный нами анализ литературы по данной проблеме показал, что в нашей стране крайне скудна обобщенная информация о российских КИ, особенно исследованиях, проводимых отечественными производителями.
Так в 2008 г. Обществом клинических исследований впервые был опубликован «Реестр Российских клинических исследований» (под ред. Член-корр. РАМН, проф. Белоусова Ю.Б.) [8]. В издании представлена информация по 79 КИ, среди которых только 4 были организованы отечественным фармацевтическим предприятием ОАО «Отечественные лекарства» (ныне ОАО «Валента Фармацевтика»).
Еще одним изданием, содержащим сведения о проводимых в России КИ, является созданный под эгидой Всероссийского научного общества кардиологов и Национального Фонда поддержки кардиологии КАРДИОФОРУМ Справочник «Российские клинические и эпидемиологические исследования в кардиологии» (проф. Шальнова С.А., проф. Марцевич С.Ю. и др.) [9]. Из 94 исследований, представленных в данном Справочнике, только в 2-х изучались ЛС отечественного производства.
В настоящее время остается дискутабельным вопрос о необходимости проведения национальных КИ ввиду того, что инновационных ЛС отечественного производства разрабатывается сейчас крайне мало. Вместе с тем, необходимы исследования по изучению терапевтической эффективности и безопасности воспроизведенных ЛС, особенно их терапевтической эквивалентности, фармакоэпидемиологические, а также исследования по изучению параметров, не затронутых в международных рандомизированных КИ.
Со стороны практикующих врачей отмечается повышенное внимание к наличию результатов собственных исследований компании/производителя по тому или иному препарату, ввиду того, что даже изученный в небольших по объему исследованиях препарат вызывает большее доверие, нежели просто факт его присутствия на фармацевтическом рынке.
В последние годы отмечается тенденция активного сотрудничества отечественных и зарубежных производителей, организуются совместные циклы производства, на территории России строятся производственные площадки, а термин «отечественный» производитель в этом случае звучит как «локальный», поэтому применительно к нашему исследованию речь будет идти о локальном фармацевтическом предприятии [10].
Исходя из вышеизложенного, целью нашего исследования явилось изучение оценки эффективности и безопасности воспроизведенных ЛС отечественного/локального производства в период их обращения на фармацевтическом рынке Российской Федерации.
Материалы и методы. Для решения поставленной цели нами был проведен ретроспективный анализ отчетов и статей, опубликованных в открытой печати, по результатам завершенных исследований ЛС, выпускаемых отечественным предприятием ОАО «Химико-фармацевтический комбинат АКРИХИН» и его стратегических партнеров. Архивная база данных содержала сведения о 197 исследованиях (доклинических, биоэквивалентности, постмаркетинговых клинических, фармакоэпидемиологических), проведенных в период с 1997 по 2013 гг включительно.
В данных исследованиях оценивалась эффективность и безопасность 45 торговых наименований ЛС (без учета лекарственных форм и дозировок), биологически активных добавок к пище (БАД) и средств лечебной косметической линии, которые были распределены в основные клинико-терапевтические группы (КТГ): кардиология, эндокринология, неврология, гинекология, дерматология/аллергология, педиатрия, туберкулез.
Анализ проводился по следующим параметрам: торговое наименование (ТН) ЛС; клинико-терапевтическая группа; производитель; название исследования; данные исследовательского центра (наименование учреждения, ФИО главного исследователя); год завершения; дизайн; количество пациентов, включенных в исследование; количество пациентов, завершивших исследование; демографические данные пациентов (пол, возраст); группы наблюдения (количество пациентов в группах, вид терапии); продолжительность наблюдения пациентов в исследовании; особенности исследуемой популяции; количество и характеристика зарегистрированных в исследованиях неблагоприятных побочных реакций (НПР) (в основной и контрольной группах); мероприятия по купированию НПР; количество пациентов, выбывших из исследования в результате НПР.
Полученные результаты. В настоящее время в портфеле ОАО «АКРИХИН», согласно перечню препаратов, опубликованном на сайте компании (www.akrikhin.r [11], присутствует 143 ТН ЛС (с учетом всех лекарственных форм и дозировок), БАД к пище и средств косметического ухода за кожей. В период с 1997 по 2012 гг. в активной промоции находилось чуть больше половины портфеля препаратов компании (54,1%), в 2013 г. на продвижении, с точки зрения маркетинговой политики, было оставлено менее половины продуктов (40,4%). В различных видах исследований эффективность и безопасность изучалась у 68 (46,6%) ТН в различных ЛФ и дозировках (рис. 1).
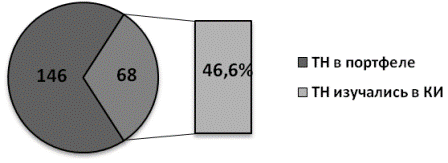
Рис. 1. Доля ТН препаратов из портфеля отечественного производителя, изучавшихся в клинических исследованиях.
Применительно к клинико-терапевтическим группам, из имеющихся в портфеле торговых наименований ЛС, изучались в постмаркетинговых исследованиях (ПмИс) более половины: кардиологические препараты - 52,6%, эндокринологические - 58,3%, неврологические - 50,0%, гинекологические - 61,5% и дерматологические - 75,8%, педиатрические - 50,0% и противотуберкулезные - 60,0% (рис. 2).
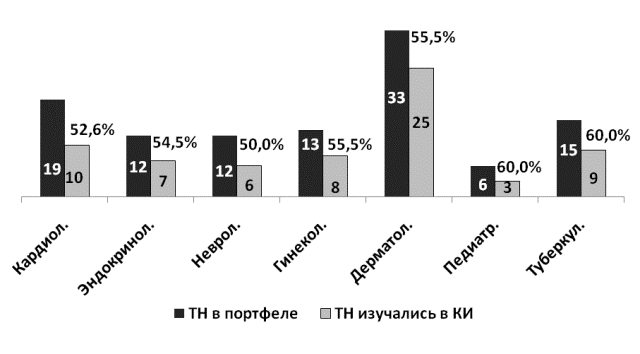
Рис. 2. Соотношение имеющихся в портфеле ТН и изучавшихся в КИ по клинико-терапевтическим группам (абс. числа, %).
Среди анализируемых отчетов на долю доклинических исследований приходилось 5,6% (11); исследований биоэквивалентности - 5,1% (10); постмаркетинговых КИ - 86,8% (171), фармакоэпидемиологических исследований (ФЭ) - 2,5% (5 ).
По дизайну среди всех постмаркетинговых исследований (n=176) большую часть составляли несравнительные, открытые, проспективные КИ - 111 (63,1%); контролируемых, рандомизированных КИ было проведено 60 (34,1%); ФЭ - 5 (2,8%). Из их общего числа на долю многоцентровых КИ приходилось 9,1% (16 КИ); изучение терапевтической эквивалентности - 1,1% (2 КИ); слепых -1,7 % (3 КИ); перекрестных - 1,7 % (3 КИ), плацебо-контролируемых - 0,6% (1 КИ) (рис. 3).
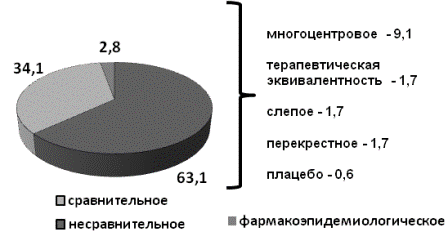
Рис. 3. Распределение постмаркетинговых исследований ЛС по дизайну, n = 176 (доля, %).
Согласно нашим данным, наиболее часто изучалась в ПмИс эффективность и безопасность препаратов, применяемых в кардиологии - 31,3%, дерматологии/аллергологии - 25,0%, гинекологии - 15,9%; значительно реже - применяемых в эндокринологии - 9,1%, педиатрии - 7,4%; неврологии - 5,7%, для лечения туберкулеза - 5,7%.
Среди анализируемых исследований, наиболее часто несравнительные по дизайну исследования проводились при изучении препаратов, применяемых в дерматологии/аллергологии - 33,3%, кардиологии - 27,9% и гинекологии - 19,8%; значительно реже в педиатрии - 8,1%, эндокринологии - 6,3%, неврологии - 4,5%.
Сравнительные по дизайну исследования преобладали в кардиологии - 35,0%, реже в эндокринологии - 15,0%, для лечения туберкулеза - 15,0%, дерматологии/аллергологии - 11,7%, гинекологии - 10,0%, неврологии - 8,3%, педиатрии - 5,0%.
Фармакоэпидемиологических исследований было только 3 в группе «Кардиология» и по 1 - в группах «Педиатрия» и «Туберкулез».
В течение анализируемого нами промежутка времени было выполнено 153 (77,7%) исследования по изучению эффективности и безопасности ЛС отечественного производства и 44 (22,3%) - зарубежного, при этом на долю ТН отечественных ЛС приходилось 59,3%, зарубежного - 36,8% (рис. 4).
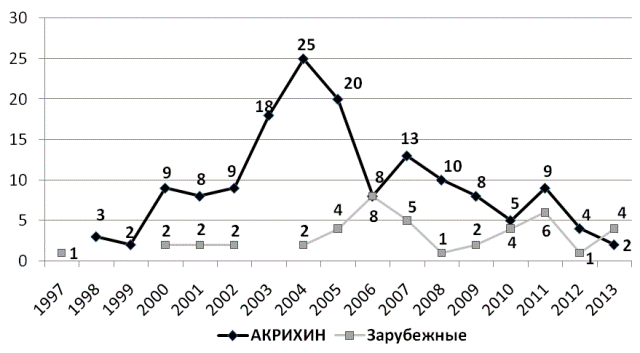
Рис. 4. Годовая динамика количества проводимых исследований ЛС отечественного и зарубежного производства (n = 197).
Согласно задачам нашего исследования, дальнейшему детальному анализу подвергались только отчеты и публикации по результатам завершенных постмаркетинговых КИ (n=169), в данный раздел не были включены проекты 2013 г. ввиду их незавершенности.
В 169 постмаркетинговых КИ было включено 20 859 пациентов, в том числе 935 детей и 311 беременных женщин, при этом число пациентов групп исследуемых препаратов (ГрИП) составило 18 991, терапию в группах сравнения (ГрСр) получали 1 868 пациентов, такое несоответствие численности групп обусловлено большим числом несравнительных по дизайну КИ. Из общего числа популяции пациентов на долю женщин приходилось 60,0% (12 514 чел.), мужчин - 40,0% (8 345).
В табл.е 1 и 2 представлены данные о возрастном составе пациентов и продолжительности их наблюдения в анализируемых нами исследованиях.
Таблица 1. Данные о возрастном составе пациентов, участвующих в КИ, в соответствии с клинико-терапевтической группой
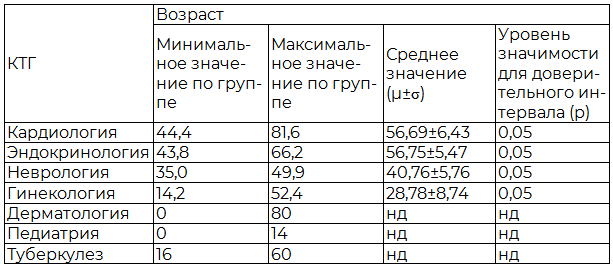
Примечание: нд - нет данных, в анализируемых отчетах не был указан средний возраст пациентов.
Таблица 2. Данные о продолжительности наблюдения пациентов в КИ, в соответствии с клинико-терапевтической группой
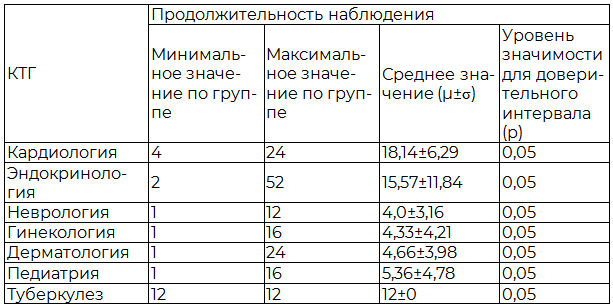
Среди всех проведенных КИ по КТГ «Кардиология» наиболее часто изучалась эффективность и безопасность терапии у пациентов с артериальной гипертензией (АГ) - 49,1%, хронической сердечной недостаточностью (ХСН) - 37,7%, ишемической болезнью сердца (ИБС) - 19,0%. В эндокринологии 81,2% КИ проводилось у больных сахарным диабетом (СД) 2 типа; в неврологии 50,0% исследований - при мышечно-болевом синдроме (МБС); в гинекологии - 64% КИ проведено у пациенток с бактериальным вагинозом (БВ); в дерматологии - 34,8% КИ посвящены атопическому дерматиту (АД), 26,1% - аллергодерматозам, 13,0% - микозам кожи; в педиатрии проведено 58,3% исследований у пациентов рахитом, 16,7% - у детей с нарушениями микрофлоры толстого кишечника.
В задачи нашего исследования входил анализ оценки безопасности препаратов в ходе постмаркетинговых КИ. Нами было установлено, что в 53-х КИ, проведенных в группе «Кардиология» были зарегистрированы НПР у 115 пациентов (62,6% из основной группы и 37,4% в группе сравнения).
В 16 КИ направления «Эндокринология» у 7 пациентов были зарегистрированы НПР, что составило 1,5% от числа больных, участвовавших в них. Одному пациенту препарат был отменен, всем остальным коррекция не потребовалась.
В группе «Неврология» из 10 проведенных КИ у 3 509 пациентов были выявлены НПР, что составило 78,9%, выбыло в результате НПР только 29 пациентов (0,8%). При этом в группах исследуемого препарата НПР были зарегистрированы у 99,7%, что объяснимо проведением большинства несравнительных КИ. У этих пациентов в 99,0% случаев НПР не требовали коррекции.
В группе «Гинекология» из 25 КИ, НПР были зарегистрированы только у 145 пациенток, что составило 4,0% от общего числа наблюдавшихся в них женщин, при этом 89,0% приходилось на пациенток групп исследуемых препаратов и не требовало коррекции.
В группе «Дерматология/Аллергология» НПР в ходе 44 КИ были зарегистрированы у 88 пациентов (7,3% - основная, остальные в группах сравнения), при этом в 76,1% случаев коррекция НПР не потребовалась, выбыл из исследований только 1 пациент.
В группе «Педиатрия» в 12 КИ с участием 513 детей НПР была выявлена только у 1 ребенка, которому препарат был отменен.
В группе «Туберкулез» в 9 КИ с участием 626 пациентов НПР были зарегистрированы у 51,4% больных из групп исследуемых препаратов и у 48,6% из групп сравнения.
На рис. 5 представлено соотношение числа пациентов, у которых были зарегистрированы НПР к общему числу пациентов по группам наблюдения.
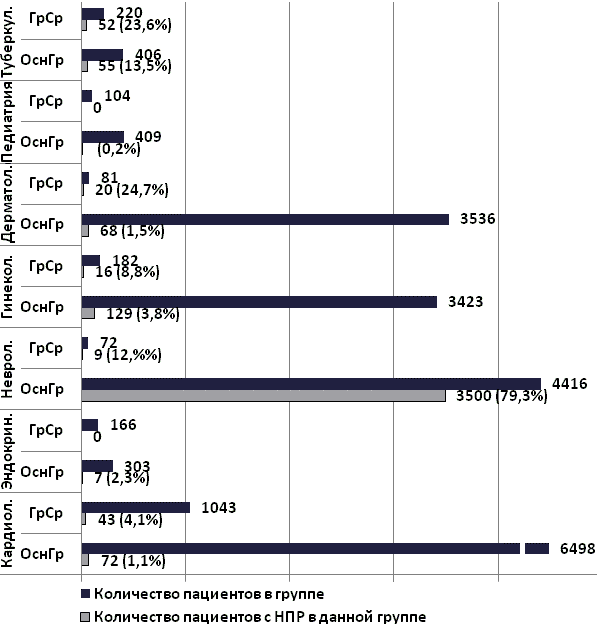
Рис. 5. Соотношение числа пациентов с зарегистрированными НПР к общему числу пациентов в группах наблюдения (абсол.чис., %).
Среди 20859 пациентов, принимавших участие в анализируемых исследованиях, 4036 НПР были зарегистрированы у 3972 чел. (19,0% от общего числа больных, включенных во все КИ).
Наиболее часто реакции развивались со стороны центральной нервной системы (ЦНС) - 54,7%, желудочно-кишечного тракта (ЖКТ) - 17,6%, опорно-двигательного аппарата (ОДА) -16,7%, значительно реже со стороны сердечно-сосудистой системы (ССС) - 3,9%, кожи - 1,7%, мочевыводящей системы (МВС) - 0,8%, изменение лабораторных показателей было зарегистрировано в 0,3% случаев, на долю неклассифицируемых НПР приходилось 4,3%.
Применительно к группам исследуемых препаратов, НПР были зарегистрированы у 20,2% пациентов, в группах сравнительной терапии - у 7,5%. Однако эти данные нельзя трактовать в пользу терапии сравнения, ввиду большего числа несравнительных по дизайну КИ в основных группах.
Обсуждение полученных результатов. Данные, полученные в нашей работе, впервые позволили систематизировать сведения о проводимых в настоящее время отечественными фармпроизводителями исследованиях, их дизайне, масштабах, продолжительности, особенностях популяции пациентов, изучаемых препаратах, факторах, влияющих на планирование и проведение данных исследований.
Наши данные показали, что в случае стратегического партнерства портфель локального производителя в большей мере представлен ТН препаратов отечественного производства (72,0%), на долю препаратов зарубежных производителей приходится около трети (28,0%). Наряду с ЛС в различных лекарственных формах и дозировках в портфеле присутствуют БАД (4,2%), косметические средства по уходу за кожей (7,0%) и изделия медицинского назначения (0,7%).
В настоящее время отмечается тенденция к уменьшению числа ТН препаратов, находящихся в активной промоции, так число продвигаемых препаратов в 2013 г. сократилось в 1,3 раза по сравнению с 2012 г., что обусловлено маркетинговой политикой компании.
Обращает на себя внимание факт, что все ТН, которые изучались в исследованиях, находились в активной промоции, а результаты проводимых исследований были необходимы в качестве доказательной базы по их эффективности и безопасности в постмаркетинговый период. Эффективность и безопасность всей остальной продукции компании, обращающейся на фармацевтическом рынке, изучалась только в рамках установленных регламентами регуляторых процедур, связанных с процессами регистрации препаратов.
Таким образом, в противовес мнению некоторых авторов о том, что локальные исследования в России проводятся лишь с целью соблюдения регуляторных требований [1,12], наши данные убедительно свидетельствуют о стремлении отечественного/локального производителя иметь собственную доказательную базу по своим продуктам, тем более этого требует медицинское сообщество.
Относительно качества отчетов проводимых в России исследований, литературные данные согласуются с результатами нашего ретроспективного анализа. По данным ряда авторов (Шальнова С.А., Марцевич С.Ю.), среди проводимых российских исследований преобладают одномоментные наблюдательные, с небольшим числом участников, не продолжительные во времени, в результате которых сложно оценить влияние терапии на исходы заболеваний [13]. Наиболее часто в таких исследованиях анализируется влияние исследуемого препарата на суррогатные конечные точки с меньшей прогностической ценностью, вместе с тем они дают информацию об эффективности и приверженности пациентов к терапии, частоте использования препарата в широкой клинической практике.
Согласно информации, представленной в Справочнике клинических и эпидемиологических исследований в кардиологии, только 31% из них являются проспективными, 40% - рандомизированными, при этом зачастую отсутствует описание метода рандомизации пациентов, что может существенно влиять на достоверность полученных результатов. Кроме того, не все проводимые в нашей стране исследования отвечают требованиям Надлежащей клинической практики (Good Clinical Practice -GCP). Кроме уже названных проблемных аспектов необходимо выделить качество отчетов по результатам проведенных исследований, которые зачастую бывают неполными и неточными, что затрудняет оценку эффектов терапии [9].
Среди отчетов, отобранных в наш ретроспективный анализ, были такие, в которых отсутствовала или была некорректной информация о критериях включения/исключения пациентов; промежуточных и конечных точках; описание дизайна исследования; методов рандомизации; методов статистического анализа; сведения о распределении пациентов по полу и возрасту; данные о продолжительности активного лечения и наблюдения пациентов в исследовании; ошибки в расчетах, отсутствие указаний на достоверность полученных результатов.
Вместе с тем необходимо отметить, что за последние 5 лет значительно повысилось качество проводимых отечественным спонсором ПмИс как на этапе его подготовки, так и в период проведения: документация исследования готовится в соответствии с требованиями Надлежащей клинической практики (GCP); обязательной процедурой стало проведение исследований с одобрением локального этического комитета; соблюдаются процедуры открытия и закрытия исследовательских центров; проводятся стартовые, промежуточные и финальные совещания; процедура рандомизации проводится централизованно методом автоматизированной системы телефонной связи – интерактивная система голосового ответа (Interactive Voise Response System - IVRS); регулярно осуществляются визиты мониторинга; в многоцентровые КИ привлекаются централизованные лаборатории и современные транспортные компании.
Выводы
1. Количество проводимых клинических и эпидемиологических исследований воспроизведенных ЛС отечественного производства зависит от маркетинговой политики компании и повышается в период вывода новых промотируемых продуктов на фармацевтический рынок с целью формирования собственной доказательной базы по их эффективности, безопасности и переносимости.
2. Изучаемые в постмаркетинговых исследованиях препараты отечественного производства показали достаточно высокий уровень безопасности.
3. В последние 5 лет повысилось качество проведения исследований с соблюдением правил Надлежащей клинической практики.
4. Все большую значимость приобретают исследования по оценке терапевтической эквивалентности воспроизведенных ЛС как отечественного, так и зарубежного производства, фармакоэпидемиологические исследования. Отмечается тенденция к изучению в клинических исследованиях БАД к пище и средств косметического ухода за кожей, особенно у пациентов групп высокого риска (дети, беременные женщины, пожилые пациенты).
