Состояние, сопровождающееся низким уровнем витамина D в организме человека, на сегодняшний день является одной из актуальных проблем здравоохранения, вследствие взаимосвязи данного процесса с несколькими хроническими заболеваниями, такими, как сахарный диабет, болезни системы кровообращения (БСК), остеопороз, онкозаболевания и т.д. [1 – 3].
Открытие витамина D изначально принадлежит Эдварду Мелланби (Mellanby, 1919, 2009). Со времени его открытия множество научных исследований сделали очевидным тот факт, что витамин D играет важную роль не только в функции костной ткани, но также, значительно влияет на пролиферацию и дифференцировку различных клеток [3].
Нарушения содержания витамина D в человеческом организме приводит к ряду патологических изменений, так называемых D-зависимых состояний. к ним относятся – дефицит, недостаточность, гиповитаминоз, токсичность и их клинические проявления [4].
По данным многих эпидемиологических исследований подсчитано, что на текущий момент во всем мире около 1 миллиарда человек страдают от недостаточности или дефицита витамина D. А в некоторых тропических странах, таких как Китай, Турция, Индия, Иран и Саудовская Аравия частота дефицита витамина D достигает 93% [4 – 13].
Следует отметить, что столь большая значимость нарушений концентрации витамина D обусловлена наличием влияния (прямого и/или косвенного) одного из его активных метаболитов 1,25(ОН)2D3 на функционирование более чем 200 генов, включая процессы клеточной пролиферации и дифференцировки, а также, апоптоза и ангиогенеза. Взаимосвязь 1,25(ОН)2D3 осуществляется на уровне органов-мишеней, обладающих специфическими рецепторами витамина D (VDR). VDR относится к подсемейству тиреоидных гормонов (Т3), являющийся ядерным транскрипционным фактором. Рецепторы VDR широко представлены в различных тканях организма [4, 14, 15] (рис. 1)

Рис. 1. Основные ткани-мишени гена VDR (1,25- dihydroxyvitamin D3): чёрное – иммунная ткань, светлое – нервная ткань, сетло-серое – мышечная ткань, голубоватое – внутренние органы, средне-серое – секреторные органы, тёмно-серое – репродуктивные органы [16].
Столь массивное распространение VDR обуславливает важное значение в регулировании функции иммунной, нервной, сердечно-сосудистой, выделительной и репродуктивной систем, а также, как упоминалось ранее, в пролиферации и дифференцировке клеток [17–19]. Основная регуляторная роль состоит в уменьшении клеточной пролиферации как нормальных, так и раковых клеток, и в ускорении их конечной дифференцировки [4].
За последние десятилетия изучения VDR гена был выявлен достаточно многочисленный ряд его полиморфизмов. Однако, вопросы изучения влияния разных видов полиморфизма VDR на функцию и сигнальный путь, кодируемого им белка во многих аспектах остаются не до конца понятными. Среди наиболее изученных вариантов полиморфизма VDR следует выделить BsmI, ApaI, и TaqI, Cdx2, FokI определяемые с помощью рестрикционных фрагментов в конце 3V части гена. Объяснение наблюдаемых ассоциаций сводится и в том числе к тому, что, вероятно, эти полиморфизмы, могут быть и нефункциональным, но при этом сцепленными с одним или более истинными функциональными полиморфизмами в другом месте гена VDR.
Большинство исследований сосредоточено на изучении частоты данных видов полиморфизмов в различных расово-этнических группах и популяциях и их взаимосвязи с развитием таких заболеваний как синдром низкой минеральной плотности костной ткани (СНМПКТ), остеопороз, уролитиаз, гиперпаратиреоз, псориаз, туберкулез, хроническая почечная недостаточность, почечная остеодистрофия, онкологические заболевания (гепатоцеллюлярная карцинома, меланома, рак поджелудочной железы, мочевого пузыря и т.д.), болезни пародонта, а также различными БСК [20].
Существенный прогресс в мировом здравоохранении может быть, достигнут только при появлении четкого понимания влияния полиморфизма VDR в различных популяциях и как следствие своевременной оценке риска развития заболеваний и прогнозирования их ответа на терапию.
Целью нашей работы было проведение литературного обзора имеющихся в индексированных базах данных, а также в альтернативных источниках исследовательских статей, содержащих информацию о частоте полиморфизма гена рецептора витамина Д (VDR или 1,25- dihydroxyvitamin D3) в различных популяциях.
Материалы и методы. Для достижения поставленной цели нами был проведен анализ литературных данных, индексированных в таких базах, как MEDLINE, Embase, US National Library of Medicine's PubMed database, ISI Web of Knowledge, Google Scholar и e-library, за последние 30 лет (с 1983 по 2014 г.).
В поисковые запросы входили следующее ключевые слова и словосочетания: “ген рецептора витамина D”, “VDR”, “полиморфизм гена рецептора витамина D”, “Cdx2”, “FokI”, “BsmI”, “ApaI”, “TaqI”.
Результаты и обсуждение. Локализация VDR гена на физической карте хромосом находится в регионе 12q12-q14 (12q13.1). По данным ряда исследователей имеется представление о геномной организации VDR 12q13.1 локуса. Сам по себе VDR ген является достаточно большим, около 100 kb (рис. 2), имеет обширную промоутерную зону, способную генерировать несколько тканеспецифических транскриптов, локализующуюся ниже гена коллагена типа II альфа-1 (COL2A1) [20 – 23].
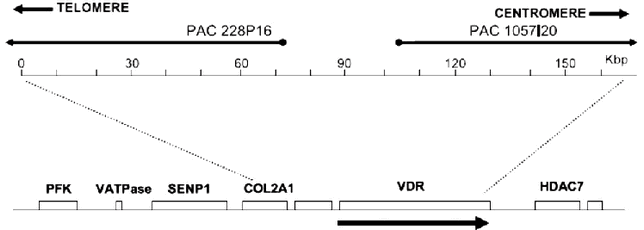
Рис. 2. Геномная структура VDR-COL2A1 в 12q13.1 локусе хромосомы на детализированной физической карте PAC клонов 228P16 и 1057I20. Стрелками указано направление транскрипции VDR гена. PFK - фосфофруктокиназа; V-АТФаза - вакуолярная АТФаза; SENP1 - сентрин/SUMO-специфичная протеаза; HDAC7= гистон-деацетилаза 7.
Информация о существующих вариантах полиморфизма VDR на текущей стадии изучении все еще остается лишь на ограниченных областях гена. В основном ее получение доступно благодаря экспериментальному скринингу с различными рестрикционными ферментами для полиморфных наборов методом Саузерн блоттинга (электрофорез в агарозном геле). Примерами этой информации являются зарегистрированные исследования по вариантам ApaI, EcoRV, BsmI, TaqI, Tru9I [20, 24 – 27]. На рис. 3 изображены основные известные в настоящее время полиморфизмы VDR гена.
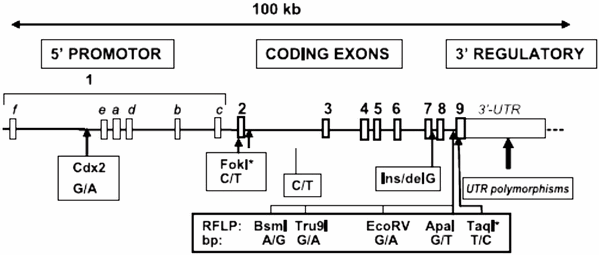
Рис. 3. Экзон–интрон структура VDR гена и позиций основных известных полиморфизмов.
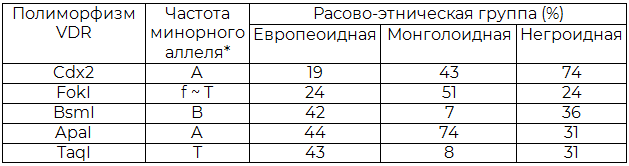
Масштабная работа по изучению суммарных данных о частоте основных полиморфизмов VDR гена была проведена A.Г. Уиттерлинденом и его соавторами в 2004 г. [20]. Ими были резюмированы данные по этническим вариациям VDR полиморфизма, представленные в табл. 1. Отраженная в работе информация дает возможность проведения дальнейшего анализа влияния первичных мутаций, преходящих со временем в истинный полиморфизм, с учетом средовых факторов и генетического фона на развитие определенных заболеваний в различных расово-этнических группах.
Таблица 1. Сравнение частоты аллелей VDR в трех основных расово-этнических для наиболее изученных полиморфизмов
В Сиднее, Австралия в 1994 г. было проведено исследование среди 311 здоровых и 207 находящихся в постменопаузальном периоде женщин. Моррисоном и соавторами были найдены ассоциации между BB VDR генотипом и СНМПКТ [26]. Тем не менее, в последующей работе Хастмайера и др. не было найдено какой-либо значительной взаимосвязи VDR полиморфизма и минеральной плотностью костной ткани позвоночника, бедренной кости, предплечья среди 86 монозиготных и 39 дизиготных пар близнецов [28].
Неженцев и др. изучали популяционные различия по однонуклеотидным полиморфизмам (SNPs) VDR гена [29]. После чего Фанг и др. в 2005 выявили вариации последовательности основной части VDR, включая конструкцию неравновесного сцепления локусов и идентификацию гаплотипов аллелей. После генетического анализа материалов от 6 148 пожилых пациентов европеоидной расы с 937 переломами, произошедшими за период 7,4 года они выявили 15 вариантов гаплотипов по однонуклеотидным полиморфизмам. Для 16% пациентов с генотипом-риска в обоих регионах, риск развития перелома повышался на 48%, вне зависимости от возраста, пола, роста, веса и минеральной плотности костной. Популяционный атрибутивный риск варьировал между 1% и 12% для каждого блока (комбинированный – 4%) для VDR генотипа-риска. В последствие этой группой ученых было выдвинуто предположение, что увеличение риска переломов наблюдается для гаплотипов риска вследствие изменения эффективности сигнализации витамина D [30].
Исследования, проведенные в Республике Казахстан по изучению частоты аллелей полиморфизмов гена рецептора витамина Д у казахстанских женщин репродуктивного возраста в ассоциации с развитием остеопении и остеопороза (Жакупова А.С. и др.), показали, что полиморфизм VDR TaqI наиболее часто встречался в гомозиготном состоянии (дикий тип), полиморфизм VDR ApaI наиболее часто в гетерозиготном состоянии и полиморфизм VDR BsmI встречался наиболее часто в гетерозиготном и мутантном гомозиготном состоянии среди целевой популяции. При этом исследователями не было найдено достоверных отличий между группами разных национальностей. Результаты денситометрии показали, что 50% исследуемых не имели признаков остеопении, 47% женщин было с остеопенией и 3% с остеопорозом [31].
Аналогичные исследования были проведены и в Республике Беларусь. В работах белорусских ученых по изучению полиморфизма VDR у женщин с постменопаузальным остеопорозом было определено, что частота встречаемости гомозиготного варианта АА по ApaI более чем в два раза выше у пациенток с остеопорозом, чем в группе пациенток с нормальными значениями минеральной плотности костной ткани [32].
Согласно множеству клинических исследований в области изучения частоты полиморфизма VDR и популяциях в контексте определения риска заболеваний, есть данные о наличии обратной связи между низким уровнем витамина D и активностью рениина плазмы, уровнем артериального давления (АД), атеросклерозом коронарных артерий и другими БСК [33–36]. Так, Е.В.Ших и Н.М.Милотовой была изучены различия в ассоциации Fok I полиморфизма гена VDR с в контексте регулирования активности ренин-ангиотензин-альдостероновой системы и состоянии фосфорно-кальциевого обмена при артериальной гипертонии (АГ). В ходе работы, было получено заключение, что Fok I полиморфизм гена VDR тесно взаимосвязан с изменением возраста возникновения АГ и с вариабельностью дневных значений систолического артериального давления [4].
Другая область исследований в контексте изучения частоты полиморфизма VDR и ассоциированных с ним патологических состояний представлена анализом спорадической манифестации гиперпаратиреоза Карлингом и др. (1997). В ходе исследований были выявлены противоречивые данные, и тем не менее в последствие авторы пришли к выводу, что более низкие уровни мРНК VDR, связанные с b, a, T и аллелями могут влиять на кальцитриол-опосредованный контроль функции паращитовидной железы, и тем самым вносить свой вклад в развитие спорадического первичного гиперпаратиреоза [37].
Интересные исследования по изучению генетических маркеров развития сахарного диабета второго типа в рамках исследования полиморфизма VDR как кандидат-гена восприимчивости к этому заболеванию были проведены в северо-индийской популяции Хемант Кумар Бид и др. Так, путем генетическогого анализа, было выяснено, что FFBbtt генотип повышает риск развития сахарного диабета второго типа [38].
Безусловно, одно из наиболее значимых направлений современного здравоохранение это изучение прогнозирования онкологических заболеваний. Согласно существующим биологическим и эпидемиологическим исследованиям уровень витамина D может оказывать влияние на развитие раковых процессов в организме человека. Несколько однонуклеотидных полиморфизмов гена рецептора витамина D были описаны в исследованиях по прогнозированию онко-рисков. Таким образом, было выявлено, что пациенты с гепатоцеллюлярной карциномой имеют большую частоту ApaI CC генотипа (P=0,027) и bAt [CCA]-гаплотипа (P=0,037) по сравнению со здоровыми людьми. При этом был сделан вывод, что ApaI полиморфизм VDR играет роль в развитии гепатоцеллюлярной карциномы у пациентов с хронической формой гепатита С [39].
Заключение. Вопрос ассоциации полиморфизма гена рецептора витамина D с различными заболеваниями хотя и изучен во многих аспектах, но все еще остается открытым к проведению дальнейших масштабных исследований. Получение четких знаний о молекулярных механизмах, клеточной специфичности действия витамина D и функциональных последствий полиморфизма гена VDR позволит в полной степени реализовать эффективное клиническое и эпидемиологическое значение в предотвращении многих социально-значимых хронических заболеваний, в том числе и онкологических.
