Почки вовлекаются в любой патологический процесс, посколько являются одним из главных органов, поддерживающих гомеостаз организма в любом возрасте. Клинические проявления многих заболеваний у детей в значительной мере зависят от степени зрелости органов мочеобразования и мочевыделения. Межорганные структурно-функциональные связи между почками и другими системами, такими как желудочно-кишечный тракт, дыхательные пути, кожа и др. в детстве выражены сильнее из-за ограниченных резервных возможностей, что проявляется особенно ярко в условиях патологии [3,6,13,17]. Сочетание патологии органов мочевой системы с аллергическими заболеваниями далеко не редкое явление. Это может быть состояние, связанное с генными мутациями; возможно воздействие единого этиологического фактора-бактериального или вирусного. Общий патогенетический механизм реализуется через иммунопатологические реакции в связи с гипоиммунным состоянием [7,11,15].
Атопический дерматит (АД) относится к числу хронических аллергических заболеваний кожи, характеризующийся упорным течением, часто торпидным к проведению традиционной терапии [10]. АД - это раннее проявление атопии у детей. АД возникает у 81% детей, если оба родители больны АД, у 59%-в случаях заболевания одного из родителей АД и респираторной аллергией другого и у 56%-если один из родителей болен АД [1,12,14]. За последние годы отмечается рост системных проявлений АД, то есть вовлечение в патологический процесс других органов и систем, которое связано с увеличением степени сенсибилизации и снижением иммунной сопротивляемости организма [1,3,9,11].
Несмотря на многочисленные исследования, посвященные самым различным вопросам атопического дерматита до сих пор не изучено функциональное состояние почек при АД и вопросы иммунокоррекции при лечении таких больных.
Целью настоящего исследования явилось изучение функционального состояния почек и особенностей иммунного статуса при атопическом дерматите у детей и обоснование иммунокоррекции при лечении таких больных.
Материалы и методы исследования. Под нашим наблюдением находились 30 детей в возрасте от 3-х до 6 лет, страдающих атопическим дерматитом. Из них: I-группа-АД, II-группа-АД+ хронический пиелонефрит (ХП). Контрольную группу составили 25 практически здоровых детей того же возраста. Клинический диагноз был поставлен на основании анамнеза, клинико-лабораторных, иммунологических показателей, функциональных методов исследования, маркеров АД и по индексу SCORAD [5].
Изучали состояние клеточного иммунитета, концентрацию иммуноглобулинов (Ig) и циркулирующих иммунных комплексов (ЦИК), а также продукцию ИЛ-2. Показатели клеточного иммунитета определяли по методу Гариба Ф.Ю. и соавт. [4]. Фагоцитарную активность нейтрофилов (ФАН) определяли с помощью теста нитросиним тетразолием с использованием частиц латекса, ЦИК по методу преципитации [2]. Продукция ИЛ-2 изучали по методу Ortaldo J. [16].
C целью иммунокоррекции в периоде обострения АД у больных в комплексную терапию включили полиоксидоний (НПО ПЕТРОВАКС Фарм, номер госрегистрации Б-250-95 №33801) парентерально, из расчета 0,15 мг/кг массы тела в сутки, в течение 5-10 дней [8]. После введения препарата каких-либо осложнений не наблюдалось. Эффективность терапии оценивали по клинико-иммунологическим показателям. Материалом для исследования служили венозная кровь, взятая в утреннее время натощак. Цифровые данные обработали методом вариационной статистики с вычислением достоверности численных различий.
Результаты и их обсуждение. По результатам проведенных исследований было выявлено, что из наблюдаемых больных по полу девочки составили-55,0%, мальчики-45,0%. По обязательным и дополнительным диагностическим критериям АД составили: наследственная предрасположенность к аллергии -84,0%, патологическое течение беременности и родов-76,0%, начало заболевания в раннем детском возрасте-56,1%, гиперемия кожи- 38,6%, зуд-68,0%, кожные высыпания на сгибательных поверхностях конечностей-72,0%, линия Денье-Моргана-14,0%, смешанный дермографизм-81,5%, наличие сопутствующих заболеваний: хронический тонзиллит - 42,0%, ДЖВП-26,5%, цистит- 12%, гельминтоз-32,0%, ВСД - 43,0%, которые согласуются с данными литературы.
При исследовании суточной мочи выявлено (табл.1), уменьшение суточного диуреза (P<0,001-0,01), повышение суточной лейкоцитурии и эритроцитурии (P<0,001). Отмечалось статистически достоверное повышение суточной протеинурии (P<0,001-0,01), который имел селективный характер. При сравнении результатов в обеих группах изменения были более выраженными у детей с АД+ХП (II-группа), чем у детей с АД (I-группа).
Таблица 1. Показатели функционального состояния почек у детей с АД (М±m)
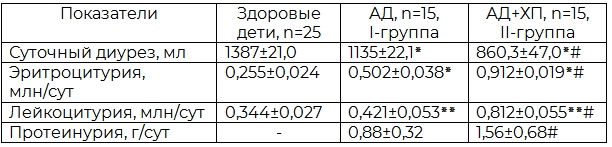
Примечания: Р<0,001٭; P<0,01٭٭; P<0,05٭٭٭; *-достоверность различий по сравнению со здоровой группой; #- достоверность различий между I и II группой.
Это объясняется тем, что по мнению исследователей [5,11], среди факторов, способствующих хроническому течению аллергического воспаления кожи у детей с АД, следует отметить частое возникновение инфекционных заболеваний, в том числе ХП, которые за счет воздействия бактериальных токсинов усугубляют действие триггеров и поддерживают хроническое течение АД.
Результаты наших иммунологических исследований показали (табл.2), что по сравнению с контрольной группой, у детей, страдающих АД (I-группа) и АД+ХП (II-группа) в период обострения (до лечения) отмечалось статистически достоверное снижение процентного содержания Т- лимфоцитов (СД3), Т-супрессоров (СД8), Т-хелперов (СД4), натуральных киллеров (LNK16) и ФАН (Р<0,001-0,01), достоверное увеличение числа В-лимфоцитов (СД19), повышение содержания в сыворотке IgE (Р<0,001) а также концентрации ЦИК (Р<0,001). Выявлено достоверное повышение продукции ИЛ-2 (Р<0,001). При сравнении результатов в обеих группах иммунопатологические сдвиги также были более выраженными у детей с АД+ХП (II-группа), чем у детей с АД (I-группа).
Выявленные иммунопатологические сдвиги объясняются тем, что в развитии АД ключевая роль принадлежит иммуноглобулин-Е опосредованным реакциям. И типы иммунного ответа связаны с одним из вариантов активации лимфоцитов с преимущественным участием клонов Th-лимфоцитов хелперов первого (Th1) или второго (Th2) типа, которые различаются по паттернам продуцируемых цитокинов (в том числе ИЛ-2) и роли стимулирования развития иммунного ответа по клеточному и гуморальному типу. Хроническая несбалансированность активации Т-хелперных клонов приводит к развитию иммунопатологических состояний, связанных с проявлениями аллергии [1, 9,16].
Кроме того, при АД отмечается повышенный синтез провоспалительной химазы клеток кожи, что сопровождается его гиперреактивностью. Именно гиперреактивность кожи становится тем фактором, который определяет реализацию атопического процесса. В поврежденных участках кожи доминируют активированные СД-4 клетки с фенотипом Th-2 лимфоцитов, способствующие выработке В-лимфоцитами повышенного количества IgE. Кроме того, при АД у детей в возрасте от 3-х до 6 лет отмечается расширение спектра причинно-значимых аллергенов и переход в поливалентную аллергию, такие как бактериальные, вирусные, грибковые, вакцинальные, лекарственные, которые характеризуются часто висцеральным проявлением.
Таблица 2. Динамика иммунологических показателей при АД у детей (М±m)
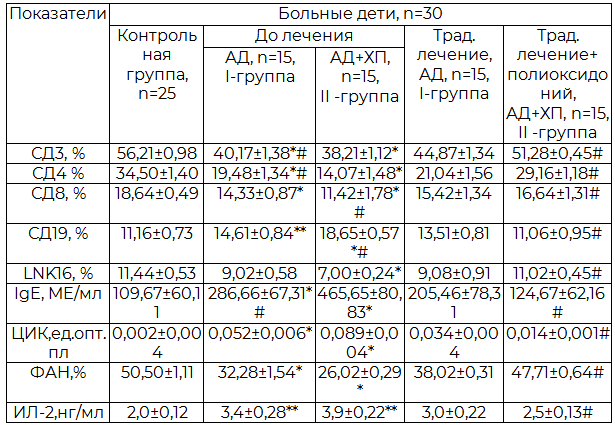
Примечание: *- достоверность различий по сравнению со здоровой группой; #- достоверность различий между I и II группой.
Обе группы получали традиционную комплексную терапию (базисные, антибиктериальные, антигистаминные препараты, гипосенсибилизирующая диета и др.) К комплексной терапии II-группы был добавлен препарат Полиоксидоний, I-группа получала только традиционную терапию.
После лечения в динамике (через 3-6 месяцев) у больных, получивших полиоксидоний (табл.2), отмечалась нормализация суточного диуреза (Р<0,001), снижение суточной эритроцитурии, лейкоцитурии и протеинурии (Р<0,01-0,05), улучшение иммунологических показателей, выражающихся в значительном увеличении относительного содержания СД3, СД4, СД8, ФАН (Р<0,001-0,05), достоверное снижение IgE, концентрации ЦИК (Р<0,001) а также снижение продукции ИЛ-2 по сравнению с группой, получавших традиционное лечение (Р<0,001-0,05).
Это связано с терапевтическим воздействием полиоксидония, которое является высокомолекулярным физиологически активным соединением с выраженной иммунотропной активностью. Полиоксидоний взаимодействует с поверхностной мембраной нейтрофилов, моноцитов и лимфоцитов. Под его влиянием происходит усиление продукции цитокинов, продуцируемых преимущественно клетками моноцитарно-макрофагальной системы при их исходно низких средних уровнях. При исходно повышенных уровнях цитокинов, в том числе ИЛ-2, препарат несколько снижает продукцию цитокинов. По механизму действия полиоксидоний является истинным иммуномодулятором, то есть он обладает более сложным и многогранным влиянием на иммунную систему. Полиоксидоний восстанавливает нарушенные функции иммунитета, не оказывая влияния на нормальные и первично действует преимушественно на клетки врожденного иммунитета такие как нейтрофилы, моноциты/макрофаги и естественные киллеры [8].
За 6 месяцев катамнестического наблюдения обострения АД+ХП была у 1 (6,0%) из 15 больных. Отмечалась нормализация показателей периферической крови (гемоглобин, лейкоциты, эозинофилы, СОЭ), раннее наступление и удлинение периода клинической ремиссии.
Выводы
1. У детей при АД изменения в анализах мочи характеризуются уменьшением суточного диуреза, повышением суточной лейкоцитурии, эритроцитурии и протеинурии, которые бывают более выраженными у детей с АД+ХП, чем у детей с АД и могут служить как критерий ранней диагностики поражения почек при АД у детей.
2. У детей при АД иммунопатологические сдвиги характеризуются дефицитом клеточного и гуморального звена иммунитета в виде снижения СД3, СД4, СД8, LNK16, ФАН, увеличением числа СД19, повышением в сыворотке крови IgE, концентрации ЦИК и гиперпродукцией ИЛ-2, которые бывают более выраженными у детей АД+ХП, чем у детей с АД и сохраняются в периоде ремиссии.
3. Высокая терапевтическая эффективность и отсутствие осложнений при лечение полиоксидонием позволяют рекомендовать его для широкого использования в комплексном лечении таких больных.
