Введение
Сохранение репродуктивного здоровья женщины является приоритетным направлением медицины и общества в целом [6]. Возрастающий интерес к развитию вспомогательных репродуктивных технологий (ВРТ) обусловлен важностью проблемы бесплодия в решении демографического вопроса в Российской Федерации.
Современные подходы к диагностике и лечению бесплодия основаны на достижениях фундаментальных наук в области изучения молекулярных процессов, лежащих в основе реализации процесса репродукции у человека [1,3]. Расшифровка механизмов гормональной регуляции репродуктивной системы обеспечивается с помощью молекулярно-биологических маркеров соответствующих процессов.
Особенностью патогенеза такой формы эндокринного бесплодия , как гиперандрогения (ГА) являются структурные изменения эндотелиальных клеток микроциркуляторного русла, вносящие свой вклад в нарушение роста и развития доминантного фолликула – симптомокомплекса, характерного для этого состояния [2, 12]. Согласно данным Тюренкова И.Н. с соавт. (2009), существует взаимосвязь возникновения и формирования эндотелиальной дисфункции при недостаточности половых гормонов [4]. В качестве одной из причин развития эндокринного бесплодия выявлены нарушения регуляции сосудистых процессов как на ранних стадиях фолликулогенеза, так и при селекции доминантного фолликула и созревании ооцита [7].
В литературе существуют данные о взаимосвязи состава фолликулярной жидкости, в которой развивается ооцит, и характеристик фолликулов, полученных в лечебных циклах ВРТ [3]. Однако мы не нашли сведений о том, в каких условиях происходит развитие ооцитов при таком распространенном состоянии, как гиперандрогения.
Целью работы послужило исследование содержания эндотелина-1, тестостерона и маркеров апоптоза sFasR/sFasL в образцах антральной жидкости фолликулов человека разной степени зрелости (III – VIII классы), полученных в лечебных циклах ВРТ.
Материал и методы
В работе проанализированы образцы фолликулярной жидкости (ФЖ) 110 полостных фолликулов на разных стадиях развития, полученных от пациенток, проходивших лечение в циклах экстракорпорального оплодотворения.
Выполнение работы одобрено локальным этическим комитетом Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого (выписка из протокола № 19 от 25.11.2009).
В исследовании соблюдались этические принципы, предъявляемые Хельсинкской Декларацией Всемирной медицинской ассоциации (World Medical Association Declaration of Helsinki 1964, 2000 ред.).
Образцы ФЖ получали от пациенток репродуктивного возраста с нарушениями менструальной и репродуктивной функции на фоне хронической ановуляции и гиперандрогении (ГА, n=65). Контрольную группу составили образцы ФЖ от женщин с регулярным двухфазным менструальным циклом и трубно-перитонеальной формой бесплодия (ТПФ, n=45).
Возраст женщин варьировал от 21 до 42 лет и в среднем составил 32,7±1,5 года. Период предшествующего бесплодия у обследованных супружеских пар составил 3–18 лет, в среднем 7,6±1,5 года.
Для установления причины бесплодия пациенткам проводили стандартное клинико-лабораторное обследование. Стимуляцию овуляции во всех лечебных циклах осуществляли с использованием препаратов агонистов гонадотропин рилизинг-гормона (а-ГнРГ) (декапептил-дейли) в сочетании с пурегоном. В качестве индуктора овуляции использовали овитрель.
Образцы ФЖ для исследования получали во время трансвагинальной пункции фолликулов разной степени зрелости (объем полученной ФЖ варьировал от 0,1 до 8 мл для диаметра фолликула от 0,2 – 0,9 мм до 16 – 20 мм, соответственно). Далее образцы помещали в стерильные пластиковые пробирки и использовали для анализа. Образцы анализировали по принципу: «одна пациентка – один доминантный фолликул» или «одна пациентка – 2-3 фолликула разной степени зрелости».
Стадию развития определяли в зависимости от диаметра фолликула. Таким образом, в исследование были включены фолликулы от ранних антральных до преовуляторных (III – VIII классы) [9].
Концентрацию эндотелина-1, тестостерона и маркеров апоптоза проводили при помощи иммуноферментного и иммунолюминесцентного анализа. Для определения концентрации эндотелина-1 использовали набор «Bl-20052 Endotelin», для определения тестостерона – «Immulite 1000 Total Testosterone», для определения sFasR – «BMS245 human sAPO-1/Fas Platinum ELISA», для определения sFasL – «BMS 260/2 human sFas-L ELISA».
Внутригрупповые показатели сравнивали со стадией раннего антрального фолликула. Показатели испытуемой группы сравнивали с показателем соответствующей стадии развития фолликула в контрольной группе.
Результаты эксперимента оценивали при помощи критерия Манна-Уитни для непараметрических показателей для двух независимых групп и критерия Вилкоксона для двух зависимых групп. Для оценки связи признаков применяли корреляционный анализ с расчетом корреляции по методу Спирмена. Результаты оценивали с учетом следующих величин r: |r|≤0,25 – корреляция слабой силы; 0.25≤|r|≤0,75 – корреляция умеренной силы; | r | ≥ 0,75 – тесная корреляция. Критический уровень значимости при проверке статистических гипотез в исследовании принимался равным 0,05.
Статистическая обработка результатов была проведена с помощью пакета прикладных программ STATISTICA v. 6.0 («StatSoft»).
Результаты и обсуждение
Первостепенное значение для нормального функционирования репродуктивной системы женского организма имеют половые гормоны стероидного происхождения. Этим гормонам отводится важная роль в регуляции репродуктивной функции женщины и поддержании способности к созреванию и овуляции доминантного фолликула [3].
Наиболее частой причиной ановуляторных состояний является избыточная продукция андрогенов. Известно, что гиперсекреция тестостерона в малых антральных фолликулах вызывает атрезию растущих фолликулов [11].
В работе оценивали содержание тестостерона в фолликулярной жидкости антральных фолликулов на разных стадиях развития.
На рис. 1 представлена динамика тестостерона в ФЖ антральных фолликулов при гиперандрогении и ТПФ.
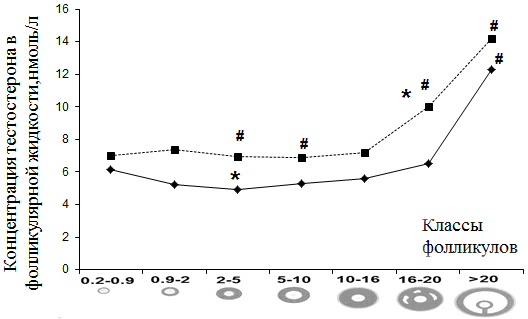
Рис. 1. Содержание тестостерона в фолликулярной жидкости антральных фолликулов при гиперандрогении и ТПФ; здесь и на рис. 2 - 4: --- гиперандрогения; — контроль; * - р<0,05 внутри группы; # - р<0,05 между аналогичными показателями контрольной группы и группы сравнения.
Уровни тестостерона в ФЖ пациенток с гиперандрогенией были значительно выше на всем протяжении процесса развития фолликулов, по сравнению с уровнями данного гормона в аналогичных стадиях контрольной группы пациенток.
Высокое содержание тестостерона в течение гормонально-зависимого этапа фолликулогенеза может свидетельствовать об андрогенном микроокружении в развивающихся фолликулах.
Формирование полноценного доминантного фолликула характеризуется определенной последовательностью морфологических изменений, обусловленной, в первую очередь, состоянием равновесия пролиферативных процессов и степенью выраженности апоптоза клеток кумулюса [13].
Известно, что подавляющее большинство фолликулов в яичнике подвергается атрезии посредством апоптоза [14]. Для фолликулов, находящихся в состоянии атрезии, характерно повышение в фолликулярной жидкости уровня растворимого маркера апоптоза sFasR, лиганд которого располагается на мембране ооцита.
Подтверждением существования андрогенного микроокружения развивающихся ооцитов является высокая концентрация растворимого маркера апоптоза sFasR в жидкости антральной полости [14].
На рис. 2 показана динамика sFasR у пациенток с гиперандрогенией и ТПФ.
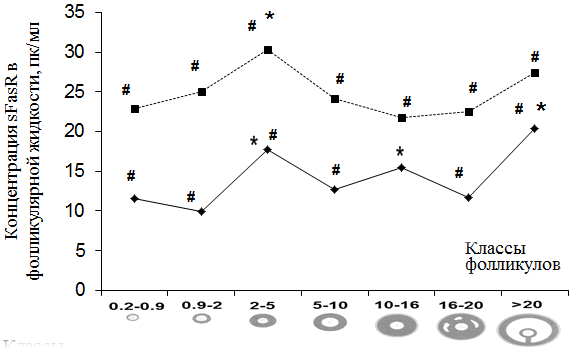
Рис. 2. Содержание sFasR в фолликулярной жидкости антральных фолликулов при гиперандрогении и ТПФ.
В группе пациенток с ТПФ было отмечено 2 пика секреции sFasR (уровни 10,2 – 12,3 пкг/мл и 17,68 ± 0,6 пкг/мл) (p < 0,05), соответственно.Выявление первого пика может быть объяснено известным фактом массовой атрезии пула фолликулов на этапе селекции доминантного фолликула. Второй пик роста уровня sFasR, вероятно, связан с развитием преовуляторной волны атрезии фолликулов, вызванной снижением концентрации ФСГ в позднюю фолликулиновую фазу цикла. Указанный дефицит ФСГ отражается на развитии фолликулов со сниженной стероидогенной активностью, приводя к их массовой атрезии, но не влияет на развитие доминантного фолликула, активно синтезирующего эстрадиол [1, 14].
В группе пациенток с гиперандрогенией продемонстрировано достоверное (p<0,05) увеличение содержания sFasR по сравнению с показателями sFasR в соответствующих стадиях группы пациенток с ТПФ. Изменения наблюдались, начиная со стадии раннего антрального фолликула и заканчивая стадией преовуляторного фолликула.
Эти результаты подтверждают полученные ранее данные о том, что в развивающихся фолликулах женщин с измененным гормональным статусом активированы процессы запрограммированной гибели клетки [14].
Апоптоз гранулезных клеток яичника контролируют экспрессией генов, кодирующих компоненты лиганд-рецепторного комплекса, инициирующего апоптоз. Запуск процесса апоптоза осуществляется посредством взаимодействия между FasL ооцитов и FasR гранулезных клеток [13].
В данной работе нам показалось интересным проанализировать динамику FasL в ФЖ антральных фолликулов. На рис. 3 показана динамика FasL при гиперандрогении и ТПФ.
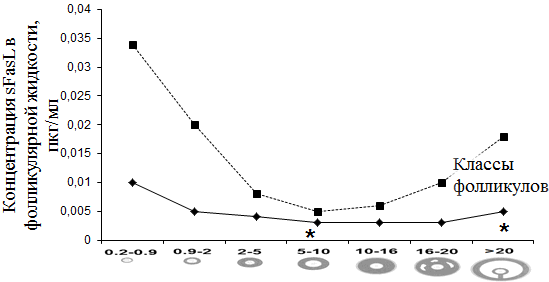
Рис. 3. Содержание sFasL в фолликулярной жидкости антральных фолликулов при гиперандрогении и ТПФ.
Известно, что апоптоз может происходить в гранулезных клетках фолликулов на любой стадии развития. Однако выраженность данного процесса максимальна на стадии доминантного фолликула [14].
В проведенном нами исследовании у пациенток с ТПФ в стадиях раннего антрального и преовуляторного фолликулов отмечалась достоверно низкая концентрация sFasL (p<0,05), соответствующая пикам секреции sFasR. Данный факт, вероятно, объясняет низкий уровень апоптоза, протекающий в физиологических условиях.
В группе пациенток с ГА уровни sFasL были значительно выше по сравнению с показателями sFasL в соответствующих стадиях контрольной группы пациенток.
Высокая концентрация выявленных нами растворимых маркеров апоптоза может свидетельствовать о наличии растворимых комплексов Fas-FasL в ФЖ, что является косвенным свидетельством активации апоптоза гранулезных клеток фолликулов при гиперандрогении. Данный факт хорошо соотносится с преобладанием андрогенного профиля микроокружения развивающихся ооцитов пациенток с гиперандрогенией [5].
Существенную роль в регуляции апоптоза клеток развивающихся фолликулов играют вазоактивные соединения (эндотелин-1, оксида азота и пр.).
Как известно, эндотелий сосудов, маркером состояния которого выступает эндотелин-1, является основным регулятором местного кровотока развивающегося доминантного фолликула. Рецепторы эндотелина-1 экспрессируются не только на начальной стадии формирования доминантного фолликула, но и в период овуляции, как в гранулезных, так и в тека-клетках [12].
На рис. 4 показана динамика уровня эндотелина-1 в ФЖ антральных фолликулов при гиперандрогении и ТПФ.
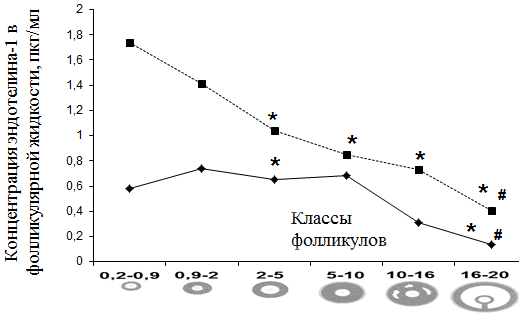
Рис. 4. Содержание эндотелина-1 в фолликулярной жидкости антральных фолликулов при гиперандрогении и ТПФ.
На заключительных стадиях развития фолликула в группе ТПФ значения уровней эндотелина-1 были достоверно (р < 0,05) понижены по отношению к показателям эндотелина-1 в стадии раннего антрального фолликула.
В группе пациенток с эндокринным бесплодием уровни эндотелина-1 в процессе фолликулогенеза превышали значения данного маркера в соответствующих стадиях группы пациенток с ТПФ (р < 0,05).
Для объяснения данного факта можно предположить, что повышение концентрации эндотелина-1 в развивающихся фолликулах связано с гиперандрогенным статусом пациенток и сопровождается дисбалансом вазоактивных компонентов, с одной стороны, регулируемых эндотелином, а с другой стороны - обусловливающих окислительный стресс [4, 10]. Следствием подобного стресса может являться выраженный вазодилататорный эффект с последующим замедлением кровотока и редукцией пролиферативных процессов в развивающихся доминантных фолликулах.
При изучении силы и характера взаимосвязей между маркерами функциональной компетентности и степенью зрелости фолликулов у пациенток с ТПФ была выявлена сильная степень влияния эндотелина-1 (r=-0,76; p=0,05) на рост и развитие фолликулов.
У пациенток с гиперандрогенией было выявлено усиление степени отрицательного воздействия эндотелина-1 (r=-0,89; p=0,007) на развитие фолликулов.
Таким образом, нами обнаружено влияние эндотелина-1, тестостерона и растворимых маркеров апоптоза на рост и развитие фолликулов женщин, страдающих эндокринным бесплодием. Указанные процессы отмечены, начиная с ранних стадий фолликулогенеза. Наши данные позволяют сделать вывод о том, что помимо «классических» регуляторов апоптоза клеток фолликулов (стероидные гормоны, система FasL/FasR), важную роль в реализации запрограммированной клеточной гибели в (пато)физиологических условиях в фолликуле играет изменение функциональной активности клеток эндотелия. Мы считаем оправданным применение исследованных молекул в качестве маркеров качества фолликулогенеза.
