В доинсулиновую эру основной причиной смерти пациентов с сахарным диабетом (СД) были диабетические комы [1]. В настоящее время, по данным Всемирной организации здравоохранения (ВОЗ), в большинстве стран диабет стал одной из главных причин преждевременной заболеваемости и смертности в связи с повышенным риском сердечно-сосудистых заболеваний, которые являются причиной смерти 50-80% больных. Сформировалось представление о СД как о сердечно-сосудистом заболевании, при котором риск неблагоприятных исходов выше, чем при ишемической болезни сердца (ИБС) [2-4]. Одним из факторов, влияющих на высокую частоту сердечно-сосудистых осложнений, является периферическая вегетативная дизрегуляция синусного узла сердца, формирующаяся в условиях хронической гипергликемии [5].
Вегетативная нервная система (ВНС) с ее реперкуссивными свойствами, принадлежностью к церебральным интегральным системам и автономностью на периферическом уровне первой откликается на эндо- и экзогенные стрессоры и активно участвует в формировании синдромов заболевания [6,7]. При этом если определение надсегментарного вегетативного статуса привносит в клиническую выраженность заболевания неспецифические психовегетативные синдромы, то исследования периферического вегетативного состояния позволяют иногда выявить и патогенетически связанные особенности [8]. Такая возможность предоставляется высокоточным анализом вариабельности сердечного ритма (ВСР) [9]. В частности, многовариантные дизрегуляции синоатриального узла сердца (СУС), пейсмекера первого порядка, обязательно участвуют в формировании сердечно-сосудистой патологии, она осложняет течение СД, прогрессируя, приводит к смерти от сердечно-сосудистых происшествий.
Анализ публикаций [10-12] свидетельствует о развитии у пациентов с СД кардиальной вегетативной дисфункции, как одного из проявления периферической вегетативной недостаточности. Роль же ВНС в патогенезе сердечно-сосудистых осложнений при СД остается не до конца изученной и нуждается в более современной трактовке. В этих условиях оценка периферической вегетативной регуляции пейсмекерной активности СУС с помощью ритмокардиографии высокого разрешения (РКГ) при СД может предоставить новые данные для ранней диагностики предвестников сердечно-сосудистого неблагополучия, позволит выделить особенности периферической вегетативной и гуморально-метаболической регуляции СУС и научно обосновать их клиническое значение.
Цель работы заключалась в изучении особенностей периферических вегетативных дизрегуляций синусного узла сердца у пациентов с СД 1 типа (СД1).
Материалы и методы. Обследовано 315 больных в возрасте от 18 до 73 лет с СД1, госпитализированных в эндокринологическое отделение Челябинской областной клинической больницы. Критерии включения: достоверность диагноза СД1 согласно диагностическим критериям ВОЗ. Критерии исключения: острые и хронические заболевания органов соматической сферы в активной фазе, беременность, прием в день обследования лекарственных препаратов. В исследование вошло 147 пациентов с СД1. Средний возраст больных СД1 составил 36,3±13,0 лет. Соотношение по полу в группе СД1: 87 (59%) мужчин и 60 (41%) женщин. Длительность заболевания 11,1±10,3 лет. Возраст начала диабета 24,8±12,3 лет. Уровень HbA1c 9,9±2,5%. В состоянии декомпенсации находилось 60,3%, субкомпенсации - 32,7%, компенсации – 7%. Среднесуточная гликемия колебалась от 3,3 до 15,1 ммоль/л, составляя в среднем 8,2±4,3 ммоль/л. Индекс массы тела (ИМТ) - 24±4,3 кг/м2. Диагностика диабетической автономной кардиальной нейропатии (АКНП) проводилась согласно утвержденным критериям Toronto Consensus Panel on Diabetic Neuropathy [5]. Для изучения периферических вегетативных дизрегуляций синусного узла использовали аппаратно-программный комплекс КАП-РК-01-«Микор» высокого разрешения. Оценивались следующие показатели ВСР: RR(с), SDNN(с), АRA(с), среднеквадратические отклонения трёх видов волн – гуморально–метаболических, симпатических, парасимпатических (бl(с), бm(с), бs(с)) и их процентные соотношения (VLF%,LF%,HF%). Реактивность в пробах модифицированной Вальсальвы (Vm), Ашнера (Pa), активной ортостатической (Aop) и с физической нагрузкой (PWC120) оценивались сопоставлением величины максимальной реакции (DRR), времени её достижения (tAB) и восстановления (tr) относительно РКГ в позе лёжа (Ph). Сравнение показателей ВРС производилось со средними значениями показателей вариабельности сердечного ритма полученными из большого контингента лиц, считающихся практически здоровыми. Статистическая обработка данных осуществлялась помощью программы STATISTICA 6.0 c использованием непараметрических методов (критерии Манна-Уитни). Данные представлены в виде M±SD.
Результаты. При РКГ исследовании во всех пробах у здоровых лиц (рис. 1) в волновой структуре сердечного ритма (СР) присутствовали все 3 вида волн - l, m, s (VLF, LF, HF). Их средние значения даны в табл. 1 в верхней строке. Волны СР имели достаточную амплитуду (σl, σm, σs) с преобладанием амплитуды высокочастотных парасимпатических колебаний. Спектральное соотношение регулирующих факторов (VLF%, LF%, HF%) демонстрировало стойкое и преимущественное парасимпатическое действие (HF%) на пейсмекерную активность СУ (рис. 2, справа). Кроме позиции в Аор, когда возросли значения симпатических РКГ показателей из-за барорецепторного реагирования на вертикальную позу, перераспределения тонуса магистральных и резистивных сосудов, снижения сердечного наполнения и выброса, компенсируемых тахикардией и, соответственно, симпатическим укорочением интервалов (табл. 1). Реакции сердечного ритма (СР) в пробах соответствовали направленности стимулов и были достаточными по показателям ∆ RR и tАВ с быстрым и полным восстановлением исходных уровня и волн СР (табл. 2). В группах же с СД 1 данные существенно отличались от контроля (табл. 1,2).
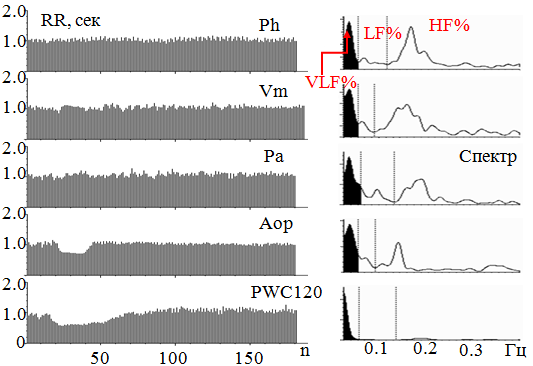
Рис. 1. Ритмокардиограммы и спектрограммы здоровой женщины. Хорошо видна трёхкомпонентная структура ВСР с волнами достаточной амплитуды. В пробах нормальная реакция на стимулы. На спектрограмме наибольшая спектральная плотность в высокочастотном парасимпатическом диапазоне (HF%), наименьшая – в очень низкочастотном гуморально-метаболическом (VLF%)
Изучение показателей временного анализа ритма сердца у пациентов с СД1 выявило значимое уменьшение длительности RR до 0,806±0,102 с, соответствующее увеличению средних значений частоты сердечных сокращений (ЧСС). Было обнаружено достоверное, более чем в 2 раза ниже контрольных цифр, снижение общей вариабельности сердечного ритма - σRR до 0,026±0,017 c в покое, а так же после стимуляции в пробах. Отмечалось двукратное снижение амплитуды дыхательной аритмии – ARA в покое, Vm, pA, Aop. Выявлено выраженное снижение абсолютных показателей среднеквадратичных отклонений гуморально–метаболических (σl) и симпатических (σm) волн, резкое снижение в 2-3 раза абсолютных показателей среднеквадратичных отклонений парасимпатических волн (σm) (табл. 1).
Таблица 1. Временные статистические показатели анализа вариабельности сердечного ритма здоровых лиц (n=41, верхняя строка) и больных сахарным диабетом 1 типа (n=147, вторая строка)
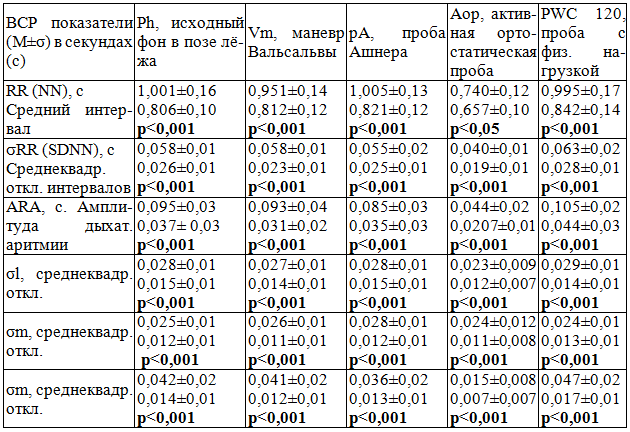
Примечание: в данной и в следующих таблицах жирным шрифтом выделены значения критерия p, согласно которым достоверно, с учётом коэффициентов вариации, отвергается гипотеза равенства в группах сравнения, p<0,05–0,001
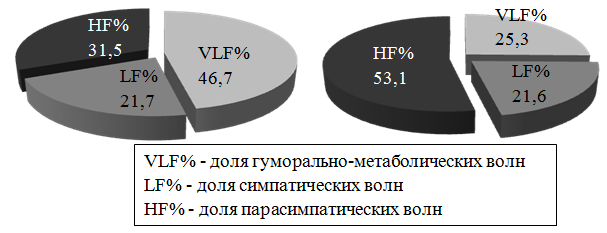
Рис. 2. Показатели спектрального анализа ВСР больных сахарным диабетом 1 типа (n=147, слева) и здоровых лиц (n=41, справа)
Спектральный анализ соотношения факторов регуляции в СУ показал патологическое перераспределение влияний на пейсмекерную активность в синоатриального узла у пациентов с СД1. Возросло гуморально-метаболическое воздействие – VLF% на пейсмекеры более чем в 2 раза относительно гр. К. При этом снизилось влияние симпатической регуляции – LF%, и снизился вклад парасимпатических колебаний в общем энергетическом спектре – HF%. При этом гуморальное влияние в СУС стало основным. Это свидетельствовало о значительной глубине патологических нарушений в регуляции пейсмекерной активности СУС у пациентов с СД (рис. 2).
Таблица 2. Показатели анализа ВСР периодов стимуляции в пробах здоровых лиц (n=41, верхняя строка) и больных СД1 типа (n=147, вторая строка)
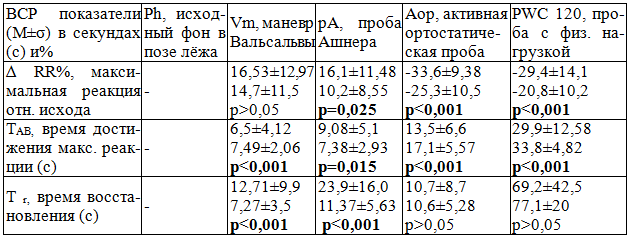
Реагирование ВСР при СД 1 (RR) в пробах было ниже нормы. Существенно и во всех пробах и позициях возросло время достижения максимальной реакции (tАВ) на стимул (табл. 2).
В зависимости от выраженности поражения ВНС по результатам стандартных вегетативных проб больные были разделены на группы: АКНП 1 - пациенты с начальными проявлениями вегетативной недостаточности (2 пограничных или 1 положительный результат), АКНП 2 - больные с выраженной вегетативной нейропатией (2 положительных результата), АКНП 3- пациенты с тяжёлой вегетативной недостаточностью (2 и больше положительных результатов, ортостатическая гипотония, вегетативная денервация СУС).
Пациенты в группе АКНП 2 и 3 отличались большей длительностью заболевания, более высоким уровнем гликированного гемоглобина и более высокой протеинурией. У пациентов с СД1 выявленная АКНП почти в половине случаев была тяжёлой степени (табл. 3).
При спектральном анализе, определяющем соотношение регулирующих в СУ факторов, обнаружены изменения, отличающие ВСР у больных СД от нормального регулирования в СУ. В норме, у здоровых лиц должно быть небольшое преобладание парасимпатических волн ВСР–σs% (HF%), в частотном анализе спектральная мощность высокочастотного диапазона – HF% должна быть больше, чем гуморального – VLF%, а в сумме с симпатическими колебаниями (LF%) тем более больше. У пациентов с СД этот фактор регуляции, судя по доле HF%, был снижен, несмотря на то, что высокочастотный диапазон был увеличен в спектральной плотности из-за патологических непарасимпатических волн (НПВ). Колебания состояли из небольших удлинений 3-5 интервалов, они патологичны, так как в норме истинные парасимпатические колебания в ВСР формируются из удлинения 1 и редко 2-х RR-интервалов, когда вагусный импульс поступает в СУС в конце диастолической деполяризации. НПВ обнаружены у 80% (117 человек) пациентов с СД1 (рис. 3). «Пик» спектральной плотности НПВ составил около 0,16-0,26 Гц (в среднем 0,23±0,045 Гц), а период волн ВСР 3,7±4 секунд. Наличие данных волн коррелирует с иммунологическими нарушениями и клиникой эндогенной интоксикации (8,13).
Таблица 3. Распределение на подгруппы пациентов с СД1 (n=147) в зависимости от степени тяжести АКНП
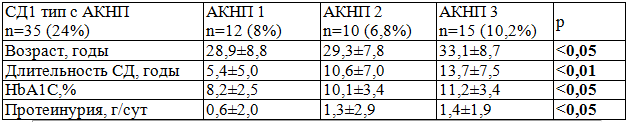
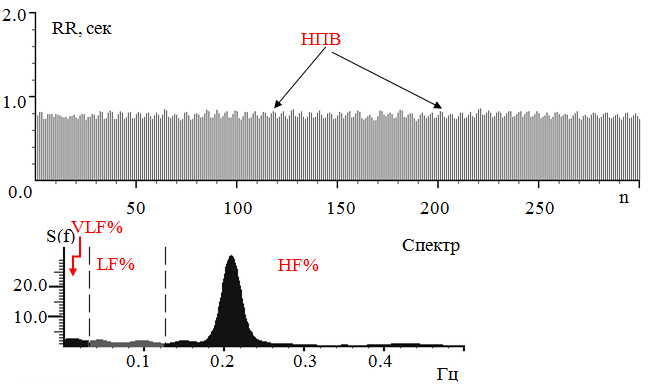
Рис. 3. РКГ пациента с СД 1 и НПВ в покое. Заметны волны из преобладающих низкоамплитудных удлинений в 3-5 межсистолических интервалов, их частота 0,23±0,045 Гц. Они имеют «пик» спектральной плотности на спектрограмме в высокочастотном диапазоне (HF,%)
Выводы
1. У пациентов с СД1 при ритмокардиографическом исследовании обнаружены расстройства периферической вегетативной регуляции синоатриального узла сердца, обусловленные значительным угнетением симпатического и парасимпатического влияний, выраженным усилением роли гуморально-метаболических воздействий на пейсмекерную функцию СУС, снижением реактивности ритма при действии стимулов.
2. Определены особенности автономной дизрегуляции синусового узла в виде формирования непарасимпатической высокочастотной периодики с «пиком» спектральной плотности 0,23±0,045 Гц и периодом волн ВСР 3,7±4 секунд, что связано с аутоиммунной природой СД1.
3. У наиболее клинически тяжелых пациентов с СД1 наблюдалась автономная кардионейропатия. Данное состояние является прогностически крайне неблагоприятным, рассматривается как высокий риск летального исхода.
