Актуальность. Синдром Кушинга (СК) – это комплекс симптомов и признаков, возникающих в результате длительного воздействия неадекватно высоких концентраций свободных глюкокортикоидов [1]. Самой частой причиной СК является экзогенный прием препаратов глюкокортикоидов. В свою очередь эндогенный СК встречается реже и обусловлен гиперпродукцией глюкокортикоидов надпочечниками. Институт Национального здоровья США отнес эндогенный СК к разряду редких заболеваний в связи с тем, что его частота встречаемости в общей популяции не превышает 10-15 случаев на 1000000/год [2].
Как известно, клиническая картина СК включает в себя многочисленные симптомы и признаки, которые можно разделить на неспецифические и специфические. В основе последних лежит именно хронический гиперкортицизм. К данным симптомам относят характерные стрии, слабость проксимальных мышц конечностей, плетору лица, нетравматичное образование кровоподтеков, остеопороз у молодых пациентов. Наличие этих симптомов у больного является показанием к проведению скрининга на выявление СК [3].
Таким образом, длительное время существовала уверенность в том, что СК редкое, но при этом клинически «яркое» заболевание. Однако, результаты последних зарубежных исследований по изучению СК в специфических популяциях больных, поставили под сомнение оба эти утверждения. Так, было показано, что специфические симптомы СК, которые как уже было отмечено, служат показанием к проведению скрининга для выявления СК, могут отсутствовать у половины больных СК [4]. Кроме того, клиническая картина СК может быть представлена только сахарным диабетом (СД) 2 типа, гипертензией или ожирением [4], то есть, теми заболеваниями, которые широко распространены в общей популяции. Было показано, например, что частота встречаемости СК в популяции пациентов с СД 2 типа значительно превысила таковую в общей и составила до 9,4% [4]. Иными словами, на настоящий момент описана «новая» форма СК, так называемый клинически скрытый СК [4,5].
Как известно, при наличии специфических клинических признаков, отражающих именно хронический гиперкортицизм, СК является тяжелым инвалидизирующим состоянием. Большинство пациентов погибает от инфаркта миокарда и нарушения мозгового кровообращения. Так, частота сердечно-сосудистой смертности в популяции с СК в 5 раз выше частоты сердечно-сосудистой смертности в общей популяции. Более того, даже при лечении осложнений пациенты с персистирующим СК продолжают иметь повышенное стандартизованное отношение смертности. В то же время после нормализации уровня глюкокортикоидов, уровень смертности в популяции с СК становится такой же, как в общей [4]. Однако, на настоящий момент неизвестно, относится ли это к пациентам с клинически скрытым СК.
Таким образом, учитывая распространенность СД 2 типа в мире, данные о повышенной частоте встречаемости СК в популяции пациентов с СД 2 типа, диагностика клинически скрытого СК у данной категории больных является актуальной проблемой. Также представляет интерес изучение метаболического профиля больных СД 2 типа с и без клинически скрытого СК.
Стоит отметить, что на сегодня день какие-либо данные о клинически скрытом СК в российской популяции пациентов с СД 2 типа отсутствуют.
Цель: определить относительную частоту встречаемости клинически скрытого СК в популяции пациентов с СД 2 типа и сравнить метаболический профиль больных СД 2 типа с верифицированным клинически скрытым СК и больных СД 2 без СК.
Материалы и методы: для реализации целей исследования было обследовано 128 пациентов. Критериями включения в исследование были: наличие СД 2 типа, индекс массы тела более 25кг/м2, возраст старше 30 лет. Критерии исключения: наличие специфических симптомов гиперкортицизма (легкое образование кровоподтеков, плетора лица, проксимальная мышечная слабость, характерные красно-фиолетовые стрии более 1 см в ширину), прием препаратов глюкокортикоидов, декомпенсация СД, частые гипогликемии, хроническая почечная недостаточность, острое заболевание, депрессия, нарушение цикла день/ночь, алкоголизм, беременность. Последние 8 состояний, как известно, сопровождаются функциональной гиперактивностью гипоталамо–гипофизарно-надпочечниковой оси, что может приводить к получению ложноположительных результатов тестов скрининга СК. Обследование пациентов было разделено на 3 этапа. На первом этапе всем больным был выполнен скрининг СК с использованием такого высокочувствительного теста, как ночной супрессивный тест с 1 мг дексаметазона (СТД 1мг) [3]. В случае, если уровень кортизола плазмы в 08-00 на следующий день после теста был ниже 50нмоль/л (отрицательный результат), диагноз СК был исключен, и дальнейшее обследование не проводилось. При уровне кортизола плазмы выше 50 нмоль/л (положительный результат), пациенты переходили на второй этап обследования, целью которого было подтверждение СК. Для этого однократно измеряли уровень свободного кортизол в суточной моче, уровень кортизола плазмы в 24-00, согласно всем правилам преаналитического этапа [3], и производили расчет коэффициента циркадного ритм секреции кортизола [6]. В случае, если все показатели были в пределах нормальных значений, диагноз СК был исключен, и дальнейшее обследование не проводилось. В случае получения хотя бы одного результата выше нормы, пациенты переходили на 3 этап исследования, целью которого было определение формы СК. Для этого измеряли уровень адренокортикотропного гормона (АКТГ) плазмы в 08-00 и проводили супрессивный тест с 8мг дексаметазона (СТД 8 мг). В зависимости от полученных результатов выполнялась топическая диагностика СК (компьютерная томография (КТ) надпочечников, магнитно-резонансная томография (МРТ) головного мозга).
Результаты и их обсуждение. Согласно первому этапу обследования, из 128 пациентов у 111 имел место отрицательный результат СТД 1 мг, и, соответственно, СК был исключен. У оставшихся 17 пациентов уровень кортизола плазмы после СТД 1 мг превышал 50 нмоль/л (положительный результат), в связи с чем их обследование было продолжено. Согласно второму этапу обследования, из 17 у 4 пациентов были получены нормальные результаты тестов. Таким образом, диагноз СК у них был исключен, и дальнейшее обследование не проводилось. Оставшиеся 13 пациентов имели минимум один ненормальный результат тестов второго этапа, и поэтому были обследованы дальше. Согласно третьему этапу обследования, были диагностированы следующие формы гиперкортицизма: 3 пациентки (№1-3) имели АКТГ-зависимый СК (повышенный уровень АКТГ, подавление уровня кортизола 50-90% после СТД 8 мг, микроаденома гипофиза на МРТ головного мозга); 1 пациентка (№4) – АКТГ-независимый СК (подавленный уровень АКТГ, аденома надпочечника). У оставшихся 9 пациентов были получены неоднозначные результаты: у 1 пациентки (№5) верифицированы двусторонние аденомы надпочечников с автономной гиперсекрецией глюкокортикоидов (уровень АКТГ в пределах референсных значений, подавление уровня кортизола на 85% после СТД 8мг). У двух пациенток (№6-7) диагностирована односторонняя узелковая гиперплазия надпочечника с автономной гиперсекрецией глюкокортикоидов (уровень АКТГ в пределах референсных значений, подавление уровня кортизола на 90, 92% после СТД 8 мг). Полученные результаты оставшихся 6 пациентов (№8-13) нами были расценены как функциональная гиперактивность гипоталамо–гипофизарно-надпочечниковой оси, т.к. на МРТ головного мозга и КТ надпочечников органической патологии не было найдено. Подробные результаты второго и третьего этапов обследования представлены в табл. 1.
Три пациентки (№1-3) были консультированы нейрохирургом и им было рекомендовано оперативное вмешательство. Пациентка №4 была консультирована хирургом-эндокринологом, однако от оперативного вмешательства она отказалась. Таким образом, ей и оставшимся 9 пациентам (№5-13) было рекомендовано динамическое наблюдение.
Повторное обследование пациентов №4-13 было выполнено через полгода и год. У пациентов №5-7 результаты скринингого теста, СТД 1 мг, были в пределах нормы, поэтому более углубленное обследование не было показано. Однако, учитывая наличие объемных образований надпочечников у этих пациенток, им было рекомендовано динамическое наблюдение (СТД 1 мг и КТ надпочечников ежегодно). У пациентов №8-13 результат СТД 1 мг был также отрицательный, что еще раз подтвердило предположение о том, что на момент первичного обследования по какой-то неизвестной причине имела место функциональная гиперактивность гипоталамо–гипофизарно-надпочечниковой оси. Дальнейшее обследование и наблюдение этих пациентов не было показано. Что касается пациентки №4, то по сравнению с изначальными результатами имела место отрицательная динамика, а именно: выросли значения свободного кортизола в суточной моче и кортизола плазмы в 24-00 (481,7 мкг/сут и 332 нмоль/л, соответственно), нарушился ритм секреции кортизола (81,3%), концентрация уровня АКТГ оставалась подавленной. Обращало на себя внимание то, что течение СД и артериальной гипертензии (АГ) стало более тяжелым. Показатели изначально и спустя год соответственно на фоне постоянной лекарственной терапии и соблюдения принципов диетотерапии при СД: гликированный гемоглобин (HbA1c) - 5,5%, 9,8%, индекс массы тела (ИМТ) – 42кг/м2, 46кг/м2, артериальное давление (АД) - 130/80мм.рт.ст., 160/90мм.рт.ст. Пациентке была рекомендована консультация хирурга-эндокринолога, от которой она повторно отказалась.
Tаблица 1. Результаты второго и третьего этапов обследования
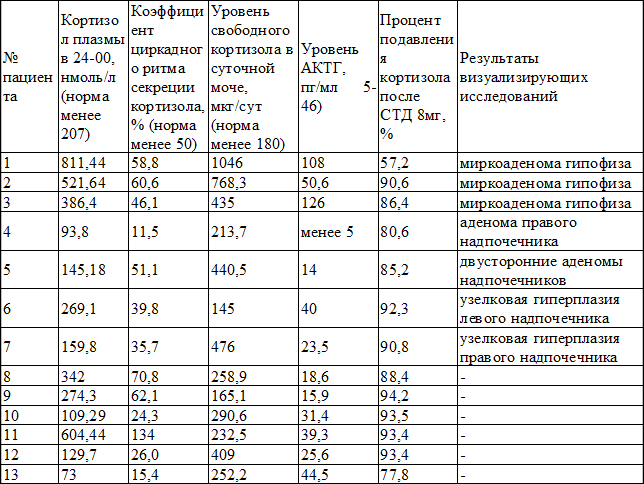
Таким образом, относительная частота встречаемости клинически скрытого СК составила 3,1%. Частота ложноположительных результатов тестов составила 12,8%. Полученные результаты в целом согласуются с данными зарубежных исследований [4].
Для реализации второй цели исследования, а именно сравнения метаболического профиля, были сформированы следующие группы пациентов: 1 группа – 111 пациентов (у которых СК был исключен на 1 этапе обследования), 2 группа – 4 пациента (у которых СК был исключен на 2 этапе обследования), 3 группа – 6 пациентов (у которых имела место функциональная гиперактивность гипоталамо–гипофизарно-надпочечниковой оси), 4 группа – 3 пациентки (у которых были обнаружены образования надпочечников с автономной гиперсекрецией кортизола), 5 группа – 4 пациентки с подтвержденным синдромом СК.
Сравнению подлежали следующие анамнестические и лабораторные показатели: возраст, стаж диабета, возрастной дебют диабета, ИМТ, окружность талии (ОТ), уровень общего холестерина (ОХС), триглицеридов (ТГ), липопротеидов низкой плотности (ЛПНП), HbA1c, уровень глюкозы плазмы натощак, значения систолического АД (САД) и диастолического АД (ДАД). Учитывая ненормальное распределение значений признаков, проверка гипотез о равенстве групповых средних проводилась с помощью непараметрических критериев Ван дер Вардена (VdW) и Краскела-Валлиса (KW). Критическое значение уровня статистической значимости p при проверке нулевых гипотез принималось равным 0,05.
Подробные результаты сравнительного анализа представлены в табл. 2,3.
Таблица 2. Средние значения изучаемых показателей в пяти группах
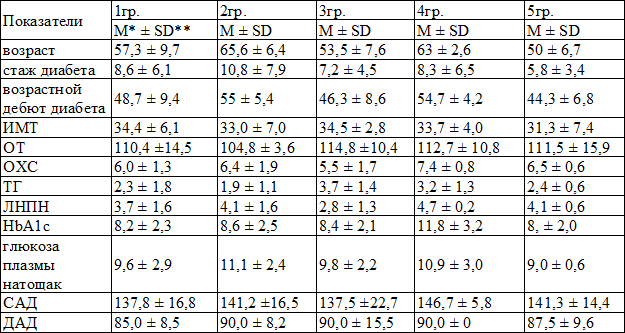
Примечание: *М – среднее значение, **SD – стандартное отклонение
Как видно из табл. 3, статистически значимые различия средних 1 гр. и 5 гр. отсутствовали. Иными словами, пациенты с СК по сравнению с пациентами без СК не имели более высоких показателей гликемии натощак, HbA1c, липидограммы, АД и др., которые потенциально могли бы ухудшить сердечно-сосудистый прогноз.
Обратили на себя внимание статистически значимые отличия уровня ТГ между 1 гр. и 3 гр., а также уровня HbA1c между 1 гр. и 4 гр.
Таблица 3. Сравнительный анализ изучаемых показателей между группами
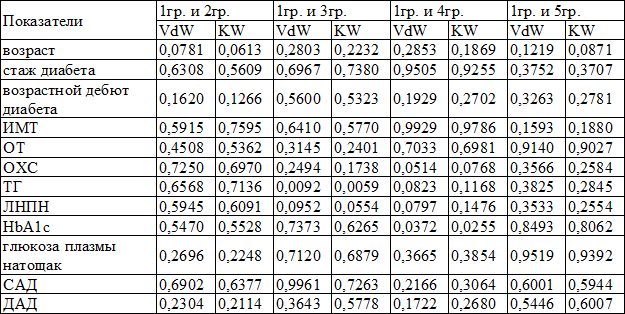
Учитывая разнородность данных, для того, чтобы перепроверить полученную информацию, был выполнен дискриминантный анализ. Согласно его результатам, используемые показатели не несли в себе достаточно важную информацию, которая могла бы объяснить различие 5 сравниваемых групп. Иными словами, пациенты всех 5 групп не имели отличий по изучаемым анамнестическим и лабораторным показателям.
Данные зарубежных исследований по сравнению метаболического профиля пациентов с клинически скрытым СК и без СК дают противоречивую информацию [6, 7]. Безусловно, авторы отдают себе отчет, что ограничением к однозначной интерпретации как полученных результатов, так и результатов других исследований являлся малый объем выборки пациентов с клинически скрытым СК.
Выводы
1) Относительная частота встречаемости клинически скрытого СК в популяции пациентов с СД 2 типа составила 3,1%, что значительно превышает частоту встречаемости СК в общей популяции.
2) Частота ложноположительных результатов составила 12,8%, что превышает частоту встречаемости клинически скрытого СК. Это, в свою очередь, свидетельствует против проведения скрининга клинически скрытого СК у всех пациентов с СД 2 типа. Однако, существует необходимость в оптимизации скрининга клинически скрытого СК.
3) В одной четвертой случаев идет прогрессирование клинически скрытого СК, проявляющееся более выраженным нарушением ритма секреции кортизола, а также сопровождающееся более тяжелым течением СД и АГ.
4) Анамнез заболевания СД 2 типа, лабораторные показатели углеводного, липидного обменов, уровни АД, объединенные нами в понятие «метаболический профиль», не имеют статистически значимых различий у пациентов с СД 2 типа с клинически скрытым СК и без него.
5) Необходимы дальнейшие исследования, направленные, во-первых, на изучение относительной частоты встречаемости клинически скрытого СК в других специфических популяциях пациентов, во-вторых, подтверждение полученных результатов на более больших выборках пациентов с клинически скрытом СК.
