Введение. Основными факторами риска развития и прогрессирования диабетических микро- и макроангиопатий являются гипергликемия, артериальная гипертония и дислипидемия. Достижение их целевых значений [1] способствует устранению модифицируемых факторов риска, предрасполагающих к реализации генетически отягощенного генотипа по сахарному диабету 2 типа (СД2) и его осложнениям, прежде всего – диабетической нефропатии (ДНФ) [1]. Кроме метаболических, иммунологических и гемодинамических факторов, существуют молекулярно-генетические, определяющие развитие и прогрессирование или напротив, обладающие протективным действием, снижающим риск возникновения сосудистых осложнений СД2.
В последние годы активно развиваются ассоциативные исследования, изучающие генетическую предрасположенность к заболеваниям [2,3]. Поиск генетических маркеров, ответственных за предрасположенность или, напротив, устойчивость к заболеваниям, являются одной из наиболее актуальных задач современной медицинской науки. Выявление таких маркеров позволит выделить группы риска развития заболеваний, устанавливать индивидуальный прогноз или диагноз еще до клинической манифестации [4-6].
В настоящее время в литературе широко обсуждается генетический риск развития СД2 и его осложнений в зависимости от выявленного у индивидуума носительства генов инсулинорезистентности, генов, определяющих секрецию инсулина, а также проводятся исследования, позволяющие идентифицировать множество генов-кандидатов СД2 [7-9]. В последние годы появились данные о том, что существуют определенные генотипы, ассоциированные с различными клиническими вариантами течения СД2 [10-12].
Цель исследования: изучить ассоциацию между носительством полиморфизмов гена лептина, фактора некроза опухоли-альфа (ФНО-α), адипонектина А и ядерного активатора пролиферации пероксисом гамма (Pro12Ala), а также стадиями ДНФ и хронической болезни почек (ХБП).
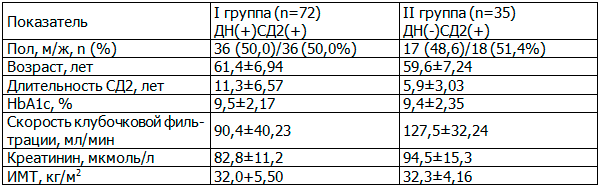
Материал и методы. Обследовано 107 пациентов с СД2 (58 мужчин, 49 женщин) 40-81 лет (средний возраст - 63,5±6,12) лет. Пациенты были разделены на 2 группы: в I группу включено 72 из них, страдающих СД2 и ДНФ, во II группу - 35 (27,6%) с СД2 типа без ДНФ. Длительность установления диагноза СД2 варьировала от 1 года до 22 (медиана – 7) лет.
Критериями включения в исследование явились следующие: СД2, ДНФ (стадии микроальбуминурии (МАУ), протеинурии (ПУ)), ХБП 1-5, принадлежность к азербайджанская национальности. К критериям исключения относились сахарный диабет 1 типа, первичные заболевания почек, мочекаменная болезнь, аномалии развития почек, симптоматическая артериальная гипертензия, хроническая сердечная недостаточность (ХСН) II-IV функционального класса (ФК) по классификации New York Heart Association (NYHA).
Осуществлено стандартное комплексное клинико-лабораторное обследование пациентов, генетические исследования. Уровень креатинина сыворотки крови оценивался фотоколориметрическим методом с помощью тест-набора Creatinine liquicolor (Human GmbH, Германия), гликированного гемоглобина - фотометрическим методом с использованием набора Glycohemoglobin (HbA1c liquidirect) (Human GmbH, Германия). Индекс массы тела (ИМТ) раасчитан по формуле Кетле, скорость клубочковой фильтрации (СКФ) - по формуле Кокрофта-Голта со стандартизацией на площадь поверхности тела [1].
У всех обследованных пациентов проведено молекулярно-генетическое исследование полиморфных вариантов четырех генов: гена активатора пролиферации пероксисом PPARG2 Pro12Аla (rs1801282), гена лептина Lep (g65911626G>A) (rs7799039), провоспалительного гена ФНО-α (c-233+8274С>T g.4682G>A) и гена адипонектина ADIPOQ (g.93054571A>G) (rs4994). Полиморфизм генов изучен на основе метода MALDI-TOF на масс-спектрометре фирмы Sequenon (США).
Массив данных обработан с помощью методов вариационной статистики с использованием программ «Microsoft Excel for Windows». Использовали методы параметрической статистики. Различия считали статистически значимыми при p<0,05.
Результаты и их обсуждение. Характеристика обследованных групп больных представлена в табл. 1.
Таблица 1. Характеристика обследованных больных азербайджанской национальности
Результаты исследования показали, что у 51 (70,8%) пациента с СД2+ДНФ была установлена стадия микроальбуминурии (МАУ), у 14 (19,4%) - стадия протеинурии (ПУ) и у 7 (9,7%) пациентов - ХБП5. В III группе из 20 пациентов с нефропатией у 5 (25,0%) больных диагностирована ХБП1, у 2-х (10,0%) - ХБП2, у 4-х (20,0%) - ХБП3, у 7-х (35,0%) - ХБП4 и у 2-х (10,0%) - ХБП5 [9]. Частота носительства однонуклеотидных полиморфизмов генов изученных генов-кандидатов представлена в табл. 2.
Таблица 2. Частота генотипов полиморфизма генов-кандидатов диабетической нефропатии в азербайджанской популяции
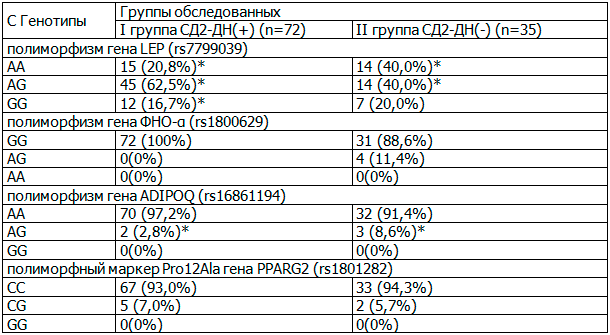
Примечание: * статистически достоверные различия между группами (р<0,05).
Установлено, что ген лептина (g65911626G>A) находится на 7q31.3 хромосоме, состоит из 3 экзонов и 2 интронов и кодируется 4,5 kb мРНК. Ген экспрессируется в белой жировой ткани, желудке, плаценте и, возможно, в молочной железе. Лептин секретируется жировой тканью преимущественно в ночное время и играет важную роль в регулировании массы тела и стимуляции расхода энергии. Мутации гена LEP изменяют секрецию гормона лептина и вызывают наследственное ожирение и ассоциированные с ним заболевания. Известны возможные генотипы: AG, AA, GG [13]. Проведенный анализ частоты встречаемости полиморфных вариантов гена лептина (g65911626G>A) у пациентов |I группы СД2+ДНФ позволил установить большую частоту выявления генотипа AG (62,5%) и наименьшую - генотипа GG (16,7%). Во II группе больных с СД2 без ДНФ генотипы AG и AA встречались с одинаковой частотой - 40,0%.
Сравнительный анализ частоты генотипов показал, что у пациентов обеих исследованных групп встречались два генотипа полиморфного маркера лептина - АА и AG, в то время как генотип GG - лишь при СД2+ДНФ. Вариант генотипа АА у пациентов с СД2 и ДНФ был обнаружен почти с одинаковой частотой и превышал таковую у обследованных I и II групп на 19,2 и 14,2% соответственно. Генотип AG часто обнаруживали у пациентов СД2 при сочетании с ДНФ.
Установлено, что ген фактора некроза опухоли (ФНО-α) - картирован на 6-й хромосоме (6p21.3) в главном комплексе гистосовместимости. В промоторной зоне гена расположены несколько полиморфных вариантов, определяющих экспрессию гена. Размер гена 2762 п.о. Синтезируемый ФНО-α состоит из 233 аминокислотных остатков молекулярной массой 25644 Да. Однонуклеотидная замена гуанина на аденин в положении -308 промотора (G-308A) приводит к увеличению продукции ФНО-α [14]. Возможные генотипы: GG, AG, AA.
При исследовании частот генотипов полиморфизма гена ФНО-α распределение оказалось следующим: у всех пациентов с СД2+ДНФ встречался лишь гомозиготный вариант полиморфизма этого гена - GG, у большинства пациентов с СД2 также обнаруживали данный генотип (в 88,6%), и лишь у небольшого числа пациентов этой группы (в 11,4%) выявлен данный гетерозиготный вариант AG. При этом генотип АА у пациентов с СД2 азербайджанской популяции не был обнаружен.
Ген адипонектина ADIPOQ (g.93054571A>G) кодирует белковый гормон массой 26 кДа, который экспрессируется преимущественно в жировой ткани, участвует в регуляции катаболизма жирных кислот, влияет на чувствительность к инсулину, уровень гликемии и течение других метаболических процессов. Ген имеет длину 16 тысяч пар оснований, расположен на хромосоме 3q27 и состоит из 3 экзонов и 2 интронов. Возможные генотипы: АА, АG, GG [15]. Из 3-х возможных генотипов полиморфного маркера адипонектина среди больных трех обследованных групп пациентов генотип АА встречался с довольно высокой частотой. Гетерозиготный вариант полиморфизма адипонектина AG выявлен лишь у пациентов с СД2-ДНФ(+) и СД2-ДНФ(-). При этом среди пациентов с СД2-ДНФ(-), носители данного генотипа встречались достоверно чаще (в 3,0 раз, р<0,01) в сравнении с относящимися к I группе - с СД2-ДНФ(+). Гомозиготный вариант GG у больных изученной выборки не встречался.
Ген гамма-рецептора PPARG (Pro12Ala) PPAR-gamma2 расположен на 3-ей хромосоме в положении 3p25, кодирует гамма-рецептор, который в основном продуцируется в жировой ткани и индуцирует пролиферацию пероксисом, отвечающих за окисление свободных жирных кислот. Данный рецептор также регулирует дифференцировку адипоцитов и гомеостаз глюкозы (определяет потребность мышечной ткани в глюкозе и ее чувствительность к инсулину), стимулирует синтез и выброс печенью параоксоназы, связывает гиполипидемические препараты и жирные кислоты, участвует в регуляции костного метаболизма. Полиморфизм Pro12Аla (rs1801282), умеренно снижающий функцию этого рецептора, является показателем снижения риска развития СД2, гиперинсулинемии, инсулинорезистентности и атеросклероза. Частота гетерозигот в популяциях европейского типа достигает 20%, гомозигот, носителей генотипа GG (что соответствует Ala/Ala) – 2%. Возможные генотипы: СС, СG, GG [16]. При изучении распределения генотипов этого полиморфного маркера Pro12Аla установлено, что среди пациентов обеих групп встречались лишь гомозиготный вариант СС и гетерозиготный вариант СG (с преобладанием первого). Частота пациентов-носителей генотипа СС среди больных с СД2-ДНФ(+), СД2-ДНФ(-) в азербайджанской популяции была сопоставимой.
Ассоциация генетического полиморфизма со стадиями ДНФ у пациентов с СД2 и ДНФ на примере гена лептина представлена на рис. 1.
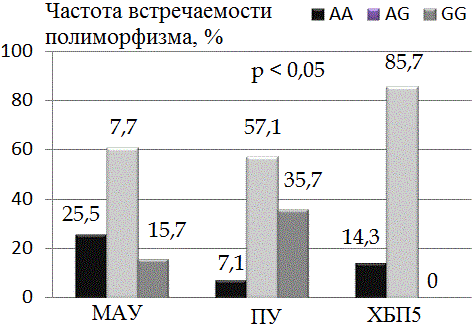
Рис. 1. Ассоциация полиморфизма гена лептина со стадиями диабетической нефропатии у больных с сахарным диабетом 2 типа в азербайджанской популяции.
На всех стадиях ДНФ преобладали гетерозиготные носитeли AG. Так, из 51 пациента со стадией МАУ 31 из них был носителем генотипа AG, 15 пациентов - генотипа АА и 7 человек - генотипа GG. Из 14 обследованных в стадии протеинурии и 7 пациентов при ХБП5 носителями генотипа AG были соответственно 8 и 6 человек, генотипа АА - 1 и 1 пациент и GG - лишь 5 пациентов в стадии протеинурии.
Отмечено увеличение числа пациентов - носителей генотипов AG среди пациентов I группы (СД2+ДНФ) в стадии МАУ в сравнении с носителями генотипов АА и GG было в 2,4 (р<0,05) и 3,9 раз (р<0,01) соответственно. Увеличение количества пациентов - носителей генотипов AG среди пациентов III группы (СД2+ДНФ) в стадии ПУ в сравнении с носителями генотипов АА и GG было в 8,0 (р<0,001) и 1,6 раз (р<0,05) соответственно, повышение количества носителей генотипов AG у больных СД2+ДНФ при ХБП5 в сравнении с носителями генотипов АА было в 6,0 (р<0,001).
Определение частоты встречаемости полиморфизма гена адипонектина у пациентов I группы с различными стадиями ДНФ показало, что среди пациентов с ДН в стадии МАУ 2 пациента явились носителями гетерозиготного генотипа AG, а остальные 49 больных с МАУ, и 14 больных в стадии ПУ и 7 - в стадии ХБП5 оказались носителями гомозиготного генотипа АА.
Изучение распределения частот генотипов в зависимости от стадии ДНФ показало, что носительство гомозиготного генотипа СС у пациентов с СД2+ДНФ на стадии МАУ обнаружено в 51 случае (70,8%), гетерозиготного генотипа CG у 3-х пациентов. На стадии ПУ носителем генотипа СС явились 13, носителем генотипа CG - 1 пациент, а ХБП5 - 6 и 1 пациент соответственно.
В табл. 3 представлено распределение частот рассмотренных генотипов у пациентов с СД2 в зависимости от степени нарушения углеводного обмена и развития нефропатии.
Таблица 3. Частота встречаемости полиморфизмов генов-кандидатов диабетической нефропатии у пациентов с СД2 и нефропатией при эугликемии
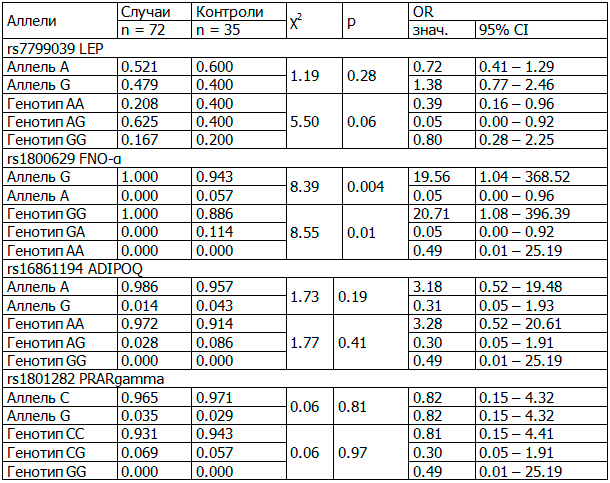
Использование мультипликативной и общей моделей наследования для однонуклеотидных полиморфизмов, распределение которых подчиняется закону Харди-Вайнберга, позволило подтвердить, что в качестве предиктора развития ДНФ у пациентов с СД2 может быть рассмотрен однуклеотидный полиморфизм rs1800629 гена FNO-α.
В ходе исследования были протестированы 4 гена, оказывающие влияние на генетическую предрасположенность к развитию ожирения и СД2, с точки зрения их вклада в развитие ДН при СД2. Необходимо отметить сопоставимые частоты встречаемости однонуклеотидных полиморфизмов генов rs7799039 LEP, rs16861194 ADIPOQ, rs1801282 PRARgamma. Однако данное обстоятельство не следует рассматривать как отсутствие вклада рассматриваемых генов в патогенез ДНФ, а с точки зрения имеющегося общего патогенетического механизма развития СД2 и ДНФ у лиц с висцеральным ожирением и превалирующего влияния глюкозотоксичности и липотоксичности и их причастности к развитию ДНФ. В нашем исследовании большинство пациентов с СД2 азербайджанской популяции имели 1 степень висцерального ожирения с абдоминальным типом распределения жира. Это усиливает роль метаболических факторов, играющих важную роль в развитии СД2 и его микрососудистых осложнений. Так, установлена негативная роль гипергликемии, конечных продуктов гликирования (в том числе – гликированных белков), переключения на полиоловый путь обмена глюкозы, активации протеинкиназы С, дислипидемии, окислительного стресса. Хроническое воспаление также является одним из звеньев патогенеза СД2 и ДНФ, при этом локальный процесс в области почечного фильтра играет важную роль в развитии ДНФ при СД2, так как способствует ее клинической манифестации. Воспалительный процесс вызывает ускорение процесса повреждения почек - миграцию моноцитов, активацию системы комплемента, нарушению агрегации тромбоцитов, «закупориванию» почечного фильтра [17]. Отсюда следует, что генетический полиморфизм гена TNF-α, являющегося ключевым в развитии хронического воспаления, оказывает влияние на развитие процесса диабетической нефропатии, при этом полиморфизм данного гена может рассматриваться в качестве генетического предиктора развития ДНФ при СД2 у пациентов азербайджанской популяции.
Выводы
- У пациентов с СД2 азербайджанской национальности выявлена высокая встречаемость генотипа AG (62,5%) гена лептина (относительный риск RR=2,50(1,09-5,72)), генотипа GG (100%) гена ФНО-α (RR=20,71(1,08-396,39)), генотипа АА (97,2%) гена адипонектина (RR=3,28(0,52-20,51)), (RR=20,71(1,08-396,39)) и генотипа СС (97,0%) полиморфного маркера Pro12Аla гена PPARG2 (RR=1,23(0,23-6,47)).
- Стадия микроальбуминурии ДН при СД2 чаще встречались у пациентов-носителей генотипа AG гена лептина(60,8%), генотипа GG гена ФНО-α (70,8%), гомозиготного генотипа АА гена адипонектина (68,0%) и генотипа СС полиморфного маркера Pro12Аla PPARG2 (70,8%).
- У больных СД2 азербайджанской популяции однуклеотидный полиморфизм rs1800629 гена FNO-α следует рассматриваться в качестве маркера развития диабетической нефропатии.
