Клиническая значимость метаболического синдрома (МС), объединенная рамками синдрома, заключается в наличии целого комплекса факторов риска, которые формируются задолго до его развития. Важное место в этом случае занимает печень [1]. В клинической практике связь МС с нарушением функций печени определяется как термин «диабетический гепатоз» (Canadian Diabetes Association. Canadian Diabetes Association 2003). Несмотря на важность нарушений печени в развитии МС многие аспекты патогенеза этого заболевания с участием гепатоцитов, в частности молекулярно-клеточные механизмы остаются не выясненными. Особенно нет четкой ясности о функциональной взаимосвязи систем микросомально-митохондриального окисления в печени при формировании МС.
Особый интерес представляет изучение влияния на микросомально-митохондриальную систему печени мембранопротекторов. Есть отдельные сведения, что хитозан и его изоформы могут позитивно влиять на функциональную активность печени при острых и хронических гепатитах [2]. Вместе с тем остается неясным, как влияет хитозан и его изоформы на субклеточном уровне в печени при формировании МС.
Целью настоящего исследования явилось изучение микросомально-митохондриального окисления в печени и влияния различных форм хитозана на эти процессы.
Материал и методы исследования. Эксперименты проведены на 60 кроликах-самцах, массой тела от 2050 до 3400 г. Метаболический синдром у кроликов вызван по методу С.А.Саидова [3]. Для создания модели метаболического синдрома в поилку животных добавляли 5% раствор сахара песка, а в корм ежедневно смешивали кристаллический холестерин в дозе 250 мг/кг массы тела. Животным подкожно вводили инсулин в дозе 0,1 ед./100 г, через день. Продолжительность эксперимента 2 месяца. Животные разделены на 3 группы: 1 группа (интактная) содержалась в естественных условиях вивария (12 кроликов). 2 группа – вызван метаболический синдром (12 кроликов). 3 группа – коррекция метаболического синдрома хитозан сульфатом (12 кроликов); 4 группа – коррекция метаболического синдрома наноформой хитозан сульфата (12 кроликов); 5 группа – группа сравнения, где коррекцию метаболического синдрома проводили глюкофажом. Хитозан является продуктом деацетилирования хитина. По химической структуре хитозан является сополимером D-глюкозамина и N-ацетил-D-глюкозамина. Хитозан является универсальным сорбентом, способным связывать огромный спектр веществ органической и неорганической природы, что определяет широчайшие возможности его применения в жизни человека. В исследованиях изучено действие хитозан сульфата и его нана формы, синтезированных на основе хитозана Bombyx mori, представленного институтом физики и химии АН РУз (зав.лаб. к.х.н. Р.Ю. Милушева).
Для коррекции МС использовали сульфат хитозана, полученный реакцией сульфатирования хитозана в среде хлорсульфоновой кислоты. Перорально водный раствор хитозан сульфата и его нано форму вводили по 25 мг/кг в течение 20 дней после получения модели метаболического синдрома. Глюкофаж, согласно инструкции данного препарата, вводили перорально из расчета – 7,14 мг/кг массы тела.
Выделение митохондриальной и микросомальной фракции печени проводилось дифференциальным центрифугированием на рефрижераторных центрифугах РС-6 и VAC-601. Содержание цитохрома Р-450 в микросомальной суспензии определяли на спектрофотометре UV/VIS (LTD, Китай) по методу Omura T., Sato R. [4]. Содержание цитохрома b5 определяли после восстановления опытных образцов суспензии микросом при добавлении НАДН. Активность амидопирин-N-деметилазы по методу Bast A., Nordhoock J. [5], анилингидроксилазы - методом А.И. Арчаков и соавт. [6], НАДФН-цитохром С-редуктазы (НАДФН-цит. С-ред) по методу Willians C.H., Kamin H. [7] и микросомальный белок по O.N. Lowry [8].
Определение активности митохондриальных ферментов печени цитохромоксидазы (ЦХО) – полярографическим методом (на полярографе LP-7 с закрытым платиновым электродом типа Кларка), сукцинатдегидрогеназы (СДГ), сукцинат-цитохром С-редуктазы (СЦС-ред.), ротенон-нечувствительной НАДН-цитохром С-редуктазы (РН-цит.С-ред.) и моноаминооксидазы (МАО) спектрофотометрическим методом (9).
Результаты исследования и обсуждение
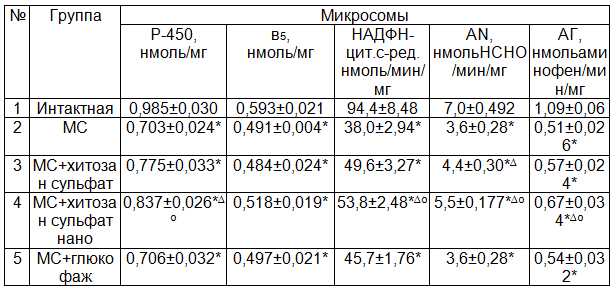
Исследования показали, что через 2 месяца от начала моделирования экспериментального МС в микросомах печени содержание цитохрома Р-450 и в5 достоверно снижается на 28,6 (Р<0,01) и 17,2% (Р<0,05) соответственно по сравнению с интактной группой (табл. 1). Активность НАДФН-цитохром С-редуктазы, амидопирин-N-деметилазы, анилингидроксилазы у животных этой группы снижается 2,48; 1,93 и 2,14 раз соответственно по сравнению с интактной группой. Эта ферментная система играет важную роль в метаболизации как эндогенных (стероидные гормоны, холестерин, жирные и желчные кислоты, простагландины), так и экзогенных (подавляющее большинство ксенобиотиков) субстратов, её функциональное состояние полностью зависит от целостности мембранных структур эндоплазматического ретикулума. Следовательно, приведенные результаты указывают на выраженное угнетение микросомального окисления в печени при метаболическом синдроме.
НАДФН-цитохром Р-450 электронтранспортная система микросом и митохондрий находится в постоянном обновлении de novo белковых ферментных комплексов, метаболическая активность которых в значительной мере зависит от изменяющихся физиологических условий и патологических процессов в клетках [10]. При этом синтез белковых ферментных комплексов de novo требует значительного использования АТФ и НАДФН. Митохондриальная и микросомальная системы конкурируют за связь с НАДФН в процессе его использования для свободного в митохондриальном дыхании и с сопряженным функционированием систем цитохром Р-450 гладкого эндоплазматического ретикулума [10-13].
Развитие многих заболеваний тесно связано с повреждением мембран клеток, которое приводит к нарушению их функциональной активности. Повреждение энергетических систем клетки не в состоянии вырабатывать достаточное количество АТФ и нуклеотрифосфатов [14]. В наших исследованиях при изучении активности митохондриальных ферментов выявлено существенное повышение активности моноаминооксидазы (МАО) и цитохромоксидазы (ЦХО) при МС 67,55 и 58,14% (Р<0,001) соответственно по сравнению с животными интактной группы (табл. 2). В то же время активность сукцинатдегидрогеназы (СДГ), сукцинат-цитохром С-редуктазы (СЦС-ред.), ротенон-нечувствительной НАДН-цитохром С-редуктазы (РН-цит.С-ред.) достоверно снижается на 32,92; 42,38; 44,19% (Р<0,001) соответственно по сравнению с интактной группой. Следовательно, наблюдаются значительные сдвиги в оксидазном пути использования О2 в цикле трикарбоновых кислот. Дисбаланс в системе субстратного окисления в цикле трикарбоновых кислот требует избыточного расходования НАДФН. Следовательно, угнетение активности МОС печени при метаболическом синдроме может быть связано с дефицитом НАДФН – как основного источника для функционирования НАДФН-цитохром С-редуктазы в микросомах, что отмечено в наших исследованиях. В настоящее время предлагаются различные методы восстановления окислительных процессов в микросомах и митохондриях, в том числе хитозановые производные.
Таблица 1. Влияние производных хитозана на микросомальное окисление в печени у кроликов с метаболическим синдромом (M±m)
Примечания: здесь и далее * - Р<0,05 по сравнению с интакными; ∆ - Р<0,05 по сравнению с МС; О - Р<0,05 по сравнению с МС+хитозансульфат.
Данные литературы свидетельствуют о том, что хитозан, оказывая сорбционное, липотропное, гиполипидемическое действие и стимулируя моторику желудочно-кишечного тракта и желчевыводящих путей, способствует нормализации обменных процессов [15, 16].
Исследование действия двух форм хитозана – хитозан сульфата и его нано формы на монооксигеназную систему показало достоверное повышение содержания цитохрома Р-450. При введении хитозан сульфата и его нано формы уровень цитохрома Р-450 превышал на 10,2 и 19,1% (Р>0,05 и Р<0,05 соответственно) по сравнению с таковыми показателями животных с МС. Хитозан сульфат и его нано форма достоверных изменений в содержании цитохрома в5 не вызывает. Хитозан сульфат достоверно на 30,45% (Р<0,01) повышает активность только НАДФН-цитохром с-ред. по сравнению с нелеченной группой. В то же время нано форма хитозан сульфата более значимо повышает как активность НАДФН-цитохром с-ред., так и амидопирин-N-деметилазы, анилингидроксилазы 41,6; 53,6; 31,7% (Р<0,001) соответственно по сравнению с нелеченной группой.
Таблица 2. Влияние производных хитозана на митохондриальное окисление в печени у кроликов с метаболическим синдромом (M±m)
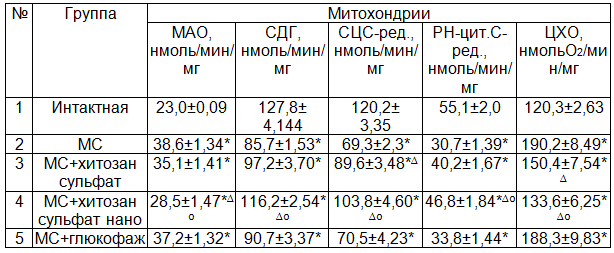
Изучение действия препарата сравнения – глюкофажа показало, что он недостаточно активен, чтобы повысить функциональную активность микросом и митохондрий. Также не выявлено значимых различий при изучении действия глюкофажа на активность митохондриальных ферментов. Глюкофаж широко применяется как средство коррекции дисметаболических расстройств при развитии МС. Возможно его эффект не связан с влиянием на процессы оксидазного и оксигеназного пути окисления. В отличие от глюкофажа производные хитозана и в большей степени хитозан нано влияют на активность ферментов митохондриального окисления. При этом хитозан нано в большей степени влияет на процесс снижения активности МАО и ЦХО и повышение скорости реакции СДГ, СЦ-цит.с.ред. РН-цит.с.ред., чем хитозан сульфат соответственно на – 18,8; 11,2% (Р<0,05) и 19,5; 15,8; 16,4% (Р<0,05).
Можно полагать, что с улучшением функциональной активности ферментов оксидазного пути окисления, способствовало улучшению функционирования ферментов цикла трикарбоновых кислот, транспорта электронов и протонов по дыхательной цепи на ее конечное звено – ЦХО. В данном случае акцептором электронов и протонов является О2, при восстановлении которого образуется Н2О. Этот путь окисления, как известно сопряжен с фосфорилированием АДФ и ресинтезом АТФ и НАДФН в митохондриях. Следует отметить, что чрезмерная активность ЦХО может быть важным фактором образования гидроксильного радикала, который является сильным окислителем активного центра цитохрома Р-450, угнетения активности ферментов микросомального окисления.
Таким образом, проведенные исследования показали, что при развитии МС наблюдается выраженное угнетение функциональной активности системы цитохром Р-450 в микросомах печени и дисбаланс в активности ферментов цикла трикарбоновых кислот в митохондриях.
Производные хитозана, в большей степени хитозан нано, позитивно влияют на восстановление нарушенной активности ферментной систем микросом и митохондрий, что можно полагать, является одной из причин снижения факторов развития МС у экспериментальных животных.
