Введение. В настоящее время во всем мире наблюдается значительный рост распространенности воспалительных заболеваний кишечника (ВЗК) [11,15,16,18,22]. Среди ВЗК неспецифический язвенный колит (НЯК) представляет особую актуальность, учитывая преимущественное поражение лиц молодого возраста, тяжелое течение и наличие опасных для жизни осложнений [3,7]. НЯК характеризуется хроническим рецидивирующим диффузным воспалением слизистой оболочки толстой кишки с развитием кишечных и внекишечных проявлений и осложнений [1,4,5,8]. В настоящее время для его диагностики используется комплексный подход с применением клинического обследования, рентгенологического, эндоскопического и гистологического методов исследования. Одним из современных способов оценки состояния слизистой оболочки толстой кишки является иммуногистохимическое исследование с определением маркеров пролиферации и апоптоза. Таким образом, с помощью моноклональных антител, специфичных фазе клеточного цикла, и последующей визуализацией их методами иммуногистохимии, можно оценить пролиферацию и процесс апоптоза в клетках [9]. Наиболее часто среди маркеров пролиферации используются такие антигены как PCNA и Ki-67. Известно, что PCNA (Proliferating Cell Nuclear Antigen) участвует не только в пролиферации клеток, но и в репарации ДНК после ее повреждения [13], что делает данный антиген условно специфичным к клеточному циклу, так как восстановление ДНК может осуществляться в фазе покоя [2,20]. Другим антигеном, достоверно ассоциированным с фазами клеточного цикла, является Ki-67. Экспрессия этого белка наступает во время фазы G1, нарастает в течение клеточного цикла и резко уменьшается в фазе митоза [14]. Этот белок, в отличие от PCNA, не участвует в репарации ДНК [19]. Таким образом, экспрессия Ki-67 дает возможность идентифицировать клетки, находящиеся во всех фазах клеточного цикла, кроме фазы покоя G0 [12,17]. Среди регуляторов апоптоза наиболее изучено семейство bcl и белок p53. Белок p53 нестабилен, локализуется в ядре клеток. При повреждении ДНК белок становится стабильным, и его концентрация в ядре резко повышается. Различают два типа p53 – «дикий» и мутантный. Первый образуется в норме, имеет очень короткий период полужизни и поэтому иммуногистохимически в тканях не определяется. Мутантный белок способен связываться с «диким», полностью его инактивируя, что может приводить к стимуляции опухолевого роста. Накопление р53 в ядре клетки инициирует апоптоз даже при отсутствии повреждения ДНК. [10,23]. Ген p53 управляет экспрессией генов семейства bcl2, расположенных на внутриклеточных мембранах [21], также регулирующих процесс апоптоза.
Цель исследования. Провести анализ экспрессии маркеров апоптоза (р53) и пролиферации (Ki-67) у больных НЯК в зависимости от длительности, степени тяжести заболевания, локализации и эндоскопической активности воспалительного процесса.
Материалы и методы. Основную группу составили 80 пациентов с НЯК в возрасте от 18 до 66 лет (33 женщины и 47 мужчин), группу сравнения - 15 практически здоровых людей. Обследование пациентов проводилось с использованием клинических, лабораторных, эндоскопических, морфологических методов, а также с помощью иммуногистохимического исследования биоптатов слизистой оболочки толстой кишки. Пациенты с НЯК были разделены на группы в зависимости от степени тяжести клинических проявлений, длительности заболевания, локализации и активности воспалительного процесса. Индекс пролиферации Ki-67 (%) вычисляли путем подсчета количества иммунопозитивных ядер к общему количеству ядер. Подсчет производился не менее чем в 10 полях зрения. Об апоптозе судили по экспрессии белка p53 в поверхностном и железистом эпителии толстой кишки. При статистической обработке полученных данных, после проведения тестов на равенство дисперсий и нормальность распределения было доказано, что выборка не соответствует закону нормального распределения, поэтому для сравнения групп применялись непараметрические критерии. Для описания количественных признаков использовались медиана, верхний и нижний квартили. Результаты и обсуждение. У здоровых лиц ИП Ki-67 составил 54(46;67), что говорит о высокой пролиферативной активности клеток толстой кишки (табл.1).
Таблица 1. Индекс пролиферации Ki-67 клеток эпителия слизистой оболочки толстой кишки (%) у здоровых людей и больных НЯК.
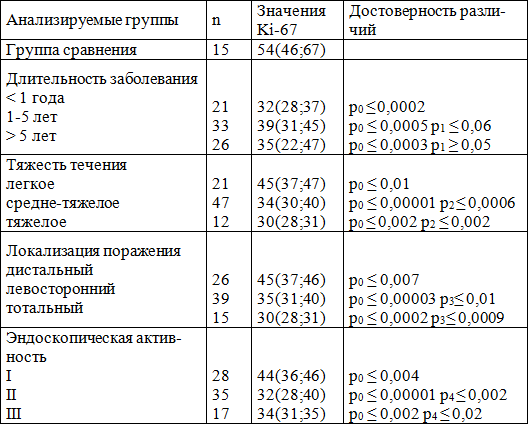
Примечание: р0 – достоверность различий с группой контроля, р1 – достоверность различий с длительностью заболевания менее 1 года, р2 – достоверность различий с легким течением заболевания, р3 - достоверность различий с дистальной локализацией заболевания, р4 - достоверность различий с I степенью эндоскопической активности.
Как следует из таблицы 1, повышение ИП Ki-67 в группе больных с длительностью НЯК от 1 года до 5 лет по сравнению с 1 группой (р≤0,06), можно объяснить повышенной пролиферативной активностью клеток, отражающей репаративные процессы в слизистой оболочке толстой кишки на фоне проводимой терапии. При увеличении длительности заболевания способность клеток к пролиферации снижается, о чем свидетельствует низкий показатель ИП Ki-67 в третьей группе больных. В зависимости от тяжести клинических проявлений НЯК также было выявлено изменение ИП Ki-67 (табл. 1). ИП Ki-67 уменьшался у больных со среднетяжелой формой заболевания (р≤0,0006) и тяжелой формой ( р≤0,002) по сравнению с пациентами, имеющими легкое течение, также имелось различие между группой здоровых лиц и пациентами с НЯК любой степени тяжести (р≤0,05). При анализе зависимости ИП Ki-67 от локализации воспалительного процесса было выявлено значительное снижение экспрессии маркера в группе больных НЯК с тотальным поражением толстого кишечника 30(28;31), тогда как при дистальном колите ИП составил 45(37;46) (р≤ 0,0009). Из таблицы 1 также видно, что при увеличении активности заболевания ИП Ki-67 снижается. Имеются достоверные различия между пациентами с I и II (р ≤ 0,002), I и III (р ≤ 0,02) степенями активности. Экспрессия р 53 не наблюдалась ни в одном случае в эпителии слизистой оболочки толстой кишки у практически здоровых людей. Результаты экспрессии данного белка у 48 больных НЯК представлены в таблице 2.
Таблица 2. Экспрессия белка р53 у больных НЯК.
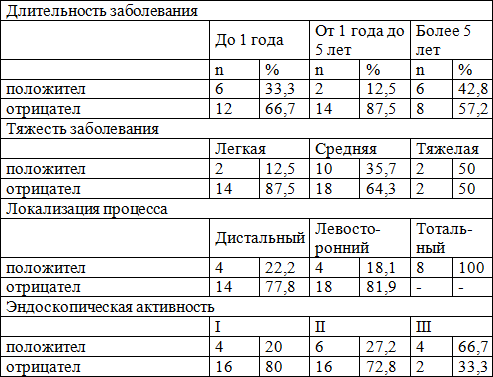
При исследовании показателя p53 в зависимости от длительности НЯК, закономерности экспрессии этого белка не выявлено, однако имеется различие в экспрессии этого маркера между группой здоровых лиц и группой пациентов с длительностью заболевания до 1 года (р≤0,05) и более 5 лет (р≤0,03). Экспрессия маркера p53 была взаимосвязана с тяжестью течения НЯК (12,5% при легком течении; 35,7 % при средней степени тяжести и 50% при тяжелом). Статистически значимые различия получены между группами здоровых лиц и пациентов со средней и тяжелой формами заболевания (р≤0,03). У больных с дистальным колитом положительный результат был получен только в 20,2% случаев, с левосторонним у 18,1% больных. При тотальном поражении кишечника экспрессия р53 обнаруживалась в 100% случаев (р≤0,03 по сравнению с дистальным колитом). Следует отметить, что экспрессия была наиболее интенсивна в участках с признаками метаплазии эпителия. Так же была выявлена зависимость от эндоскопической активности заболевания: при ее увеличении экспрессия р53 возрастала (р≤0,05).
Выводы:
1. При неспецифическом язвенном колите в фазе обострения пролиферативная активность клеток эпителия слизистой оболочки толстой кишки значительно снижена, о чем свидетельствует снижение ИП Ki-67 по сравнению с практически здоровыми людьми.
2. Отмечается увеличение экспрессии белка р53 в слизистой оболочке толстой кишки у больных НЯК по сравнению со слизистой оболочкой без воспалительных изменений.
3. При длительности неспецифического язвенного колита менее 1 года наблюдается наиболее низкий ИП Ki-67.
4. Увеличение клинической и эндоскопической активности неспецифического язвенного колита, а также протяженности патологического процесса в толстой кишке сопровождается снижением пролиферативной активности клеток эпителия толстой кишки и увеличением показателей активации апоптоза.
