Введение. В настоящее время наряду с неуклонным ростом хронической патологии верхних отделов пищеварительного тракта (ВОПТ) наблюдается тенденция к утяжелению течения кислотозависимых заболеваний (КЗЗ), увеличению удельного веса эрозивных, субатрофических и атрофических форм гастродуоденальной патологии. Эти тенденции связывают, с одной стороны, с высокой частотой хеликобактериоза в детском возрасте как одного из этиологических факторов формирования хронических заболеваний эзофагогастродуоденальной области [1]. С другой стороны, известно, что пик патологии ВОПТ приходится на период полового созревания, особенно на его начало [2]. Несбалансированность и напряженность обменных процессов, нестабильность вегетативной и эндокринной регуляций в этот критический период онтогенеза может приводить к формированию морфофункциональных изменений различных систем органов. В этой связи представляется важным исследование эндокринного статуса детей с хронической эзофагогастродуоденальной патологией в период становления пубертата в комплексе с фактором Helicobacter pylori (H.pylori)-инфицированности для уточнения механизмов формирования патологии.
Цель исследования. Оценить изменения гормональных показателей у детей I-III стадии полового развития (СПР) с хроническим гастродуоденитом (ХГД) в сочетании с гастроэзофагеальной рефлюксной болезнью (ГЭРБ) в зависимости от фактора H.pylori-инфицированности.
Материалы и методы исследования. В общеклиническую группу (ОКГ) вошло 77 детей в возрасте от 7 до 12 лет с ХГД+ГЭРБ, находившихся на лечении в педиатрическом соматическом отделении городской больницы №20 г. Ростова-на-Дону. Верификация диагноза проводилась с использованием эзофагогастродуоденоскопии (эндоскоп Olympus P-20) и выполнением биопсии слизистой оболочки (СО) желудка и пищевода. Диагностика Нelicobacter pylori осуществлялась тремя методами: 1) полимеразной цепной реакцией для детекции ДНК Нelicobacter pylori в биоптатах СО антрального отдела желудка тест-системами «Литех» (Россия); 2) уреазным методом с определением уреазной активности в биоптате СО желудка путем помещения его в жидкую среду, содержащую стандартный RU-Test Нelicobacter pylori (Россия); 3) иммуноферментным анализом сыворотки крови на наличие суммарных иммуноглобулинов к Helicobacter pylori тест-системами «DRG» (Германия). Все дети находились в I-III стадии полового развития (начало полового созревания). Для оценки клинических проявлений патологии ВОПТ с учетом фактора Helicobacter pylori-инфицированности был рассчитан интегральный показатель патологии (ИПП), разработанный Л.К. Андреещевой и С.М. Макеевым [3]. Все пациенты находились в стадии клинико-эндоскопического обострения заболевания. Исследование уровня гормонов в сыворотке крови проводилось методом иммуноферментного анализа для эстрадиола наборами фирмы R&D (США); прогестерона и тестостерона, тиреотропного гормона (ТТГ), трийодтиронина (Т3), тироксина (Т4), кортизола – наборами фирмы «Алкор Био» (Россия); инсулина – наборами фирмы «Monobind Inc.» (США); соматотропного гормона (СТГ) – наборами фирмы DRG (США); гастрина-17–наборами фирмы «BIOHIT DIAGNOSTICS» (Европа); холецистокинина – наборами фирмы PENINSULA LABORATORIES INC (USA) по рекомендуемому протоколу №3. Обследование детей осуществлялось утром, натощак. Группу контроля (ГК) составили 28 детей I-II групп здоровья, сопоставимых по возрасту, полу, половому развитию с ОКГ. Родители пациентов были ознакомлены с целью и дизайном работы, дали информированное согласие на участие их детей в исследовании и публикацию его результатов в открытой печати. Статистическую обработку результатов исследования проводили с помощью пакетов программы Statistica for Windows (версия 6.1) методами параметрической и непараметрической статистики (критерии Стьюдента, Манна-Уитни, Фишера). Данные представлены в виде абсолютных значений (N), %, средней величины (M), ошибки средней (m), медианы (Me), а также 25 и 75 квартиля [25%-75%]. Достоверным считали уровень значимости p<0,05.
Результаты исследования и их обсуждение. В результате проведенного эндоскопического и морфологического обследования больных установлено, что у 42 детей (54,5%) определялось катаральное воспаление СО желудка и двенадцатиперстной кишки, а у 35 больных (45,5%) выявлена более тяжелая, эрозивная форма воспалительного процесса, а именно: поверхностные эрозии с локализацией в желудке (11 детей – 31,4%), луковице двенадцатиперстной кишки (12 больных – 34,3%) и с сочетанной локализацией (12 детей – 34,3%). Следует отметить, что у всех детей гастродуоденит сочетался с проявлениями гастроэзофагеальной рефлюксной болезни. Установлено, что у 29 больных (37,7%) патология ВОПТ ассоциирована с Helicobacter pylori. Инфицированность Н.pylori чаще выявлялась у детей с эрозивным гастродуоденитом (ЭГД) по сравнению с поверхностным гастродуоденитом (ПГД) (48,57% и 28,57%) (?2 =3,84, p=0,050). Доля ЭГД+ГЭРБ в группе Н.pylori-позитивных больных составила 58,6%, что было достоверно выше доли ЭГД+ГЭРБ (37,5%) среди Н.pylori-негативных больных (p=0,04). При определении методом иммуноферментного анализа в крови суммарных антител в группе Н.pylori-положительных детей было выделено 2 подгруппы: Н.pylori-серопозитивных (1 подгруппа) и Н.pylori-серонегатив-ных (2 подгруппа) больных. В 1 подгруппу вошло 13 детей, что составило 16,9% от всех больных и 45,8% от всех Н.pylori-положительных больных. В 1 подгруппе доля ЭГДС+ГЭРБ составила 76,9%, что достоверно превысило долю ПГД+ГЭРБ (23,1%) (p=0,008). Во 2 подгруппе преобладали дети с ПГД+ГЭРБ (56,2%), в то время как на ЭГД+ГЭРБ приходилось 43,8%. Было установлено, что частота встречаемости эрозивной формы поражения эзофагогастродуоденальной области в 1 подгруппе была достоверно выше встречаемости ЭГД+ГЭРБ во 2 подгруппе (p=0,05). С учетом данных ИПП клиническая картина у H.pylori-положительных детей не отличалась от клинических проявлений заболевания у H.pylori-негативных пациентов (7,21±0,38 и 6,72±0,47 баллов соответственно) (p>0,05). Проведенное исследование гормонального статуса в группе у H.pylori-позитивных и H.pylori-негативных пациентов выявило статистически значимые различия со стороны тиреоидных гормонов в виде более низких значений общего трийодиронина у H.pylori-позитивных больных (p=0,014) (табл. 1). Также установлено, что в сравнении с группой контроля у H.pylori-положительных пациентов уровень инсулина и СТГ значительно ниже (p=0,049 и p=0,035 соответственно), а содержание кортизола и эстрадиола – существенно выше контрольных показателей (p=0,05 и p=0,046 соответственно) (табл. 1). Рассмотрены особенности изменений эндокринных факторов у H.pylori-положительных серопозитивных и H.pylori-положительных серонегативных пациентов. Выявлено, что у больных 1 подгруппы уровень кортизола и тестостерона был существенно выше, чем у детей 2 подгруппы и группы контроля (F=4,54; p=0,042 и F=4,77; p=0,038 соответственно) (табл. 2). Установлено, что значения инсулина у H.pylori-положительных серопозитивных пациентов были существенно ниже, чем в ГК и 2 подгруппе (p=0,025 и p=0,048 соответственно) (табл. 2). Что же касается H.pylori-положительных серонегативных больных, достоверных различий содержания гормонов в сравнении с группой контроля не найдено (p>0,05). Исследование не выявило статистически значимых изменений, связанных с фактором H.pylori-инфицированности, со стороны гастроинтестинальных гормонов (p>0,05). Установлена тенденция к более высокому содержанию ТТГ у H. pylori – положительных серопозитивных пациентов (0,05>p>0,10), что указывает на снижение протективного потенциала СО ВОПТ, так как известно, что повышенные концентрации ТТГ подавляют синтез мукополисахаридов и тем самым снижающего защитные свойства слизи [4]. Следовательно, полученные данные установили, что H.pylori-инфицированность сочетается с гормональным дисбалансом, проявляющимся в снижении трофического действия на СО ВОПТ таких анаболических гормонов, как инсулин и соматотропный гормон, и повышении агрессивного действия кортизола и тестостерона. Причем, эта закономерность выявлена у H.pylori-положительных серопозитивных пациентов. Снижение уровня инсулина у детей ОКГ, возможно, обусловлено участием нейромедиаторов в модуляции эндокринной функции поджелудочной железы и ингибирующим влиянием гормонов желудка на секрецию инсулина, приводящим к снижению его трофических эффектов и к потенцированию воспалительных изменений СО ВОПТ.
Таблица 1. Уровень гормонов у больных в зависимости от инфицированности Нelicobacter pylori.
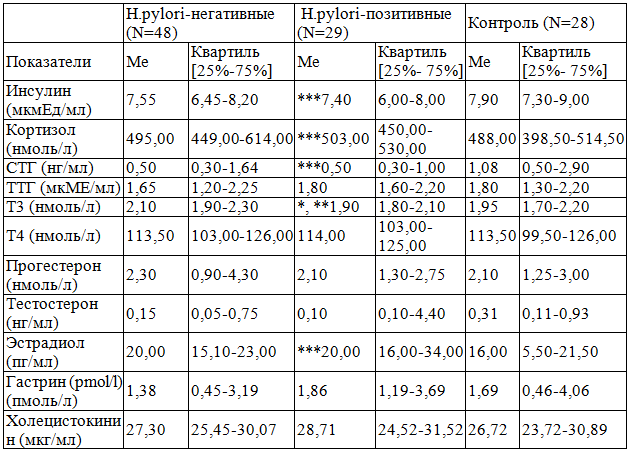
Примечания: СТГ – соматотропный гормон; ТТГ – тиреотропный гормон; Т3 – трийодтиронин общий; Т4 – тироксин общий.; N – количество больных; Ме-медиана; [25%-75%] – верхний и нижний квартили; p-значимость различия; * - различия статистически значимы при сравнении H.pylori-негативных и H.pylori-позитивных пациентов, p<0,05; ** - различия статистически значимы при сравнении H.pylori-негативных больных с контролем, p<0,05; *** - различия статистически значимы при сравнении H.pylori-позитивных больных с контролем, p<0,05.
Существуют исследования о взаимосвязи функции щитовидной железы и H.pylori-инфицированности [5]. Снижение уровня Т3 у H.pylori-положи-тельных детей может быть проявлением тиреоидной дисфункции на данном этапе онтогенеза. А так как гормоны щитовидной железы обладают гастроинтестинальными эффектами, то эти изменения могут приводить к нарушению секреторно-моторной функции органов пищеварения, прежде всего, желудка, и могут играть огромную роль в формировании патологии ВОПТ. Кроме того, тиреоидные гормоны, влияя на состояние СО желудка путем непосредственного воздействия на метаболические и регенераторные процессы и опосредованно – через взаимодействие с гастроинтестинальными гормонами и модулирование их эффектов, могут определять тяжесть течения КЗЗ. Также есть данные об участии гормонов щитовидной железы в нейроэндокринной регуляции иммунных процессов в желудке и опосредованном влиянии на состояние СО ВОПТ [6]. Повышенный уровень кортизола и тестостерона у H.pylori-положительных пациентов подтверждают факт реализации агрессивной функции указанных гормонов в повышенных концентрациях в отношении СО ВОПТ, что не противоречит результатам ранее проведенных исследований [7-9] и данным зарубежных исследований [10]. Кроме того, известно, что высокий уровень кортизола оказывает расслабляющее действие на сфинктерный аппарат гастродуоденальной области [4], в частности на кардиальный жом, что способствует формированию патологического гастроэзофагеального рефлюкса, который диагностирован у 100% наших пациентов.
Таблица 2. Уровень гормонов у Helicobacter pylori – положительных серопозитивных и Helicobacter pylori – положительных серонегативных больных.
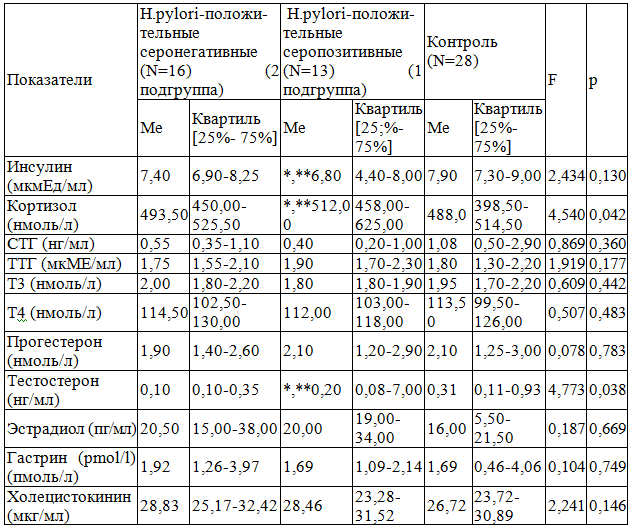
Примечание: * - различия статистически значимы при сравнении 1 подгруппы и группы контроля, p<0,05; ** - различия статистически значимы при сравнении 1 и 2 подгруппы, p<0,05.
Что же касается более высоких значений эстрадиола у H.pylori-положительных больных, целесообразно рассматривать этот результат исследования с точки зрения компенсаторной активации защитной функции эстрогенов в отношении СО ВОПТ при Н. pylori-ассоциированной патологии [11, 12].
Выводы. Установлено, что H.pylori-ассоциированная хроническая воспалительная патологии ВОПТ у детей в период становления пубертата сопряжена с более тяжёлыми (эрозивными) формами поражения СО эзофагогастродуоденальной области. Это состояние обусловлено формированием эндокринной дисрегуляции, связанной с фактором H.pylori-инфицированности и проявляющейся снижением трофических эффектов на желудочно-кишечный тракт со стороны анаболических гормонов (инсулина, соматотропного гормона), на фоне усиления «агрессивных» воздействий кортизола, тестостерона и ТТГ на СО ВОПТ, а также развитием дисфункции тиреоидных гормонов и компенсаторным усилением протективного эффекта эстрогенов. Поэтому важным аспектом в лечении H.pylori-ассоциированной хронической патологии ВОПТ у детей в период становления пубертата является эрадикационная терапия, не только устраняющая фактор инфекции, но и опосредованно уменьшающая гормональную дисрегуляцию и тем самым способствующая повышению трофического потенциала одних гормонов и снижению повреждающего воздействия на СО эзофагогастродуоденальной области других эндокринных факторов.
