Оксид азота (ОА) является аутокринным и паракринным медиатором, способным влиять на метаболические процессы в клетках. ОА, как мощный эндогенный вазодилататор, принимает участие в регуляции системного и легочного сосудистого сопротивления и коагуляции крови. Он функционирует в центральной и вегетативной нервной системе. По эфферентным нервам этот агент регулирует деятельность органов дыхательной системы, желудочно-кишечного тракта и мочеполовой системы. ОА подавляет пролиферацию гладкомышечных клеток сосудов, снижение его активности вызывает вазоконстрикцию и тромбоз. Реакция ОА с кислородом сопровождается образованием стабильных конечных продуктов - нитрита и нитрата, которые являются косвенными маркерами концентрации ОА в организме [1].
Негативное действие содержания ОА начинает проявляться, когда его суммарная концентрация либо резко снижается, либо возрастает, приводя к функциональному и структурному повреждению органа [2].
Первой заметной вехой в изучении ОА была работа П. Митчелла и соавторов в 1916 г. [3].
В последние годы значительно расширились представления о роли оксида азота (OА) и его метаболитов в различных физиологических и патологических процессах, в патогенезе различных заболеваний [4-8].
ОА управляет, как внутриклеточными, так и межклеточными процессами в живой клетке. Многие болезни - гипертония, ишемия миокарда, тромбозы, рак - вызваны нарушением физиологических процессов, которые регулирует ОА. Именно по этой причине ОА представляет огромный интерес для биологов и медиков самых разных специальностей. Интерес к ОА обусловлен, прежде всего, тем, что он вовлекается в регуляцию множества функций, включая сосудистый тонус, сердечную сократимость, агрегацию тромбоцитов, нейротрансмиссию, синтез аденозинтрифосфàта (АТФ) и белков, иммунную защиту. Кроме того, в зависимости от выбора молекулярной мишени и особенностей взаимодействия с ней, ОА оказывает и повреждающий эффект. В последние годы большое внимание уделяется анализу роли ОА в регуляции основных функций организма в норме и при патологии [9-14]. Так, результаты исследований, продемонстрированных в ряде работ, свидетельствуют о том, что ОА, супероксид и продукт их реакции – пероксинитрит, образующиеся при инфекционных заболеваниях, играют важную роль в патогенезе этих заболеваний, модифицируя белки и повреждая нуклеиновые кислоты. В условиях хронического воспаления, длящегося годами, эти эффекты способствуют мутагенезу и могут инициировать, таким образом, канцерогенез [15]. Возможно, механизм канцерогенного действия ОА связан с его влиянием на дифференцировку клеток. Выявлено, что ОА ингибирует дифференцировку человеческих К562 лейкемических клеток, вызванную противоопухолевыми препаратами (акларубицин, доксорубицин, масляная кислота) [16].
В другом исследовании не обнаружено количественных отличий между экспрессией ОА в нормальной слизистой желудка и в поврежденной слизистой раком желудка [17]. ОА, молекула со свойствами радикала, позволяет этому соединению, как активировать свободно-радикальные реакции, так и ингибировать их. ОА относится к факторам антимикробной защиты организма. Он уничтожает множество типов патогенных микроорганизмов (вирусы, бактерии, грибы, простейшие) или останавливает их рост. Бактериальные продукты (токсины) индуцируют в макрофагах синтез фактора некроза опухоли (ФНО), который индуцирует синтазу ОА [18].
Исследование ОА в крови, ограничивают полученную информацию о состоянии слизистой желудка, поскольку при ряде заболеваниях подобные сдвиги могут быть обусловлены многими факторами, наличием сопутствующей патологии других органов и систем организма [19].
В этой связи представляет значительный клинический интерес изучение уровня ОА в биоптатах слизистой оболочки желудка при заболеваниях верхнего отдела пищеварительного тракта (в том числе хеликобактер-ассоциированных заболеваний), возможности его определения в качестве маркёра для оценки активности воспалительного процесса в слизистой оболочки желудка (СОЖ).
Цель настоящей работы - изучить содержание ОА в биопсийном материале слизистой оболочки желудка пациентов с гастродуоденальной патологией ассоциированных с H.pylori. Оценить фенотип лимфоцитов в суспензии клеток биопсийного материала больных хроническими воспалительными заболеваниями гастродуоденальной области в период обострения.
Материалы и методы. Нами проводилась сравнительная характеристика обсеменения слизистой оболочки желудка (СОЖ) Н.pylori инфекцией, уровня ОА в биопсийном материале СОЖ у больных с гастродуоденальной патологией в разные стадии и фазы патологического процесса. Верификация состояния верхних отделов желудочно-кишечного тракта проводилась путем проведения эзофагогастродуоденоскопии при помощи эндоскопа «Evis 140» фирмы «Olympus» (Япония). Наличие осеменения Н.pylori инфекцией СОЖ определялось двойной методикой: тестом на уреазную активность с помощью Quck test (Финдляндия), а также гистоморфологическим методом. Гистологические срезы окрашивались гематоксилином и эозином по Романовскому-Гимза. Забор биопсийного материала проводился по общепринятой методике: 2 биоптата из антрального отдела, 2 биоптата из тела желудка. Ферментативную активность Н.рylori в биоптате определяли с помощью уреазного теста «H.pylori Quick Test» (Финляндия).Методом полимеразной цепной реакции (ПЦР) с использованием коммерческих наборов «Хеликопол», НПФ «Литех» (Россия) проводилось изучение участков генома H.рylori ( ice A1, BabA1 - генов). С использованием указанных наборов для ПЦР, суспензию клеток выделяли на градиенте плотности фиколл - урографин (с=1,077) и разделяли на субпопуляции CD4+, CD8+,CD25+ методом иммуномагнитной сепарации, реактивами фирмы «Dynal» (Норвегия). Содержание ОА в биопсийном материале слизистой желудка проводили спектрофотометрическим методом с использованием фотометра Spectroguant Nova 60, Германия.
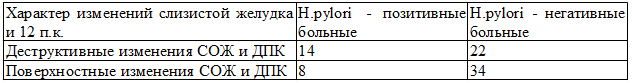
Обследовано 78 пациентов. Средний возраст 54,8±0,32. Мужчин было 30, женщин - 48. Все больные были разделены на две категории в зависимости от характера изменений СОЖ и двенадцатиперстной кишки (ДПК): с деструктивно-язвенными изменениями СОЖ и ДПК (острые, хронические эрозии желудка и ДПК, язва луковицы ДПК), с поверхностными изменениями СОЖ и ДПК. (поверхностный гастрит, очаговый атрофический гастрит, дуоденит) (табл. 1).
Таблица 1. Характер изменений слизистой оболочки желудка и двенадцатиперстной кишки в зависимости от инфицированности H.pylori
Статистическую обработку проводили при помощи программных пакетов Microsoft Excel XP. Вычисляли среднее арифметическое значение (М), ошибку среднего арифметического значения (m); различия между группами оценивали с помощью t-критерия Стьюдента, достоверными считались результаты при Р<0,05.
Результаты и обсуждение. Клиническая картина у наблюдаемых больных была полиморфной. Ведущими синдромами являлись: болевой, синдром диспепсических расстройств и астено-вегетативных нарушений. Ни один из выше перечисленных синдромов не встречался изолированно. Болевой синдром у большинства пациентов локализовался в эпигастральной, пилородуоденальной и околопупочной области. Содержание ОА в биоптатах СОЖ отражало локальный статус воспалительных процессов, являясь интегральным показателем отражающим снижение защитного действия оксида азота у инфицированных H.pylori больных. Полученные данные указывают на неоднородность содержания ОА в биоптатах СОЖ у инфицированных и неинфицированных больных H.pylori с различной патологией - деструктивно-язвенными изменениями и поверхностными изменениями СОЖ (табл. 2). Из данных табл. 2 следует, что у больных с деструктивными изменениями СОЖ, ассоциированные с Н.рylori, отмечено более выраженное повышение уровня ОА.
Таблица 2. Содержание оксида азота в биоптатах слизистой оболочки желудка у больных с гастродуоденальной патологией в зависимости от обсемененности Н.рylori (М±m) мг/л

Примечания: * - достоверность изменений р<0,01, ** - достоверность изменений р<0,001
ОА оказывают прямое цитотоксическое действие с повреждением эпителиоцитов СОЖ и ДПК в результате кислото-пептидной агрессии с развитием воспалительно - пролиферативных процессов, а также нарушением оксидантно - прооксидантного равновесия.
Определение дезоксирибонуклейновая кислоты (ДНК) Н.pylori в суспензии клеток биопсийного материала дало положительные результаты в группе больных с поверхностными изменениями СОЖ в 45,4% случаев, в группе больных с деструктивными изменениями в 70%. При этом, частота определения генов ice A1, BabA1 была выше в группе больных с деструктивными изменениями.
В субпопуляции CD4+/CD8+ фрагменты ice А1,Вab А1 обнаружены у 36,6% пациентов, причем одновременное нахождение этих генов в CD4/CD8 клетках было только у 27,2% пациентов с поверхностными изменениями СОЖ и у 30% с деструктивными изменениями. В суспензии клеток с фенотипом CD25+ обнаруживали, только фрагмент Bab1 у 45,4% пациентов с поверхностными изменениями СОЖ и у 50% с деструктивными изменениями. Одновременное присутствие фрагментов ice A1 и Bab A1 в CD4+, CD8+ и CD25+ наблюдалось у 27,2% пациентов с поверхностными изменениями СОЖ и у 30% с деструктивными изменениями.
Выводы. Уровень повышения ОА в биоптатах СОЖ у больных с деструктивными изменениями зависит от степени и характера воспалительных изменений, наличия инфекции H.pylori. ОА вовлекается в защиту организма на последних этапах иммунного ответа и образно рассматривается как "карающий меч" иммунной системы.
Однако, накапливаясь в клетке в неадекватно больших количествах, ОА оказывает и повреждающий эффект. Многочисленные наблюдения недавнего времени показали, что функциональный иммунитет к ряду микробных и вирусных инфекций регулируют CD4+CD25+ Т-лимфоциты [20,21]. Тper-клетки могут влиять на иммунную реактивность и течение микробной инфекции таким образом, что в некоторых случаях активность Тper не только подавляет иммунную патологию, но также влияет на иммунный ответ на патогены, предотвращая их элиминацию. Активированные Тper-клетки ограничивают силу иммунного ответа эффекторных Т-клеток, что делает их неспособными адекватно контролировать вирусную и микробную инфекции [22]. Нефагоцитирующие клетки CD4+, CD8+ могут являться носителями участков генома H.pylori. При этом часть из них является активированными клетками, экспрессирющими рецептор к интерлейкину-2 CD25+. Таким образом, повторные микробные инфекции могут усилить не только Т-клеточный иммунитет, генерируя Т-клетки памяти, но и супрессивную активность эндогенных CD4+CD25+ Трег-клеток.
