Введение. Известно, что гормон мелатонин образуется в клетках эпифиза из предшественника N–ацетилсеротонина. Секреция мелатонина происходит преимущественно в темное время суток, в утренние и дневные часы синтез гормона подавляется. Главный физиологический эффект мелатонина заключается в хронотропной активности, связанной с формированием основополагающего суточного биоритма [1]. Также данный гормон может оказывать влияние на иммунную систему, обладает антистрессовой активностью, антиопухолевым эффектом и антиоксидантным действием [2-4].Однако в настоящее время препараты мелатонина используются в медицине, в основном, как регуляторы цикла «сон-бодроствование».
В работе при лечении неалкогольного стеатогепатита (НАСГ) нами был использован препарат эпифамин, который относится к классу цитомединов и является пептидным биорегулятором, тропным к эпиталамо-эпифизарной области и способным обеспечивать коррекцию содержания мелатонина в организме. Первичный НАСГ наиболее часто ассоциирован с эндогенными нарушениями липидного и углеводного обмена и возникает у лиц больных сахарным диабетом 2 типа (СД2). При данном заболевании происходит повышение поступления свободных жирных кислот в печень и возрастание скорости синтеза липидов. Будучи высокореактогенными соединениями, свободные жирные кислоты являются субстратом пероксидного окисления липидов (ПОЛ) [5].
Одно из важнейших мест в антиоксидантной системе (АОС), обеспечивающей нейтрализацию процессов ПОЛ, занимает глутатионовая система. Восстановленный глутатион (GSH) и связанные с его превращениями ферменты – глутатионредуктаза (ГР: КФ 1.6.4.2) и глутатионпероксидаза (ГП: КФ 1.11.1.9), выполняют важную роль в защите организма от свободных радикалов. Данная ферментативная система обеспечивает детоксикацию Н2О2 и гидроперекисей с помощью GSH за счет действия глутатионпероксидазы (ГП). Действие ГП сопряжено с функционированием ГР, катализирующей восстановление глутатиона за счет НАДФН. Глутатионовая АОС включает также глутатион – S – трансферазы (ГSТ: КФ 2.5.1.18), которые предохраняют ДНК, митохондрии и другие жизненно важные компоненты клетки от токсикантов и таким образом значительно повышает устойчивость клетки и организма в целом [6].
Известно, что состояние синтезирующей функции печени оценивается по уровню активности сывороточной холинэстеразы (ХЭ КФ 3.1.1.8). Изменение активности ХЭ, является важным диагностическим показателем у больных с различными заболеваниями печени.
Целью работы стало исследование концентрации GSH и активностей ГП, ГР, GSТ, ХЭ в крови больных НАСГ, развивающемся при сахарном диабете 2 типа.
Материалы и методы. В клиническое исследование было включено 61 человек с неалкогольным гепатитом, развивающимся вследствие СД2. Из них 20 мужчин (32,8%) и 41 женщина (67,2%). Возраст больных составлял от 45 до 80 лет: средний возраст – 62,5±17,5 года. Средняя продолжительность заболеванием СД2 составила 3,3±8,7 лет. Диагноз неалкогольного стеатогепатита был поставлен на основании клинических признаков заболевания, биохимического исследования крови, данных ультразвукового исследования печени. Из сопутствующих заболеваний чаще всего регистрировались следующие: ожирение – 61 больной (100%), дислипидемия – 61 больной (100%), гипертоническая болезнь – 51 больной (83,6%), хроническая сердечная недостаточность – 42 больных (68,9%), хронический гастрит – 30 больных (49,2%).
Контрольную группу составили 65 практически здоровых лиц с нормальными показателями общего и биохимического анализов крови.
Критериями исключения из исследования явились: вирусные гепатиты, злокачественные новообразования, острый инфаркт миокарда, острое нарушение мозгового кровообращения.
Больные были разделены на 2 группы. Первая группа пациентов (33 человека) находилась на базисном лечении: сахароснижающая терапия (таблетированные препараты сульфонилмочевины и бигуаниды), гепатопротекторы: карсил (эквивалент силимарина 35 мг) по 2 таблетки 3 раза в день во время еды, эссливер форте (эссенциальные фосфолипиды 300 мг) по 2 таблетки 3 раза в день, антигипертензивная терапия (ингибиторы ангиотензинпревращающего фермента – эналаприл 10 мг) по 1 таблетке 1 раз в день, гиполипидемическая терапия (симвастатин 10 мг) по 1 таблетке 1 раз в день, в течение 10 дней. Вторая группа пациентов (28 человек) дополнительно к базисной терапии получала эпифамин (ООО «Клиника Института биорегуляции и геронтологии», Санкт-Петербург, Россия; удостоверение качества и безопасности №103, регистрационное удостоверение № 004471.Р.643.04.2003, биологически активная добавка) по 1 таблетке (10 мг) 3 раза в день за 10-15 минут до еды в течение 10 дней.
В ходе клинического исследования использовали сыворотку крови больных, находящихся на лечении в стационаре. Кровь для исследования забиралась в пробирки типа «вакутейнер» в утреннее время, натощак, из локтевой вены.
Концентрацию GSH определяли на спектрофотометре Hitachi U-1900 (Япония) с помощью реакции с 5,5 – дитио – бис – (2 – нитробензойной) кислотой, в результате которой образуется тионитрофенильный анион, имеющий максимум поглощения при 412 нм. Активность исследуемых ферментов определяли при 340 нм. За ферментативную единицу (Е) принимали количество фермента, катализирующее превращение микромоля субстрата за 1 мин при 250С. Активность ГР определяли в среде, содержащей 50 мМ калий-фосфатный буфер (pH 7,4), 1мМ ЭДТА, 0,16 мМ НАДФН и 0,8 мМ окисленного глутатиона. Измерение активности ГП проводили в 50 мМ калий-фосфатном буфере (pH 7,4), содержащем 1мМ ЭДТА, 0,12 мМ НАДФН, 0,85 мМ восстановленного глутатиона, 0,37 мМ Н2О2, 1 ед/мл ГР. Измерение активности ГSТ проводили в среде 0.1М калий– фосфатного буфера (рН 7.4), содержащем 1 мМ ЭДТА, 1мМ 1– хлор– 2,4– динитробензол, 5 мМ GSH. Общий белок определяли унифицированным методом по биуретовой реакции [7].
В ходе работы использовали набор реактивов для определения активности ХЭ (Bio-La-Test, Erba Lachema s.r.o., Чехия) НАДФН, трис–НСl–-буфер, ЭДТА («Reanal», Венгрия), глутатион окисленный и восстановленный, ферментный препарат ГР («ICN», США), остальные реактивы отечественного производства марки «хч» или «чда».
Статистическая обработка материала включала в себя использование стандартных методов вариационной статистики (расчет средних значений (М), ошибка средних значений (m), t–критерия Стьюдента) и непараметрического теста Вилкоксона с использованием прикладных программ «STATISTICA 6.0». Достоверными считались различия при р≤0.05.
Результаты и обсуждение. У больных с НАСГ содержание GSH в сыворотке крови было ниже в среднем в 1,9 (p<0,05) раза относительно контрольного уровня (Рис. 1). Это могло быть связано со значительным возрастанием расходования данного метаболита при интенсификации свободнорадикальных процессов. После проведения базисного лечения достоверных различий уровня GSH не наблюдалось. Комбинированная терапия с эпифамином приводила к повышению концентрация GSH в 1,2 раза по сравнению с данными, полученными до лечения, т.е. его уровень изменялся в сторону нормы (Рис. 1). Полученные данные согласуются с результатами, полученными нами при применении экзогенного мелатонина при экспериментальном гепатите у животных [8].
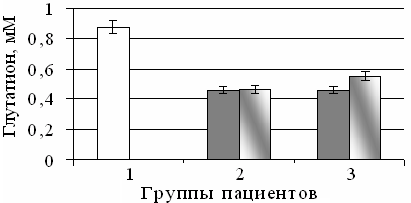
Рис. 1. Содержание восстановленного глутатиона в сыворотке крови пациентов контрольной группы (1), у больных с неалкогольным стеатогапатитом, развивающемся при сахарном диабете 2 типа (2), при комбинированной терапии с эпифамином (3): здесь и далее до лечения ( серый), после лечения ( серо-белый); достоверность значений (p) ≤ 0.05 (*) - по сравнению с нормой, (**) - по сравнению с патологией.
Активности ГП и ГР, выраженные в Е на мл сыворотки, в 1–ой группе больных НАСГ, развивающемся на фоне сахарного 2 типа, до назначения лечения увеличивались в среднем в 1,4 и 1,3 (p<0,05) раза соответственно по сравнению с контрольным уровнем (Таблица). Удельные активности ферментов повышались в 1,3 (p<0,05) и 1,1 (p<0,05) раза соответственно по сравнению с нормой (Таблица). Вероятно, стимуляция ГП/ГР-системы происходила в ответ на избыточное образование АФК при данной патологии. После проведения стандартного лечения активности ГП и ГР, выраженные в Е на мл, увеличивались в среднем в 1,2 (p<0,05) и 1,7 (p<0,05) раза соответственно по сравнению с результатами, полученными до базисного лечения (Таблица). Удельные активности ГП и ГР увеличивались в 1,1 (p<0,05) и 1,4 (p<0,05) соответственно (Таблица). Очевидно, возрастание активности ГП/ГР - системы было сопряжено с положительным действием базисного лечения на антиоксидантный статус больных.
Во 2-ой группе больных НАСГ до проведения терапии активности ГП и ГР, выраженные в Е на мл сыворотки, изменялись в тех же пределах, что и в 1-ой группе пациентов. После проведения комбинированной терапии с эпифамином, активности ГП и ГР, выраженные в Е на мл, увеличивались в 2,7 (p<0,05) и 2,1 (p<0,05) раза соответственно (Таблица), а удельные активности ферментов повышались в среднем в 1,7 (p<0,05) раза по сравнению с результатами до лечения (Таблица). Таким образом, в данной группе больных наблюдалось наибольшее повышение активности ГП/ГР системы. Полученные данные согласуются с предположениями о том, что антиоксидантная активность мелатонина может быть связана с его действием на антиоксидантные ферменты путем активации или стимуляции их синтеза [9].
Активность ГSТ, выраженная в Е на мл сыворотки крови, в 1-ой группе больных НАСГ до назначения базисного лечения уменьшалась в 1,9 (p<0,05) раза (Таблица), а удельная активность в 2,2 (p<0,05) раза (Рис. 4Б) по сравнению с контрольным уровнем. Очевидно, снижение активности ГSТ происходило в результате значительных затрат восстановленного глутатиона в ответ на избыточное образование АФК при развитии оксидативного стресса. Это предположение согласуется с полученными данными о повышении активности ГSТ на фоне возрастания уровня GSH после проведения лечения. Так, после базисной терапии наблюдалась тенденция к увеличению активности фермента, выраженной в Е на мл, и удельной активности в среднем в 1,1 (p<0.05) раза.
Во 2-ой группе больных НАСГ до проведения терапии активность ГSТ изменялась в тех же пределах, что и в 1-ой группе. После проведения комбинированного лечения с эпифамином активность данного фермента, выраженная в Е на мл, увеличивалась в 1,3 (p<0.05) раза (Таблица); удельная активность в 1,6 раза (табл. 1), по сравнению с результатами до лечения. Таким образом, лечение с эпифамином способствовало повышению активности ГSТ в большей степени, чем в первой группе больных.
Таблица 1. Активность ферментов глутатионовой антиоксидантной системы
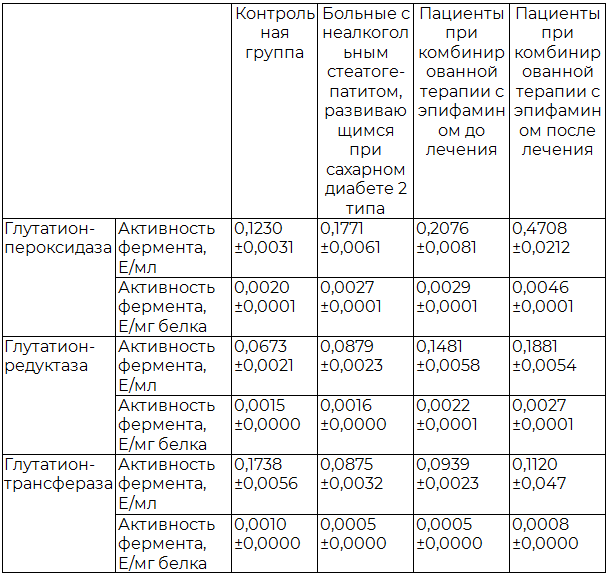
Примечание: достоверность значений (p) ≤ 0.05 .
Активность ХЭ в сыворотке крови больных НАСГ, развивающемся на фоне сахарного СД2 была увеличена в 2,2 (p<0,05) раза (Рис. 2) по сравнению с верхней границей нормы (76-230 мкат/л). Это согласуется с данными о возрастании активности фермента у больных СД2 с ожирением и нарушением липидного профиля [10, 11]. После проведения базисного лечения активность ХЭ изменялась в сторону нормы, снижаясь в 1,3 (p<0,05) раза (Рис. 2). После комбинированной терапии с эпифамином уровень активности ХЭ уменьшался в 1,6 (p<0,05) раза (Рис. 2). Скорее всего, данный эффект связан с гиполипидемическим и антиоксидантным действием мелатонина, уровень которого корригируется под влиянием эпифамина [12].
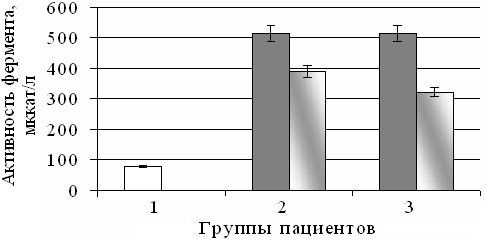
Рис. 2. Активность холинэстеразы в сыворотке крови пациентов контрольной группы (1), у больных с неалкогольным стеатогапатитом, развивающемся при сахарном диабете 2 типа (2), при комбинированной терапии с эпифамином (3).
Полученные данные свидетельствуют, что терапия с эпифамином способствовала более значительному повышению концентрации GSH, активностей ГР, ГП, ГSТ по сравнению с базисным лечением, по-видимому, за счет стимулирующего действия на АОС организма мелатонина, коррекция уровня которого происходила под действием данного препарата. Повышающаяся при данном заболевании активность ХЭ более существенно снижалась при комбинированном лечении с эпифамином, что, вероятно, было связано с положительным эффектом мелатонина на метаболизм липидов.
