Актуальность. Значимость инфекции Helicobacter pylori (HР) на сегодняшний день доказана в патогенезе хронического гастрита, язвенной болезни желудка и двенадцатиперстной кишки, MALT-лимфомы и некардиального рака желудка [13, 20]. Широкое распространение этой инфекции (распространенность хронического гастрита в мировой популяции охватывает от 50 до 80% взрослого населения) и связь с заболеваниями, опасными своими исходами (желудочно-кишечное кровотечение, рак желудка) ввели HР-ассоциированную патологию верхнего отдела желудочно-кишечного тракта в ранг социально значимой [6].
На сегодняшний день деятельность Российской гастроэнтерологической ассоциации путем проведения региональных и федеральных научных конференций, ряда важных клинических и эпидемиологических исследований способствовала широкому внедрению эрадикационной терапии в клиническую практику в России [4, 6]. Но, несмотря на очевидные успехи в области терапии HР-инфекции за счет широкого внедрения антисекреторной и антихеликобактерной терапии, данная проблема окончательно не решена [3].
Два с лишним десятилетия практического применения эрадикационной терапии и множество проведенных клинических исследований свидетельствуют об отсутствии гарантированного успеха вне зависимости от выбранной схемы терапии. Другими словами, лечение инфекции HР – относительно сложная задача ввиду отсутствия стопроцентных схем [6]. Интерес к проблеме недостаточной эффективности эрадикационных схем подчеркивается колоссальным числом публикаций, включающим на сегодняшний день более 100 мета-анализов контролируемых исследований, посвященных разным аспектам антихеликобактерной терапии. Наибольшее число мета-анализов (более 25) посвящено оценке эффективности схем первой линии, традиционно включающих ингибиторы протонной помпы (ИПП), кларитромицин и амоксициллин [14]. Этот интерес сегодня абсолютно понятен, так как за последние годы эффективность тройной эрадикационной терапии первой линии в силу разных причин прогрессивно снижается [19], уже давно не превышая рекомендованного Маастрихтскими соглашениями (Маастрихт III-2005, IV-2010) 80% уровня [22, 23]. Так, Graham D.Y., Fischbach L. отмечают, что лишь в 18% проанализированных исследований процент эрадикации НР превзошел 83%, а в 60% не удалось достичь 80%-ного порога успешной эрадикации [19].
Наиболее значимым фактором снижения эффективности тройной антихеликобактерной терапии первой линии является растущая резистентность HР к кларитромицину [16]. Известный ранее путь по увеличению эффективности тройной терапии путем увеличения длительности курса до 10–14 дней уже не работает, так как, по данным недавнего мета-анализа, этот шаг обеспечивает всего 3–5% преимущества при потенциально неблагоприятных фармакоэкономических показателях [18, 22].
По данным многочисленных исследований, для преодоления проблемы снижения эффективности антихеликобактерной терапии при хроническом НР-ассоциированном гастрите целесообразно включать в тройную схему эрадикации первой линии висмута трикалия дицитрат (Де-Нол), к которому не существует первичная и не развивается приобретенная устойчивость микроорганизма [7, 21].
По мнению P. Malfertheiner добавление висмута трикалия дицитрата к препаратам тройной схемы эрадикационной терапии первой линии позволяет добиваться нескольких значимых целей [21]:
- сохраняет высокие показатели эффективности антихеликобактерной терапии первой линии;
- преодолевает резистентность НР к кларитромицину у конкретного пациента;
- снижает распространенность в популяции не чувствительных к кларитромицину штаммов НР;
- компенсирует отсутствие новых антибактериальных препаратов с выраженной активностью в отношении НР.
Вместе с тем, безопасность использования висмута трикалия дицитрата показана как отечественными исследователями, так и данными мета-анализа, подтвердившего отсутствие значимых побочных эффектов у 4763 больных [2, 10, 17].
Цель исследования. Изучение динамики клинических проявлений диспепсии и морфологических изменений слизистой оболочки желудка (СОЖ) при хроническом НР-ассоциированном гастрите на фоне разных схем эрадикации.
Материалы и методы. В исследование включены 97 пациентов в возрасте от 20 до 65 лет (средний возраст 46,5±13,3 года), из них 62 (63,9%) женщины и 35 (36,1%) мужчин.
В соответствие с рекомендациями Российской Гастроэнтерологической Ассоциации по диагностике и лечению инфекции НР у взрослых и Европейскими рекомендациями – Маастрихт IV (Флоренция, 2010) при хроническом НР-ассоциированном гастрите назначалась схема эрадикационной терапии первой линии, включающая ИПП 20 мг 2 раза в день за 30 минут до еды, Амоксициллин 1000 мг 2 раза в день и Кларитромицин 500 мг 2 раза в день в течение 10 дней [4, 9, 22].
HР-позитивные пациенты (n=44, 45,4%) методом «лотерейной» рандомизации были разделены на две группы: в 1-ю группу вошли пациенты, которым назначалась схема эрадикационной терапии первой линии в течение 10 дней – 20 (45,5%) человек; во 2-ю группу были включены пациенты, которые кроме эрадикационной терапии первой линии, принимали Де-Нол в дозе 120 мг по 2 табл. 2 раза в день за 30 минут до еды в течение 4-х недель – 24 (54,5%) человека. Группу сравнения составили НР-негативные пациенты – 53 (54,6%) человека. Группы были сопоставимы по полу и возрасту.
Оценку клинических признаков основных вариантов синдрома диспепсии (ЭБС - эпигастрального болевого синдрома (боли в подложечной области) и ПДС - постпрандиального дистресс-синдрома (чувство переполнения, распирания, раннего насыщения, отрыжка воздухом)) определяли до и через 4 недели после окончания лечения хронического НР-ассоциированного гастрита.
Из инструментальных методов диагностики пациентам до и через 4 недели после окончания лечения проводилась ФЭГДС с биопсией СОЖ из пяти точек согласно современному подходу – модифицированному варианту OLGA system (Operative Link for Gastritis Assessment) – Российскому пересмотру классификации хронического гастрита, который был утвержден III Съездом Российского общества патологоанатомов [1, 24, 5]. Полученные при биопсии фрагменты слизистой оболочки желудка (2 – из тела, 2 – из антрального отдела желудка, 1 – из угла желудка) фиксировали в 10%-м нейтральном забуференном формалине (рН 7,2-7,4) в течение 12-24 часов и заливали в парафин по общепринятой методике. Парафиновые срезы толщиной 3-4 мкм окрашивали гематоксилином и эозином. Приготовление красителей, буферных растворов, постановку соответствующих контролей проводили по прописям, приведенным в соответствующих руководствах [11, 8]. В каждом из 5 биоптатов описывали основные патоморфологические изменения: хроническое воспаление (мононуклеарная воспалительная инфильтрация), активность воспаления (нейтрофильная инфильтрация), атрофию, степень обсемененности НР [1, 5, 15, 24]. В качестве градации использовались обозначения: 0 – отсутствие признака; 1 – слабая степень выраженности признака; 2 – умеренная; 3 – выраженная. В соответствии с рекомендациями Российской группы по изучению НР для идентификации инфекции использовали 2 диагностических метода: гистобактериоскопический с окраской 0,1%-м толуидиновым синим и быстрый уреазный тест.
Статистическую обработку данных проводили с помощью пакета Statistica 6,0 и Microsoft Excel. Результаты считались значимыми при р<0,05.
Результаты и обсуждение. На момент включения в исследование все пациенты хроническим НР-ассоциированном гастритом имели клинические признаки диспепсии. Анализ динамики основных синдромов диспепсии показал, что проведение эрадикационной терапии сопровождается редукцией клинических признаков диспепсии при хроническом НР-ассоциированном гастрите. Но эффективность антихеликобактерного лечения была наиболее высокой в купировании клинических симптомов диспепсии у пациентов 2-ой группы. Как видно из табл. 1, значимость различий в исследуемых группах (до и через 4 недели после лечения) является статистически значимой во 2-ой группе по всем клиническим признакам диспепсии: боль в подложечной области (Z=3,72 р=0,0002), раннее насыщение (Z=3,08 р=0,002), чувство переполнения в эпигастрии после еды (Z=2,50 р=0,012), отрыжка воздухом (Z=2,77 р=0,006), что свидетельствует о клинических преимуществах добавления Де-Нола к препаратам тройной терапии.
Таблица 1. Динамика выраженности клинических признаков диспепсии в группах исследования под влиянием эрадикационной терапии, М±s
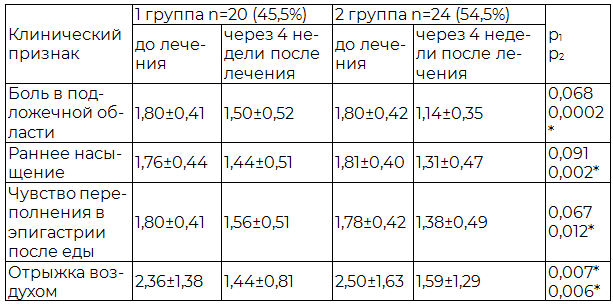
Примечание: р1 – сравнение клинических признаков 1-й группы до и после лечения (критерий Вилкоксона); р2 – сравнение клинических признаков 2-й группы до и после лечения (критерий Вилкоксона).
Таким образом, эрадикационная терапия обладает хорошей эффективностью в отношении купирования клинических симптомов диспепсии при хроническом НР-ассоциированном гастрите в обеих группах. Но клиническая эффективность антихеликобактерного лечения отличается при разных схемах эрадикации. Так, клинические симптомы диспепсии редуцируются наиболее полно у пациентов хроническим НР-ассоциированным гастритом под влиянием стандартной эрадикационной терапии первой линии, назначаемой совместно с Де-Нолом, чем у пациентов, получающих только эрадикационную терапию первой линии, что имеет статистическую достоверность (р<0,05).
Изменение показателей активности, воспаления и атрофии во всех отделах желудка под влиянием эрадикации в обеих группах показано в табл. 2, 3, 4.
Таблица 2. Полуколичественная характеристика морфологических признаков хронического гастрита в биоптатах антрального отдела до и после эрадикации (М±s)
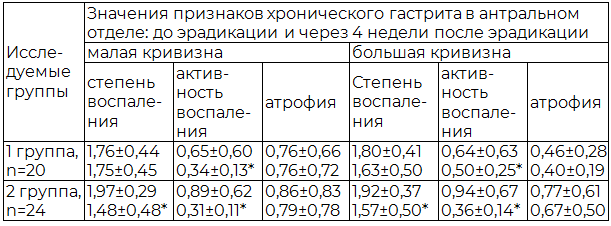
Примечание: здесь и далее *- р < 0,05 между показателями до и после эрадикации
Таблица 3. Полуколичественная характеристика морфологических признаков хронического гастрита в биоптатах угла желудка до и после эрадикации (М±s)
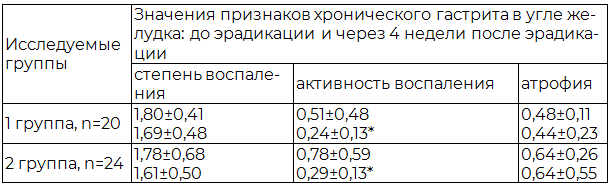
Таблица 4. Полуколичественная характеристика морфологических признаков хронического гастрита в биоптатах тела желудка до и после эрадикации (М±s)
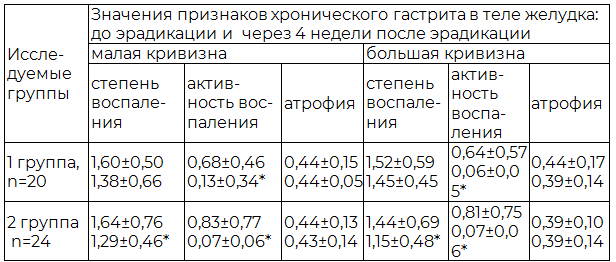
Установлено, что через 4 недели после успешной эрадикации НР в обеих группах имело место снижение таких морфологических показателей хронического гастрита как активность и степень воспаления, тогда как атрофические изменения СОЖ регрессу не подвергались. При этом наиболее значимым эффектом антихеликобактерной терапии в обеих группах являлось выраженное снижение активности воспаления в слизистой оболочке антрального отдела, угла и тела желудка (р<0,05). Это характеризовалось уменьшением инфильтрации эпителия и собственной пластинки слизистой оболочки полиморфно-ядерными лейкоцитами. Вместе с тем, в отношении показателя степени воспаления в двух исследуемых группах наблюдались различия. Так, у пациентов 2-й группы через 4 недели после эрадикационной терапии отмечалось достоверное (р<0,05) снижение степени воспаления в антральном отделе, угле и теле желудка в виде уменьшения плотности мононуклеарного инфильтрата приблизительно наполовину, тогда как статистически значимого изменения аналогичного показателя у пациентов 1-й группы обнаружено не было (р>0,05).
Регрессия морфологических признаков хронического гастрита во 2-й группе наиболее ярко проявлялась в антральном отделе – основном месте обитания НР, где отмечалась наибольшая разница между степенями воспаления и активности до и после эрадикации (табл. 2).
Таким образом, непосредственными эффектами эрадикации НР в отношении структурных изменений СОЖ при хроническом НР-ассоциированном гастрите является редукция воспалительных изменений: прежде всего, уменьшение активности гастрита (объема инфильтрации нейтрофилами), и выраженности воспаления (инфильтрации мононуклеарами).
Эрадикационная терапии первой линии совместно с Де-Нолом оказала наиболее благоприятный эффект на выраженность и активность воспаления как в антральном отделе, так и в угле и теле желудка. Уже на ранних стадиях постэрадикационного периода (через 4 недели после эрадикации НР) у этих пациентов отмечено более быстрое (по сравнению со схемой эрадикации тройной терапии без Де-Нола) снижение плотности мононуклеарной воспалительной инфильтрации собственной пластинки СОЖ. Полученный результат свидетельствует о том, что добавление Де-Нола к эрадикационной терапии первой линии статистически значимо (р<0,05) снижает не только активность, но и степень воспаления в антральном отделе, угле и теле желудка.
Через месяц после антихеликобактерной терапии первой линии без Де-Нола также отмечалась тенденция к уменьшению активности и выраженности воспаления в СОЖ. Однако, у лиц, не получавших Де-Нол в схеме эрадикации первой линии, было отмечено снижение, прежде всего, активности гастрита при достоверно более низких темпах редукции мононуклеарной воспалительной инфильтрации, чем у лиц при аналогичной терапии с Де-Нолом. Это свидетельствует о персистенции воспалительного инфильтрата в условиях элиминации инфекта и, следовательно, о сохранении риска опосредованного через цитокины повреждения СОЖ, что служит фактором риска развития рака желудка и согласуется с данными других исследователей [1, 2, 7, 22].
Таким образом, у больных хроническим НР-ассоциированным гастритом эрадикационная терапия первой линии с добавлением Де-Нола оказала благоприятный эффект на выраженность признаков воспаления в СОЖ, что обусловлено положительными свойствами Де-Нола на активность воспалительного процесса, а именно снижение содержания провоспалительных цитокинов в СОЖ и наличие антиоксидантного эффекта [2, 7, 9, 10, 12, 15, 22].
На фоне эрадикационной терапии в обеих группах атрофические изменения СОЖ регрессу не подвергались. Очевидно, что вопрос о стадии атрофии СОЖ при массивной мононуклеарной инфильтрации собственной пластинки решать затруднительно сразу после эрадикации инфекта, обеспечивающей некоторую редукцию инфильтрата, тем более что атрофические изменения могут быть мозаичными. Учитывая анализ данных литературы, истинную оценку о наличие или отсутствии атрофических изменений СОЖ можно будет давать через достаточно продолжительное время после эрадикации инфекта – НР, по мере снижения мононуклеарной инфильтрации собственной пластинки слизистой оболочки.
Выводы
1. Клинические симптомы диспепсии редуцируются наиболее полно у пациентов хроническим НР-ассоциированным гастритом под влиянием стандартной эрадикационной терапии первой линии, назначаемой совместно с Де-Нолом, чем у пациентов, получающих только эрадикационную терапию первой линии.
2. Эрадикационная терапия первой линии, назначаемая совместно с Де-Нолом, снижает не только активность, но и степень воспаления в антральном отделе, угле и теле желудка, что позволяет достичь более быстрой редукции морфологических изменений СОЖ и замедлить прогрессирование гастрита.
