Желчнокаменная болезнь выявлена у 5-25% населения России, причем в возрасте 40-45 лет составляет 20-25% у женщин и 5 % у мужчин. В возрасте 50-60 лет у 20% женщин и у 15% мужчин и в возрасте 60-65 лет у 35% женщин и 10% мужчин [4-6].
В последнее время в печати активно обсуждается вопрос о связи Helicobacter pylori не только с заболеваниями гастро-дуоденального отдела желудочно-кишечного тракта, но и с заболеваниями гепатобилиарной системы.
В настоящее время особый интерес представляют роль H.pylori в развитии хронических заболеваний желчевыводящих путей. Определенные факторы колонизации, устойчивости к действию желчных кислот штаммов Н. pylori участвуют в поддержании хронического воспаления желчевыводящих путей, чему могут способствовать определенные факторы патогенности бактерий [1,2]. Установлено, что H.pylori колонизирует преимущественно апикальную часть железистого эпителия желчного пузыря [2,3].
В колонизации желчных путей патогенетическое значение имеют штаммы H.pylori cagA, bagA - негативные, vacA-позитивные, но отличающиеся преобладанием m2 аллельного варианта, имеющего незначительный уровень токсической активности [2,3]. ДНК хеликобактеров была обнаружена у китайцев с желчнокаменной болезнью [4,5]. При обследовании двух популяций с высоким риском развития рака желчного пузыря и желчных путей - жителей Японии и Тайланда, установлена ассоциация между обнаружением H. bilis в желчи и развитием злокачественных опухолей [6]. В последнее время имеются многочисленные сообщения об обнаружении ДНК хеликобактеров в органах гепатобилиарной системы при различных патологиях [2,3,7-12]. Выявление корреляции между присутствием ДНК хеликобактеров и повышением клеточной пролиферации желчного эпителия демонстрирует высокую вероятность участия этих микроорганизмов в генезе гепатобиллиарного рака [13,14]. Необходимость профилактической эрадикации хеликобактерной инфекции понимается в результате того, что цирроз печени коррелирует с язвенной болезнью желудка и двенадцатиперстной кишки, ассоциированной с НР- инфекцией [3, 13,14].
Обнаружение Helicobacter pylori при хронических заболеваниях желчевыводящих путей [2,3], представляет интерес для определения лечебной тактики при желчнокаменной болезни. Инфицирование геликобактериозом желчевыводящих путей может осуществляться 2 путями: восходящим путём из двенадцатиперстной кишки; через сосудистое русло при бактериемии. H.pylori выделяется в 80% случаев в желудочных биоптатах, и в 58% случаев в биоптатах печени при различных заболеваниях гепатоцеллюлярной зоны [2,3]. Многочисленные исследования подтверждают, что не только внежелудочные или энтеропатогенные хеликобактеры освоили в качестве экологической ниши ткани печени и желчного пузыря, но и желудочные, главным из которых остаётся H. pylori [2,3]. Помимо H.pylori в желчи больных с патологией билиарной системы обнаруживаются патогенные (сальмонеллы, лептоспиры и др.) и условно-патогенные (кишечная палочка, клебсиеллы, протей, энтеробактер, стафилококки, энтерококки и др.) бактерии, вирусы гепатита А, грибы рода Кандида, возбудители протозойных и глистных инвазий [3]. Известно, что после выполнения холецистэктомии встречаются многочисленные проблемы, как ранние, так и поздние, связанные с послеоперационными осложнениями. К наиболее типичным осложнениям следует отнести различные склеротические процессы в желчных протоках и зоне сфинктера Одди, нарушение моторики в гастродуоденальной зоне, вторичные поражения поджелудочной железы и печени и т.д. Все указанные процессы, несомненно, снижают качество жизни пациентов после холецистэктомии. Вместе с тем роль H.pylori в развитии осложнений желчнокаменной болезни практически не изучена. Дальнейшие исследования данной проблемы могут открыть возможные пути лечения и профилактики воспалительных процессов в желчевыводящих путях.
Полимеразная цепная реакция (ПЦР) предназначена для качественного обнаружения ДНК Helicobacter pylori в биологических образцах (биоптаты антрального отдела желудка, биоптаты двенадцатиперстной кишки, биоптаты десен, мазки из зубодесневого кармана, слюна.) [2,3]. Данный метод позволяет оценить генотипические и фенотипические характеристики возбудителя [2,3]. Почти у каждого пациента имеется уникальный штамм Helicobacter pylori [3,4] . Существует ряд генов, продукты которых - белки Cag A, Vac A, Ice A, Bab A - полагают факторами патогенности[7,9]. В зависимости от их наличия выделяютдва типа штаммов Helicobacter pylori. ПЦР представляет собой многократно повторяющиеся циклы синтеза специфической области ДНК-мишени в присутствии термостабильной ДНК-полимеразы, дезоксинуклеотидтрифосфатов, соответствующего солевого буфера и олигонуклеотидных затравок-праймеров, которые определяют границы амплифицируемого участка. Цикл состоит из трех стадий с различными температурными режимами. На первой стадии при +940С происходит разделение цепей ДНК На второй стадии при +560С - +600C - присоединение праймеров к комплементарным последовательностям на ДНК-мишени. В завершении на 3 стадии при температуре +720C протекает синтез новых цепей ДНК путем достраивания цепей праймеров в направлении 5‘ -3‘ . В каждом цикле происходит удвоение числа копий амплифицируемого участка, что позволяет за 25-40 циклов наработать фрагмент ДНК, ограниченный парой выбранных праймеров, в количестве, достаточном для ее детекции с помощью электрофореза или альтернативными ему технологиями.
Таким образом, методика ПЦР включает в себя:
- Выделение ДНК из клинического образца;
- Амплификация специфических фрагментов ДНК;
- Детекция продуктов амплификации.
Метод полимеразной цепной реакции в средах позволяет идентифицировать Helicobacter pylori без выделения чистой культуры по присутствующим в исследуемом материале фрагментам его генома [9,12].
Цель исследования: определение инфицирования слизистой желчного пузыря с помощью метода полимеразной цепной реакции у больных, страдающих различными вариантами течения желчнокаменной болезнью (ЖКБ) после выполнения холецистэктомии.
Материалы и методы. Клиническую группу составили женщины (n=75) в возрасте от 30 до 50 лет, страдающие различными вариантами течения ЖКБ (ЖКБ с острым калькулезным холециститом (n=25), ЖКБ с хроническим калькулезным холециститом в стадию ремиссии (n=25), ЖКБ с хроническим калькулезным холециститом в стадию обострения (n=25). Всем пациентам выполнялась стандартная методика лапароскопической холецистэктомии.
Исследование на НР проводилось при помощи полимеразной цепной реакции биоптатов слизистой желчного пузыря. Статистический анализ полученных данных проводился при помощи критерия χ2.
Результаты и обсуждение. По результатам исследования ДНК возбудителя выявлено у пациентов с ЖКБ, острым калькулезным холециститом в 8 случаях, что составило 32% от количества больных с острым холециститом и 10,7% среди всех пациентов с желчнокаменной болезнью; у пациентов с ЖКБ, хроническим калькулезным холециститом в стадии обострения ДНК НР выявлен у 3 пациентов, что составило 12% внутри группы и 4% среди всех исследуемых, у пациентов с ЖКБ хроническим калькулезным холециститом в стадии ремиссии ДНК возбудителя в слизистой оболочке не выявлен.
При оценке критерия χ2 у пациентов с желчнокаменной болезнью получены следующие данные (табл. 1).
Таблица 1. χ2 у пациентов с желчнокаменной болезнью
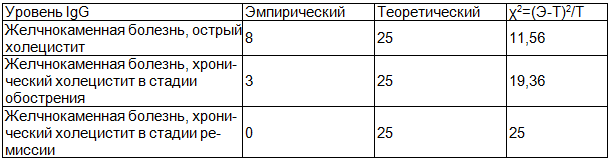
∑χ2=55,92. Находим критическое значение критерия по таблице критических значений. Для этого нам понадобится число степеней свободы (df). Df=3-1=2. Для вероятности ошибки p≤0,05 и df=2 критическое значение χ2=6,0.
Полученное эмпирическое значение больше критического - различия частот достоверны (χ2=55,92 p≤0,05). Следовательно, в данном случае можно говорить о достоверности полученных значений.
При оценке критерия χ2 у пациентов с желчнокаменной болезнью, острым холециститом получены следующие данные (табл. 2).
Таблица 2. χ2 у пациентов с желчнокаменной болезнью, острым холециститом

∑χ2=14,12. Находим критическое значение критерия по таблице критических значений. Для этого нам понадобится число степеней свободы (df). Df=2-1=1. Для вероятности ошибки p≤0,05 и df=1 критическое значение χ2=3,8.
Полученное эмпирическое значение больше критического - различия частот достоверны (χ2=14,12 p≤0,05). Следовательно, в данном случае можно говорить о достоверности полученных значений.
При оценке критерия χ2 у пациентов с желчнокаменной болезнью, хроническим калькулёзным холециститом в стадии обострения получены следующие данные (табл. 3).
Таблица 3. χ2 у пациентов с желчнокаменной болезнью, хроническим калькулёзным холециститом в стадии обострения

∑χ2=19,72. Находим критическое значение критерия по таблице критических значений. Для этого нам понадобится число степеней свободы (df). Df=2-1=1. Для вероятности ошибки p≤0,05 и df=1 критическое значение χ2=3,8.
Полученное эмпирическое значение больше критического - различия частот достоверны (χ2=19,72 p≤0,05). Следовательно, в данном случае можно говорить о достоверности полученных значений.
При оценке критерия χ2 у пациентов с желчнокаменной болезнью, хроническим калькулёзным холециститом в стадии ремиссии получены следующие данные (табл. 4).
Таблица 4. χ2 у пациентов с желчнокаменной болезнью, хроническим калькулёзным холециститом в стадии ремиссии

∑χ2=25. Находим критическое значение критерия по таблице критических значений. Для этого нам понадобится число степеней свободы (df). Df=2-1=1. Для вероятности ошибки p≤0,05 и df=1 критическое значение хи-квадрат=3,8.
Полученное эмпирическое значение больше критического - различия частот достоверны (–=25 p≤0,05). Следовательно, в данном случае можно говорить о достоверности полученных значений.
Полученные результаты говорят о присутствии ДНК Helicobacter pylori у пациентов с желчнокаменной болезнью. Отмечено, что в группе пациентов с острым калькулёзным холециститом у наибольшего количества исследуемых отмечается присутствие ДНК возбудителя. В группе хронического калькулёзного холецистита в стадии обострения у ряда пациентов также наблюдается ДНК возбудителя. Однако у пациентов с хроническим калькулёзным холециститом в стадии ремиссии ДНК возбудителя выявить не удалось. Если посмотреть результаты полученные другими исследователями со всего мира, то тут эта ситуация выглядит следующим образом. В исследовании тканей желчного пузыря, полученных от 68 пациентов при холецистэктомии (Турия 2008), ДНК H.pylori была обнаружена в 15 образцах (22%) [2-4]. В более ранних исследованиях, проведенных в Германии [3-7] и Мексике [4,5,7], сообщается о неудачных попытках обнаружения хеликобактерной ДНК в желчи и слизистой оболочке желчного пузыря при заболеваниях билиарного тракта. При исследовании, проводимом в Южной Корее с участием 43 пациентов ни в одном случае с помощью ПЦР не удалось выявить ДНК H.pylori ни в желчи, ни в тканях желчного пузыря [2,3]. В исследовании Каragin P. (2010) только у 7 из 100 больных хроническим и острым холециститом была обнаружена ДНК Helicobacter, при этом в шести случаях секвенирование доказало принадлежность ДНК H.pullorum и только в одном случае - H.pylori [5].
Полученные результаты, говорят о присутствии ДНК Helicobacter pylori у пациентов с желчнокаменной болезнью. Отмечено, что в группе пациентов с острым калькулёзным холециститом у наибольшего количества исследуемых отмечается присутствие ДНК возбудителя. В группе хронического калькулёзного холецистита в стадии обострения у ряда пациентов также наблюдается ДНК возбудителя. Однако у пациентов с хроническим калькулёзным холециститом в стадии ремиссии ДНК возбудителя выявить не удалось. Полученные данные позволяют говорить, что Helicobacter pylori занимает определенное значение в патогенезе желчнокаменной болезни. Данное исследование несет, несомненно, большое значение в профилактике осложнений желчнокаменной болезни.
Выводы:
- У больных, страдающих ЖКБ выявлено ДНК Helicobacter pylori.
- ДНК возбудителя в группе с острым калькулезным холециститом отмечается у 8 пациентов (32% p≤0,05) .
- В стадию обострения у больных, страдающих ЖКБ осложненной хроническим калькулезным холециститом выявлено ДНК Helicobacter pylori у 3 пациентов (12% p≤0,05).
