Язвенный колит (ЯК) - распространенное заболевание, причем наблюдается тенденция к ежегодному увеличению случаев выявления, преимущественно поражаются лица молодого и трудоспособного возраста [1]. Пик заболеваемости приходится на возрастной период 20-40 лет [5, 6].
Распространенность язвенного колита в индустриально развитых странах в последние десятилетия приобрела характер почти эпидемии [9].
Так, в США она составляет 116 на 100000 населения, в Италии - 121, в Канаде 37,2; частота выявления новых случаев ЯК в Северной Америке и Северной Европе колеблется от 3 до 15 наблюдений на 100000 населения в год. В Сибири ЯК встречается в 4-20 случаях на 100000 населения. В Канаде наблюдается самая высокая заболеваемость воспалительными заболеваниями кишечника, ими страдает около 0,5 % всего населения. В Москве заболеваемость ЯК составляет от 20,1 до 20,6 на 10000 жителей [1].
Люди с белым цветом кожи болеют язвенным колитом в 1,5-5 раз чаще. Низкая заболеваемость ЯК отмечается в Азии, Японии, Южной Америке. Эта тенденция сохраняется уже в течение последних 40 лет. Риск развития ЯК у мужчин после 40 лет превышает таковой по сравнению с женщинами в 2 раза.
Этиология язвенного колита до сих пор неизвестна.
- заболевание вызывается экзогенными факторами и основной причиной считается инфекция;
- ЯК является аутоиммунным заболеванием;
- это заболевание обусловлено дисбалансом иммунной системы желудочно-кишечного тракта.
- Обсуждаются 3 основных концепции:
При этом одним из важных факторов, осложняющих течение язвенного колита является микрофлора, которая может влиять на процесс обострения заболевания.
Базисные препараты включают аминосалицилаты (5-аминосалициловая кислота, салофальк, сульфасалазин, пентаса), кортикостероиды и иммунодепрессанты.
С целью уменьшения воспаления назначают антибактериальные препараты. Рекомендуется назначение метронидазола с фторхинолонами, цефалоспорины 3-4 поколений антибактериальные химиопрепараты [1-4].
При воспалительных заболеваниях кишечника у больных потеряна иммунологическая толерантность к бактериям, населяющим желудочно-кишечный тракт [7, 9]. При неэффективности консервативной терапии или развитии осложнений заболевания, оперативные вмешательства при ЯК выполняются у 10-20 % пациентов, летальность достигает 12-50 % [1].
При развитии ЯК нарушается барьерная функция слизистой оболочки кишечника, при этом бактериальные агенты могут проникать в глубокие ткани кишки - запуская каскад воспалительных и иммунных реакций. Нарушение целостности слизистой оболочки толстой кишки создает благоприятные условия для обсеменения транзиторной микрофлорой пораженного участка [8].
Микроорганизмы, находящиеся в слизистой оболочке и на поверхности язвенно-некротических образований, принимают непосредственное участие в развитии обострений ЯК.
В настоящее время отсутствует единое мнение о применении антибактериальной терапии у пациентов с ЯК. Применение цефалоспоринов 3 поколения способствует селекции штаммов энтеробактерий, продуцирующих бета-лактамазы расширенного спектра действия (БЛРС).
Отсутствие единого мнения о применении антибактериальной терапии, данных о роли условно - патогенной флоры в воспалительных процессах толстой кишки создает трудности в определении показаний к назначению антибиотиков у пациентов с ЯК.
В связи с этим целесообразно проанализировать качественный состав микрофлоры, выделенной из биопсийного материала у пациентов с ЯК, полученного из участков поражения слизистой оболочки толстой кишки.
Цель. Улучшение результатов лечения пациентов с язвенным колитом за счет микробиологического мониторинга и подбора эффективных схем эрадикационной терапии.
Материалы и методы. В работе было обследовано 15 пациентов с язвенным колитом в возрасте от 28 до 61 года, которые находились на стационарном лечении в отделениях колопроктологии и гастроэнтерологии Клиник СамГМУ с января по июль 2016 г. Мужчин было 7 (46,6%), женщин 8 (53,4%). Распределение пациентов по возрасту и полу представлено в табл. 1.
Таблица 1. Распределение больных ЯК (n=15) по возрасту и полу
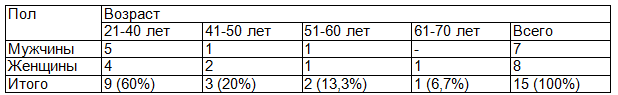
Всем больным выполнялись стандартные клинические и лабораторные исследования, ирригоскопия, ректороманоскопия, фиброколоноскопия с биопсией.
Критерии, по которым оценивали тяжесть язвенного колита, показаны в табл. 2.
Таблица 2. Оценка тяжести ЯК
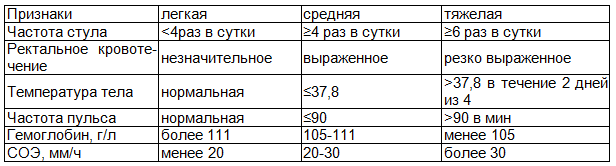
Примечание: СОЭ - скорость оседания эритроцитов.
Легкая форма ЯК была у 2 (13,3 %) пациентов, среднетяжелая у 8 (53,3%), тяжелая у 5 (33,3%) [2,12]. Распределение пациентов по степени тяжести язвенного колита продемонстрировано в табл. 3.
Таблица 3. Распределение больных ЯК (n=15) по степени тяжести заболевания
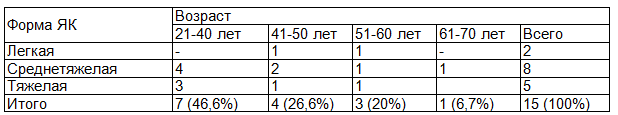
Дистальный колит выявлен у 5 (33,3 %), субтотальный у 4 (26,6 %), тотальный у 6 (40 %) больных. Внекишечные проявления ЯК у пациентов не выявлены. Сопутствующие заболевания выявлены у 9 (60 %): гипертоническая болезнь - у 2, ишемическая болезнь сердца - у 2, дисциркуляторная энцефалопатия у 1, рефлюкс эзофагит у 1. Анемия средней степени тяжести диагностирована у 2 пациентов, легкой степени тяжести у 1.
Терапия включала базисные препараты, содержащие 5-AСК (5- аминосалициловую кислоту), фолиевую кислоту; стероидные гормоны (преднизолон, гидрокортизон) и симптоматические средства (спазмолитики - папаверин, но-шпа).
При среднетяжелой и тяжелой формах ЯК назначали инфузионную терапию, аминокислоты, хлористый калий, витамины группы B, гемостатические препараты, парентеральное питание и антибактериальную терапию (ципрофлоксацин, цефалоспорины III поколения и метронидазол), поскольку при воспалении развивается дисбиоз и нарушается барьерная функция толстой кишки.
У всех пациентов забор материала осуществлялся до начала лечения.
Сбор материала проводили в соответствии с методическими указаниями МУ 4.2.2039-05 «Техника сбора и транспортирования биоматералов в микробиологические лаборатории». Собирался биопсийный материал язвенных поражений слизистой оболочки толстой кишки во время фиброколоноскопии и ректороманоскопии.
Биопсийный материал гомогенизировали механически, растирая биоптат в стерильных пробирках в физиологическом растворе. Полученный гомогенизат высевали на плотные питательные среды: кровяной агар, универсальные хромогенные среды, агар Сабуро.
Выделенные культуры идентифицировали с использованием MALDI-TOF масс-спектрометрии. У всех выделенных культур определяли антибиотикорезистентность диско-диффузионным методом в соответствии с методическими указаниями МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам».
У всех энтеробактерий дополнительно определяли фенотипы продукции БЛРС (бета-лактамазы расширенного спектра действия) методом двойных дисков с цефалоспоринами III поколения и амоксициллином/клавулановой кислотой.
Результаты. Из биопсийного материала от 15 пациентов было выделено и идентифицировано 33 штамма микроорганизмов: 21 штамм из семейства Enterobacteriaceae, 1 штамм из группы грамотрицательных неферментирующих бактерий, 11 штаммов из рода Enterococcus. Видовой состав выделенных микроорганизмов представлен в табл. 4.
Таблица 4. Видовой состав микрофлоры, выделенной из биопсийного материала от пациентов с ЯК (n=33)
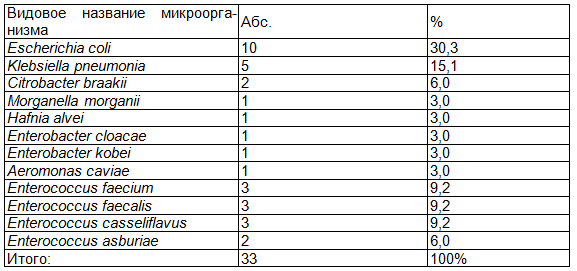
У 4 пациентов (26,8 %) микроорганизмы были выделены в монокультуре, у 3 пациентов (20,0 %) было выделено 3 микроорганизма; 2, 4 и 5 культур микроорганизмов было выделено у 2 пациентов соответственно (по 13,3 %). Роста микрофлоры не было выделено из 2 проб биопсийного материала (13,3 % пациентов).
18 штаммов было выделено в титре 105 КОЕ (колониеобразующих единиц) в биоптате, 3 штамма - в титре 106 КОЕ в биоптате, 5 штаммов - в титре 104 КОЕ в биоптате, 7 штаммов - в титре 103 КОЕ в биоптате.
E.coli была выделена в монокультуре у 2 пациентов, при этом у одного из них был выделен штамм с мукойдным фенотипом. Другие представители семейства Enterobacteriaceae были выделены в ассоциациях с энтерококками и другими энтеробактериями.
Кроме E. coli в монокультуре был выделен E. casseliflavus. Остальные энтерококки были выделены в ассоциациях с энтеробактериями и энтерококками других видов.
У всех выделенных штаммов была определена резистентность к антибактериальным препаратам. 2 штамма E. coli (20,0 %) оказались резистентными к ампициллину и фторхинолонам. 1 (10,0 %) штамм проявил фенотип продуцента БЛРС. У остальных 7 (70,0 %) штаммов E.coli не было выявлено признаков резистентности к тестируемым антимикробным препаратам.
Из 5 штаммов K. pneumoniae продуцентом БЛРС оказался 1 штамм (20 %), у остальных штаммов не было выявлено резистентности к тестируемым препаратам.
Другие энтеробактерии, выделенные из биопсийного материала не проявляли признаков приобретенной антибиотикорезистентности. Тем не менее следует учитывать особенности природной резистентности у E. cloacae, H. alvei к ампициллину, амоксициллин/клавуланату, цефазолину и цефокситину; у M. morganii к ампициллину, амоксициллин/клавуланату, цефазолину, цефуроксиму, тетрациклину, полимиксину B, колистину и нитрофурантоину.
Все представители рода Klebsiella обладают природной резистентностью к ампициллину, тикарциллину и пиперациллину.
Среди энтерококков не было выделено штаммов, резистентных к ванкомицину. Все штаммы сохраняли чувствительность к основным группам препаратов.
Обсуждение. Выделение микроорганизмов из группы энтеробактерий или энтерококков в биопсийном материале у пациентов с ЯК является косвенным фактом участия их в патологическом процессе в слизистой оболочке толстой кишки.
Особенно это имеет значение в случае выделения микроорганизмов в монокультуре, или в ассоциациях из близкородственных видов.
Количественная характеристика в титрах 104 и более для условно патогенных бактерий является отклонением от нормы при обследовании каловых масс на дисбактериоз кишечника [10].
Таким образом, выделение энтеробактерий из биопсийного материала в указанных титрах требует назначение антибактериальной терапии даже в случае возможной контаминации биоптата кишечным содержимым.
Значительное биологическое разнообразие видов условно патогенных энтеробактерий требует от врачей - бактериологов обязательного определения видового положения выделенных микроорганизмов, что обусловлено значительным разнообразием механизмов природной и приобретенной резистентности к основным группам препаратов, применяемых для лечения бактериальных осложнений у пациентов с ЯК.
Следует отдельно отметить разнообразие видов энтерококков, выделенных из биопсийного материала от пациентов с ЯК. Особенно выделение «редких» видов.
По данным литературы этиологическая структура энтерококковых инфекций характеризуется преобладанием E. faecalis (80 - 90 %) и E. faecium (10 - 15 %) [8]. Остальные энтерококки составляют менее 5 % от всех случаев участия их в патологических процессах.
Важность детального исследования видового состава энтерококков у пациентов с ЯК обусловлена высокими рисками распространения их во внутрибольничной среде и формирования множественной лекарственной устойчивости [11].
Выводы
- Значительное видовое разнообразие микрофлоры, выделяемой из биопсийного материала, требует точной идентификации и разработки стандартных процедур выделения микроорганизмов из биоптатов у пациентов с язвенным колитом.
- Разработка индивидуальных схем эрадикационной терапии условно патогенной микрофлоры, основанных на микробиологическом мониторинге, позволит улучшить результаты лечения пациентов с язвенным колитом.
