В последние годы исследованию синдрома эндогенной интоксикации (СЭИ) отводится важная роль. Показано, что эндотоксемия развивается при всех патологических состояниях, связанных с повышенным катаболизмом или блокадой детоксикационных систем организма [1]. В нашей работе мы рассматривали синдром эндогенной интоксикации при воспалительных заболеваниях органов малого таза (ВЗОМТ) – сальпингоофоритах и метроэндометритах с различными вариантами клинического течения. Классическая клиническая симптоматика не всегда встречается при легких и среднетяжелых состояниях, в клинической картине которых могут доминировать такие во многом субъективные проявления эндогенной интоксикации, как быстрая утомляемость, снижение работоспособности, потливость, эмоциональная лабильность и т.д. [5].
Практически при любой патологии и любом неблагоприятном (стрессовом) воздействии на организм активируются процессы свободнорадикального окисления, что приводит к накоплению токсических веществ, которые относят к эндотоксинам. Повышение в сыворотке крови содержания продуктов перекисного окисления липидов (ПОЛ), а также увеличение активности ферментов детоксикации активных форм кислорода являются неспецифическими тестами эндотоксикоза. Кислородные радикалы (супероксидный, гидроксильный, пероксидный), образующиеся в ходе воспаления, обладая высокой реакционной способностью, ускоряют процесс перекисного окисления ненасыщенных жирных кислот [2].
Продукты распада липидов (альдегиды, диальдегиды, эпоксиды) оказывают повреждающее действие на различные структуры клетки, белки, нуклеиновые кислоты и другие структуры, следовательно, являются эндопатогенами [4]. Концентрация малонового диальдегида в сыворотке крови отражает активность процессов перекисного окисления липидов в организме больного, служит маркером степени эндогенной интоксикации [3].
Несмотря на то, что свободнорадикальное окисление липидов непрерывно протекает во всех тканях и органах человека и животных, оно не приводит к развитию радикального повреждения. В норме низкий уровень продукции радикалов-инициаторов и сбалансированная система антиоксидантной защиты приводит к тому, что скорость свободнорадикальных реакций (СРР) ПОЛ клеточных мембран и липопротеидов плазмы крови крайне мала.
В процессе возникновения и развития воспалительных заболеваний этот баланс нарушается, увеличивается эффективность стадии инициации СРР, а с другой стороны, уменьшается активность системы антиоксидантной защиты, что и приводит к ускорению свободнорадикального поражения компонентов клетки и липопротеидов [6].
В настоящее время для оценки состояния антиоксидантной системы организма человека наряду с определением содержания отдельных антиоксидантов в плазме и клетках крови используют показатель, обозначаемый как антиоксидантная активность (АОА) плазмы крови. АОА плазмы (сыворотки) крови - это интегральный показатель, отражающий ее способность противодействовать развитию свободнорадикальных реакций [11].
В процессе воспаления изменяется количество некоторых белков, так называемых, острофазных белков. К ним относится гаптоглобин. Гаптоглобин - это альфа-2-гликопротеин (альфа-2-глобулин), синтезируемый в печени, который прочно связан с гемоглобином. Гаптоглобин повышается при наличии воспалительного процесса, тканевого некроза или малигнизации. Дефицит гаптоглобина в плазме есть следствие гемолиза «in vivo».
Гаптоглобин – специфический белок, участвующий в связывании с гемоглобином и тем самым предохраняющий его от выделения с мочой, что сохраняет очень ценное для организма железо. Результатом может быть повышение, снижение или сохранение нормального уровня белка [4].
Поскольку воспалительные, некробиотические процессы и гемолиз, часто развиваются одновременно, целесообразно оценивать содержание ГП в комплексе с другими показателями, в нашем случае с показателями оценки состояния баланса системы СРР - АОА.
В изученных нами литературных источниках отсутствовали конкретные данные о состоянии ПОЛ и АОС при ВЗОМТ с различной степенью тяжести (лёгкой, средней, тяжёлой) СЭИ, что не соответствует принципу дифференцированного подхода к диагностике и лечению основного заболевания с учётом всех звеньев патогенеза.
Целью исследования явилось совершенствование лабораторной диагностики эндогенного токсикоза и оптимизация терапии.
Дизайн исследования. Было обследовано 77 женщин репродуктивного возраста поступивших в гинекологические стационары г. Пензы и г. Заречный Пензенской области с диагнозами метроэндометрит и сальпингоофорит с различными вариантами клинического течения. Средний возраст обследованных женщин составил 28,6±7 лет.
Критериями включения явилось наличие клинических проявлений в виде жалоб на боли внизу живота, нарушение менструального цикла, повышение температуры тела, дизурические явления. При объективном осмотре обнаруживали болезненность и увеличение при пальпации матки, увеличение, болезненность, тяжистость и другая патология при пальпации придатков, патологические бели, а также общие симптомы эндотоксикоза (гипертермия, тахикардия, озноб, головная боль, диспепсия, общая слабость и т.д.) В исследование не вошли пациентки с послеродовыми осложнениями воспалительного характера. Пациентки, имевшие беременность на фоне ВЗОМТ, а также сопутствующие заболевания воспалительного характера, системные заболевания соединительной ткани и др.
Группу контроля составили 40 здоровых женщин – доноров крови, обратившихся на областную станцию переливания крови. Средний возраст которых был сопоставим с обследуемой группой и составил 30,4±6 лет.
Оборудование и методы исследования. Принципом метода определения малонового диальдегида является взаимодействие тиобарбитуровой кислоты в кислой среде с низкомолекулярными диальдегидами, (главным образом, малоновым), с образованием окрашенного комплекса [9]. Интенсивность которого определялась спектрофотометрически на автоматическом биохимическом анализаторе SABA – 18 M.
Для определения общего антиокислительного статуса плазмы крови использовались тест-системы фирмы Randox. Компонентами тест-систем для определения АОА плазмы крови являются: система генерации радикалов и субстрат или молекула-мишень, которая подвергается свободнорадикальному окислению. Добавление в модельную систему плазмы крови, содержащей различные водо- и жирорастворимые антиоксиданты, приводит к уменьшению образования радикалов и торможению окисления субстрата. Изменение параметров окисления субстрата в присутствии плазмы крови, регистрируемое с помощью полярографии, флуоресцентной и абсорбционной спектроскопии, хемилюминесценции и других методов, используется для характеристики ее АОА [11]. Изменение параметров окисления субстрата в присутствии плазмы крови регистрировалось спектрофотометрически (SABA – 18 M).
Количество гаптоглобина определялось иммунотурбидиметрически. Антитела к гаптоглобину при добавлении к пробам, содержащим гаптоглобин, образуют нерастворимые комплексы. Эти комплексы вызывают изменение абсорбции пропорционально концентрации гаптоглобина в пробе. Тест проводился на автоматическом анализаторе COBAS INTEGRA.
Использовались результаты общеклинических исследований (общий анализ крови, биохимический анализ крови и т.д.).
Полученные результаты обрабатывались с помощью стандартных статистических программ Microsoft Office Exсel 2007. Для всех показателей определяли средние значения (М), а также стандартную ошибку среднего (m). Для оценки степени достоверности различий между группами использовали простой критерий Стьюдента (t). Различия между показателями считали достоверными при p<0,05; 0,01, 0,001. Для множественных сравнений, учитывая небольшое количество групп, использовался дисперсионный анализ и критерий Стьюдента с поправкой Бонферони, k = 3 [10].
Результаты и их обсуждение. Одним из ведущих патогенетических механизмов, приводящих к воспалению, независимо от этиологии, является окислительный стресс. Для обоснования наличия эндогенного токсикоза в организме больных ВЗОМТ исследовано количественное содержание биохимического маркера эндотоксикоза МДА (конечного продукта ПОЛ) в крови пациенток с воспалительными заболеваниями гинекологического профиля.
Среднее значение МДА в исследуемой группе было достоверно выше значений в группе контроля (р=0,001) и свидетельствует об активизации ПОЛ и накоплении МДА. Т.е. уровень малонового диальдегида у лиц с анализируемой патологией превышал нормальные значения на 195,65%, свидетельствуя о чрезмерном усилении процессов пероксидации липидов в организме при ВЗОМТ. В этой связи можно полагать, что избыточная индукция процессов свободнорадикального окисления при ВЗОМТ может рассматриваться как один из биохимических механизмов формирования эндогенной интоксикации при данном заболевании.
В целях разграничения по степени тяжести СЭИ были использованы разработанные Краснопольским В.И. критерии оценки степени интоксикации у больных с гнойно-воспалительными заболеваниям гинекологического профиля [8]. Учитывалось количество лейкоцитов в общем анализе крови, СОЭ, общий белок крови, температура тела [7,8]. Концентрация МДА возрастает по мере увеличения степени тяжести СЭИ.
Выявлено, что концентрация МДА в группе пациенток с лёгкой степенью течения СЭИ при ВЗОМТ составила 161% от нормальных значений, что достоверно выше, чем в группе контроля (p=0,01). Значения МДА при средней и тяжёлой степени нарастали и были достоверно выше (p<0,01;k=3), что составило 195,65% и 229,77% от контрольной группы (рис. 1). Увеличение количества МДА позволяет говорить об интенсификации процессов свободно-радикального окисления и прогрессировании синдрома эндогенной интоксикации.
Вследствие дисбаланса (неэффективность работы первого и второго звена ферментативной антиоксидантной защиты организма) в работе основных звеньев антиоксидантной защиты нарушается обезвреживание активных форм кислорода. Оценивая функцию антиокислительной активности плазмы крови, мы получили следующие результаты.
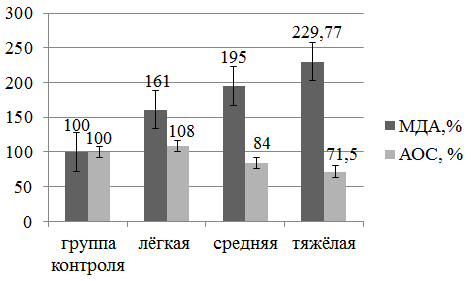
Рис. 1. Средние значения АОС (АОА) и МДА в контрольной группе и группе пациенток с ВЗОМТ (в процентах от контрольной группы)
Статистически незначимым (t=0,28) оказалось различие между средними значениями основной и контрольной групп. АОА уменьшилась по сравнению с контрольной группой всего на 5%.
Однако, при исследовании и сравнении изменений в группах с лёгкой, средней и тяжёлой степени СЭИ при ВЗОМТ (рис. 1) выявлено статистически значимое снижение антиокислительной активности плазмы, по мере утяжеления заболевания (p<0,01; k=3). При этом антиокислительная активность при лёгкой степени тяжести СЭИ была достоверно выше (p<0,01), чем в контрольной группе, чем и объясняется отсутствие статистически значимых различий между средними показателями.
На наш взгляд имеет место «напряжение функции» - увеличение активности антиоксидантов на начальных стадиях процесса развития эндотоксикоза, с целью его компенсации. Дальнейшее действие повреждающего агента (микробный токсин) приводит к усугублению процессов свободнорадикального окисления, в том числе ПОЛ.
У пациенток с лёгкими проявлениями эндотоксикоза уровень АОА был повышен на 8% (компенсация СРР), при средней и тяжёлой стадии процесса АОА снижается на 16% и 28,5% соответственно. Различия между показателями АОС у больных с разной степенью тяжести общего состояния признаны статистически достоверными (p<0,01; k=3) и демонстрируют снижение способности клетки противодействовать развитию свободнорадикальных реакций. По мере увеличения степени тяжести СЭИ нарастали также и общие симптомы эндотоксикоза, такие как общая слабость, лабильность нервной системы, диспепсия, головная боль, озноб, потливость. При этом общая температурная реакция организма в ряде случаев не соответствовала клинической и биохимической картине заболевания.
С целью оценить характер процесса, преобладания того или иного патогенетического фактора СЭИ нами исследованы изменения количества гаптоглобина (ГП). В сыворотке крови исследуемой группы среднее содержание достоверно не отличалось от значений в группе контроля (t=0,16), разница составила 2,9%.
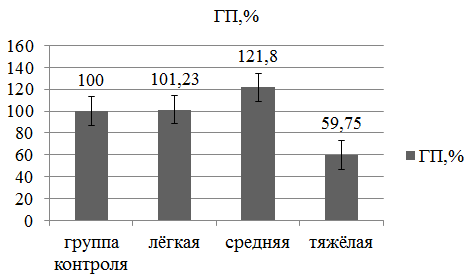
Рис. 2. Содержание ГП в группах с различной степенью тяжести СЭИ при ВЗОМТ по сравнению с контрольной группой в % от основной группы
Рассматривая изменения количества ГП в зависимости от степени тяжести СЭИ при ВЗОМТ оказалось, что при лёгкой степени достоверных различий с группой контроля нет (t=0,44). Разница в процентном выражении составила 1,23%, что, по–видимому, объясняется относительной компенсированностью процесса на данном этапе. В то же время мы видим достоверный рост концентрации ГП при СЭИ средней степени тяжести (p<0,05, k = 3), на 21,8% больше, чем у здоровых женщин. Т.е. на этой стадии можно отметить преобладание воспалительного компонента в патогенезе СЭИ.
Резкое снижение количества ГП у пациенток с тяжёлой степенью СЭИ при ВЗОМТ на 40,25% меньше, чем в группе контроля (p<0,01, k = 3) может объясняться гемолизом, развивающемся по мере усугубления протеолиза в результате прогрессирования пероксидации липидных компонентов клеточных мембран.
Выводы. У больных ВЗОМТ развивается эндогенный токсикоз, в генезе которого играют роль нарушения окислительно-восстановительных процессов в организме.
Нарушения перекисного окисления липидов и антиоксидантной защиты в организме больных следует рассматривать в качестве биохимических механизмов развития эндогенного токсикоза при ВЗОМТ.
Чрезмерная интенсификация процессов перекисного окисления липидов в виде увеличения концентрации вторичных продуктов свободно-радикального окисления и снижение активности антиокислительной системы патогенетически взаимосвязаны между собой, определяя клиническое течение ВЗОМТ. Наиболее выраженные нарушения при ВЗОМТ регистрируются при тяжёлой степени эндогенного токсикоза.
Для комплексной лабораторной оценки биохимических нарушений при ВЗОМТ целесообразно исследование в периферическом кровотоке пациентов продуктов вторичной (малоновый диальдегид) липидной пероксидации и общую антиоксидантную активность крови.
Изменения концентраций ГП говорят о стадийном развитии процесса прогрессирования СЭИ при ВЗОМТ, и преобладании различных факторов патогенеза на каждой стадии.
Разработка современных методов оценки тяжести синдрома эндогенной интоксикации, позволит провести объективную диагностику тяжести состояния больных ВЗОМТ, выбрать оптимальный метод терапии соответственно каждой стадии эндогенной интоксикации и оценить эффективность проводимой терапии.
