Из года в год растет научно-практический интерес к проблемам патологии гемостаза во время беременности. Актуальность этой проблемы в акушерстве связана с тем, что большинство заболеваний во время беременности и ее осложнений обусловлены или сопровождаются изменениями в системе гемостаза. Многочисленные исследования продемонстрировали взаимосвязь генетической тромбофилии с невынашиванием беременности, преэклампсией, задержкой внутриутробного развития плода, преждевременной отслойкой нормально расположенной плаценты [1,2,4].
Наличие тромбофилии у беременной обусловливает активацию прокоагулянтного потенциала крови, в том числе омывающей формирующиеся ворсины хориона, что приводит неполноценной инвазии цитотрофобласта, запаздыванию начала маточно-плацентарного кровообращения и является морфологическим субстратом раннего самопроизвольного выкидыша [3].
В систематическом обзоре [10] делается вывод о том, что имеется положительная связь привычного невынашивания в первом триместре, однократной потери беременности во втором и третьем триместре при наличии тромбофилии, связанной с геторозиготной мутацией фактора V Leiden (FVL) 1691 GA или протромбина (FII) 20210 GA. Носители этих дефектов имели более высокий риск потери плода в первом и втором триместрах, но абсолютный риск все же оставался низким.
В метаанализах данных о тромбофилии и невынашивании сообщается о связи наличия двух или более случаев потери беременности и носительства фактора V Leiden, гомозиготный полиморфизм гена метилентетрагидрофолатредуктазы (MTHFR) 677 ТT не подтвержден как фактор риска [5,6]. В то же время R.P. Murphy (2000), который провел исследование с участием 3020 пациенток, не выявил повышения частоты невынашивания беременности во ІІ триместре, гестоза и задержки внутриутробного развития плода у носителей мутации гена фактора V Лейдена [8]. Противоречие результатов различных исследований наводит на мысль о неточности в оценке степени риска. Возможная причина этого в различном популяционном составе исследуемых групп, различном спектре исследуемых полиморфизмов. Однако, несмотря на разнородность оценки риска невынашивания при том или ином варианте тромбофилии, в литературе есть сообщения об улучшении исходов беременности при проведении антикоагулянтной и антиагрегантной терапии беременным с невынашиванием и наследственной тромбофилией [7,9].
В связи с этим, понятие о степени риска тромбофилии для развития осложнений беременности постепенно трансформируется. Закономерным представляется вопрос, в каких условиях генетический фактор реализуется и становится виновным в развитии патологического состояния? Возможно, чтобы дать ответ на этот вопрос, необходимо усилить внимание к клиническим проявлениям и к тщательному мониторингу состояния свертывающей системы. Особенно это касается женщин с неблагоприятными исходами беременности. Существует мнение о том, что решение о применении антикоагулянтной терапии беременным с неблагоприятными исходами беременностей в анамнезе нужно принимать не на основании наличия врожденной тромбофилии, а на основании неблагоприятного анамнеза. Это мнение базируется на том, что неблагоприятное течение беременности – это проявление материнского фенотипа, которое, как изменения в коагулограмме, отражают протромботическую тенденцию при беременности, приводящую к повреждению плаценты [9].
Исходя из вышесказанного, целью данного исследования стало определение изменений в системе гемостаза у женщин с невынашиванием беременности, ассоциированным с генетическими тромбофилиями.
Материалы и методы исследования. Было обследовано 92 беременных в возрасте от 18 до 44 лет в первом, втором и третьем триместрах беременности. Основную группу составили 58 беременных с синдромом привычной потери плода (СППП), среди которых 52 (89,7%) женщины имели прерывания беременности в первом триместре, у 6 (10,3%) беременность прерывалась во втором и третьем триместрах. Диагноз синдрома потери плода ставился в соответствии с приказом МОЗ Украины № 624 от 3.11.2008 г. Контрольную группу составили 34 соматически здоровых женщин с физиологическим течением беременности и неотягощенным акушерским анамнезом.
Исследование генетических полиморфизмов проведено с помощью алель специфической полимеразной цепной реакции, с последующей детекцией методом лектрофореза в 3% агарозном геле. Для определения наследственных форм тромбофилии (ТФ) проводили исследование генетических полиморфизмов факторов свертывания крови и фибринолиза (1691 G→A FVL, 20210 G→A в гене протромбина (FII), 455 G→A в гене фибриногена (FB)), эндотелиальной дисфункции и фолатного обмена (677 C→T MTHFR) с использованием комплекта реагентов «SNP-экспресс» производства НВФ «Литех» (Россия) для определения полиморфизмов в геноме человека. Для выделения ДНК из лейкоцитов целостной крови использовали реагент «ДНК-экспресс-кровь» (НВФ «Литех», Россия). Результаты анализа дают возможность для каждого из исследуемых полиморфизмов сделать вывод о том, что гомозигота нормальная, гетерозигота или мутантная гомозигота.
Определение количества тромбоцитов проводили с помощью автоматического счетчика крови. Исследование функциональной активности тромбоцитов проводили на агрегометре АР 2110 «СОЛАР» (Белоруссия). Определение показателей системы гемостаза (протромбиновый индекс, активированное частичное тромбиновое время (АЧТВ), уровень фибриногена) проводили на автоматическом коагулометре «Amelung Coagulometr KC 4A» (Trinity Biotech, Ирландия).
Для диагностики тромбофилического состояния определяли растворимые фибрин-мономерные комплексы (РФМК) на основе фенантролинового теста с помощью диагностикума «РФМК-тест» фирмы «Технология-Стандарт» и уровень D-димера иммуно-ферментным методом с использованием латекс-теста «Tina-quant а D-Dimer» («Roche Diagnostics», США) на системе «Roche/Hitachi Сobas c 6000».
Статистическую обработку результатов исследования проводили с использованием пакета программ Statistica v.6.1®. При описании нормально распределенных данных (проверка по критерию Колмогорова-Смирнова) указывали среднее арифметическое и стандартную ошибку среднего (M±m), в противном случае – медиану (Ме) и квартили [25%; 75%]. Для межгруппового сравнения независимых выборок применяли параметрический t-тест Стьюдента или непараметрический U-тест Манна-Уитни, для сравнения зависимых групп – соответствующий критерий Стьюдента или Вилкоксона (Т). Достоверность различий относительных показателей оценивали по критерию Хи-квадрат Пирсона (c2), в том числе с поправкой Йейтса. Результаты считали статистически значимыми при уровне р£0,05.
Результаты и обсуждение. Беременные основной группы не были сопоставимы по возрасту (31,7±0,7 года) с группой контроля (25,8±0,8 года, р<0,001), что обусловлено тем, что текущая беременность у женщин с невынашиванием наступила после нескольких неудачных беременностей и лечения бесплодия. Паритет беременности у женщин основной группы колебался от 2 до 14 и в среднем составлял 3,0 [2,0; 3,0], в то время как в контрольной группе данная беременность была первой у 58,8% женщин, а среднее количество беременностей на одну женщину составляло 1,0 [1,0; 2,0] (р<0,001).
Анализ экстрагенитальной патологии показал высокую частоту соматических заболеваний у пациенток основной группы – 77,6% случаев в основной группе против 41,2% в контрольной группе (р<0,001), среди которых превалировали заболевания мочевыводящих путей – 39,7% против 23,5% (р=0,114), заболевания желудочно-кишечного тракта – 32,8% против 8,8% (р=0,009), нарушение обмена веществ (ожирение) – 20,7% против 2,9% (р=0,041), патология щитовидной железы – 15,5% против 11,8% (р=0,618). Варикозная болезнь вен нижних конечностей и заболевания сердечно-сосудистой системы (артериальная гипертензия, нейроциркуляторная дистония по гипертоническому типу) отмечались только у женщин основной группы – 27,6% (р=0,002) и 15,5% (р=0,040), соответственно.
Гинекологический анамнез был осложнен воспалительными заболеваниями у 72,4% женщин с невынашиванием беременности против 8,8% пациенток контрольной группы (р<0,001), бесплодием – у 22,4% против 11,8% (р=0,204), лейомиомой тела матки – у 12,1% против 2,9% пациенток (р=0,264).
Наследственный анамнез пациенток основной группы был достоверно чаще, чем в контроле, отягощенным, в том числе: гипертонической болезнью 84,5% против 38,2% (р<0,001), заболеваниями сердца (ишемической болезнью, стенокардией) – 70,7% против 23,5% (р<0,001), сахарным диабетом – 62,1% против 8,8% (р<0,001), невынашиванием беременности у матери – 32,8% против 5,9% (р=0,003). Случаи сердечно-сосудистых катастроф (инсульты, инфаркты) и гиперхолестеринемия наблюдались только у родственников пациенток основной группы – 43,1% и 67,2% (р<0,001), соответственно. Перечисленное выше, подтверждает наследственную предрасположенность к патологии эндотелия и системы гемостаза у беременных основной группы, которая может проявляться при беременности акушерскими осложнениями.
Анализ частот генотипов и аллелей 1691 G→A FVL, 20210 G→A FII, 455 G→A FB и 677 C→T MTHFR показал, что они имели существенные отличия (р<0,001) в группах исследования (табл. 1). В основной группе наблюдали патологические гомозиготные мутации по всем маркерам, тогда как в группе контроля таких мутаций не было. Мутация 1691 AA FVL имела место в 1,7% случаев, 20210 AA FII – 1,7%, 455 AA FB – 36,2%, нарушения фолатного обмена (677 TT MTHFR) – в 20,7% случаев. В группе с невынашиванием беременности наблюдали повышение встречаемости гетерозиготных форм 1691 GA FVL в 4,5 раза (39,7% против 8,8%; р=0,002), MTHFR 677 CT – в 2 раза (50,0% против 23,5%; р=0,012). Гетерозиготный полиморфизм FII 20210 GA выявлялся у 39,7% женщин основной группы, в то время как в контрольной группе такие случаи не наблюдались (р<0,001). Частота выявления гетерозиготных форм FB 455 GA в группах исследования была сопоставимой – 29,3% и 23,5% (р=0,547).
Изучение показателей сосудисто-тромбоцитарного звена гемостаза крови у обследованных беременных обеих групп в первом триместре беременности (табл. 2) показало отсутствие достоверных различий в количестве тромбоцитов (p=0,443), но в процессе беременности отмечена тенденция к снижению уровня тромбоцитов в основной группе по сравнению с первым триместром (p=0,059 в III триместре).
Таблица 1. Результаты исследования генетических полиморфизмов факторов свертывания крови и фибринолиза, (абс., %)
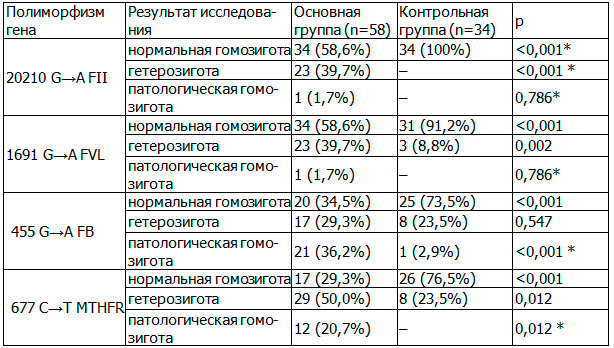
Примечание: р – уровень значимости различий показателей между группами по критерию c2 (* – с поправкой Йейтса).
Таблица 2. Динамика основных показателей системы гемостаза у женщин с невынашиванием беременности, ассоциированном с генетическими тромбофилиями (M±m или Ме [25%; 75%])
![Таблица 2. Динамика основных показателей системы гемостаза у женщин с невынашиванием беременности, ассоциированном с генетическими тромбофилиями (M±m или Ме [25%; 75%])](/images/articles/2015/2.0/15045/t2.png)
Примечания: * – р<0,05 в основной группе по сравнению с I триместром по критерию Стьюдента или Вилкоксона (Т) для зависимых выборок; # – p<0,05 по сравнению с контрольной группой по критерию Стьюдента (t) или Манна-Уитни (U) для независимых выборок.
Изучение показателей коагуляционного звена гемостаза в первом триместре позволило определить следующие отличия в основной группе в сравнении с группой контроля (табл. 2). Установлено достоверное снижение среднего показателя международного нормализованного отношения (МНО) на 7,1% (0,953±0,018 против 1,026±0,008, р=0,002), протромбинового индекса – на 5,8% (91,4±1,7% против 97,0±1,1%, р=0,023), АЧТВ – на 17,0% (25,9±0,5 сек против 31,2±0,5 сек, р<0,001), и повышение среднего уровня D-димера на 20,0% (0,60 [0,50; 0,90] против 0,50 [0,40; 0,50] мкг ФЕО/мл, р<0,001). Уровни фибриногена, РФМК, фибринолитической активности не имели достоверных различий у беременных основной и контрольной группы в первом триместре (при всех сравнениях р>0,30).
В динамике беременности отмечено увеличение концентрации фибриногена в основной группе в сравнении с первым триместром на 22,4% (с 3,48±0,13 до 4,26±0,26 г/л, р=0,006), уровня РФМК – на 20,3% (с 12,87±0,72 до 15,48±0,88 мг/100 мл, р=0,022), протромбинового индекса – на 6,1% (с 91,4±1,7 до 97,0±1,9%, р=0,030), а также снижение МНО на 7,5% (с 0,953±0,018 до 0,882±0,018, р=0,007).
Выводы
Таким образом, беременных с патологическими генотипами и аллелями 1691 G→A FVL, 20210 G→A FII и 677 C→T MTHFR следует относить к группе риска развития невынашивания беременности и акушерских осложнений.
При изучении показателей сосудисто-тромбоцитарного звена гемостаза крови следует обращать внимание на падение уровня тромбоцитов в процессе беременности, что является неблагоприятным маркером в диагностике гиперкоагуляции и вынашивания беременности.
Полученные результаты исследования коагуляционного звена гемостаза позволяют выявить беременных с гиперкоагуляционным синдромом, которые формируют группу риска развития невынашивания беременности и акушерских осложнений (это данные исследования уровня D-димера, МНО, протромбинового индекса и АЧТВ) с целью пересмотра тактики наблюдения беременных с угрозой прерывания беременности и коррекции медикаментозного лечения.
Перспектива дальнейших исследований заключается в разработке тактики ведения беременных с генетическими тромбофилиями для профилактики невынашивания беременности.
